
- •Бийский технологический институт (филиал)
- •Р.Н. Питеркин, р.Ш. Просвирнин, е.А. Петров технология нитроэфиров и нитроэфирсодержащих промышленных вв
- •Содержание
- •Введение
- •Часть I. Нитроэфиры
- •1 Историческая справка о развитии промышленных способов производства нитроглицерина
- •2 Современные способы производства нитроэфиров
- •2.1 Оптимальные составы кислот и модули нитрации
- •2.2 Инжекторы для осуществления нитрационного
- •2.3 Холодильники для охлаждения эмульсии
- •2.4 Центробежные сепараторы для разделения эмульсии нитроэфир–отработанная кислота
- •2.5 Процесс и оборудование для стабилизации
- •2.6 Весовой дозатор-расходомер нитроэфиров
- •2.7 Насосы для транспортирования отработанных
- •2.8 Технологическая схема производства нитроэфиров в малогабаритном оборудовании
- •3 Вспомогательные стадии процесса производства нитроэфиров
- •3.1 Разложение нитротел в отработанных кислотах
- •3.2 Обезвреживание сточных вод производства
- •3.2.1 Адсорбционный способ обезвреживания
- •3.2.2 Автоклавный способ очистки сточных вод
- •3.2.3 Восстановление нитроэфиров
- •3.2.4 Электрохимический метод обезвреживания
- •3.2.5 Сверхкритическое водное окисление
- •3.3 Приборы для непрерывной оценки качества нитроэфиров
- •I, мA 0,1 % hno3 0,03 % hno3 0,01 % hno3
- •0,2 0,4 0,6 Содержание н2о, %
- •4 Свойства нитроэфиров
- •4.1 Физические свойства нитроэфиров
- •4.2 Взрывчатые свойства нитроэфиров
- •4.3 Поведение нитроэфиров в кислых средах
- •4.3.1 Стойкость кислых нгц, дндэг и их смеси
- •4.3.2 Стойкость кислых динитрата триэтиленгликоля, тринитрата нитроизобутилглицерина и динитрата
- •4.3.3 Влияние воды на стойкость кислых нитроэфиров
- •4.3.4 Влияние серной и азотной кислот
- •4.3.5 Влияние окислов азота
- •4.3.6 Стойкость нгц и дндэг с пониженной
- •4.3.7 Механизм разложения кислых нитроэфиров
- •4.3.8 Разложение нитроэфиров в отработанных
- •4.3.9 Разложение нитротел в слабых отработанных кислотах
- •4.4 Реакции нитроэфиров с основаниями
- •4.4.1 Гидролиз нитроглицерина
- •4.4.2 Гидролиз динитрата этиленгликоля (днэг)
- •4.4.3 Гидролиз динитрата диэтиленгликоля (дндэг)
- •4.5 Причины аварий на производствах нитроэфиров
- •Литература
- •Часть II. Нитроэфирсодержащие взрывчатые вещества
- •5 Технология производства нитроэфирсодержащих взрывчатых веществ
- •5.1 Современные направления развития
- •5.2 Разработка технологии и создание
- •Фаза подготовки компонентов
- •Фаза конечных операций
- •5.3 Автоматизация производства
- •5.4 Экологическая защита производства
- •5.4.1 Разработка эффективных методов
- •5.4.2 Технико-экономические показатели производства
- •6 Оптимизация и модернизация штатных рецептур нитроэфирсодержащих вв
- •6.1 Оптимизация угленита э-6
- •6.2 Исследование предохранительных свойств
- •6.3 Разработка и исследование угленита м – новой рецептуры вв V класса [15]
- •6.4 Модернизация детонита м
- •6.4.1 Разработка рецептуры модернизированного
- •6.4.2 Отработка технологии модернизированного
- •6.4.3 Промышленные испытания модернизированных детонитов [24]
- •7 Некоторые аспекты безопасности нитроэфирсодержащих вв
- •7.1 О химической стабильности и предельных сроках хранения нитроэфирсодержащих промышленных вв
- •7.2 О чувствительности нитроэфирсодержащих
- •7.3 О физической стабильности
- •Литература
- •Сокращения и обозначения
4.4.1 Гидролиз нитроглицерина
Кармышов В.Ф. [70] омылял нитроглицерин (НГЦ) при 50 °C содовыми растворами различной концентрации (рисунок 4.8). Растворённый в 8 %-ном растворе соды НГЦ полностью омыляется в течение 30 минут.
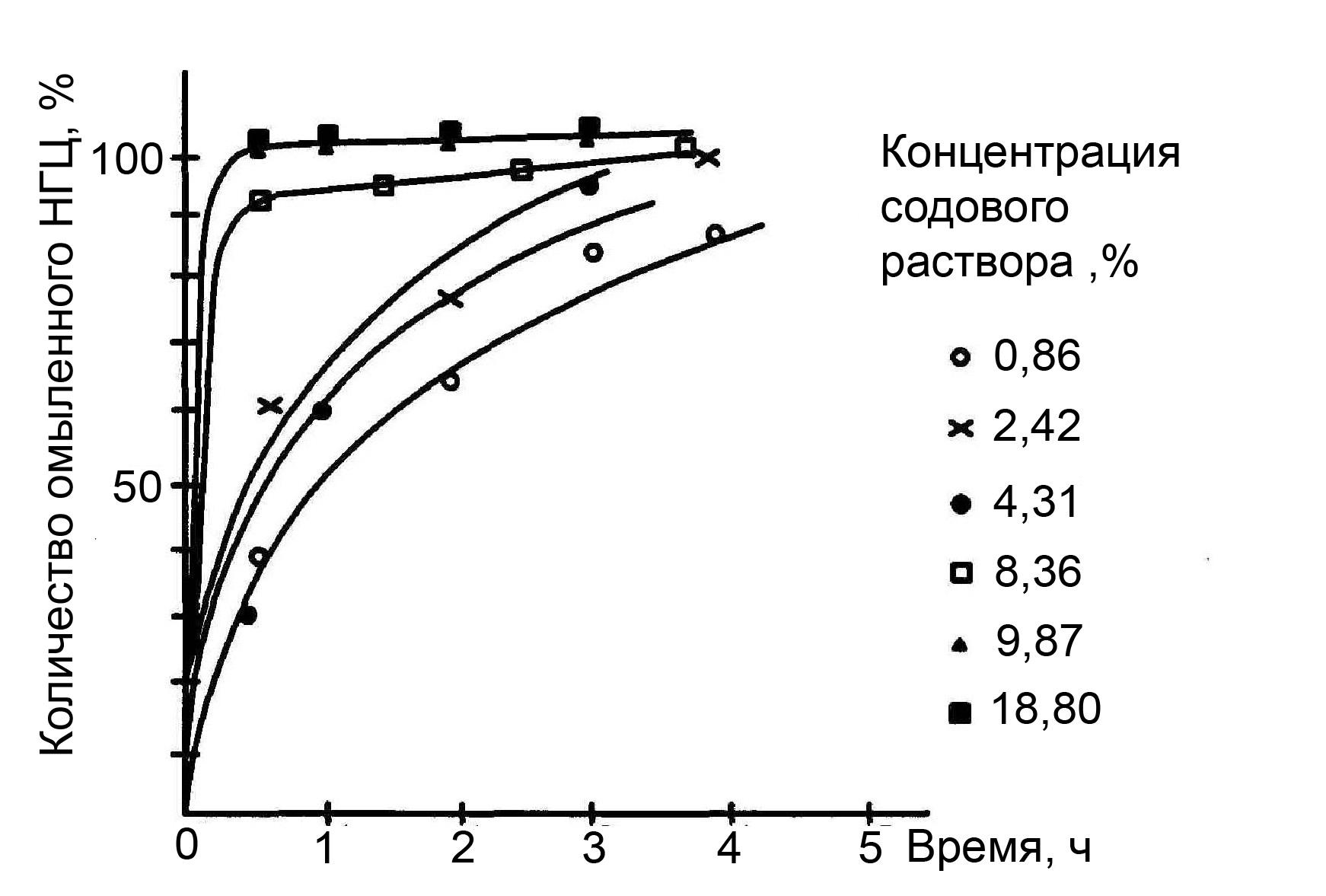
Рисунок 4.8 – Омыление НГЦ при 50 ºС содовыми растворами
Кеппелос
с сотрудниками [71] гидролизовали
нитроглицерин в водных растворах
Ca(OH)2.
Моно- и динитраты глицерина в продуктах
реакции не обнаружены. При гидролизе
1,2- и 1,3-динитратов глицерина промежуточным
продуктом является нитрат глицидола.
Соотношение между количеством
![]() и
и![]() равно 2:1. Около 7 % НГЦ превращается в
оксолат кальция. Попытка идентификации
органических соединений после упаривания
раствора, экстракции, ионного обмена
была мало успешной.
равно 2:1. Около 7 % НГЦ превращается в
оксолат кальция. Попытка идентификации
органических соединений после упаривания
раствора, экстракции, ионного обмена
была мало успешной.
В
работе [72] нитроглицерин вводили в
растворы NaOH
концентрацией 0,001N
и 0,1N
(pH
11,0 и 13,0 соответственно). НГЦ использовали
в виде адсорбатов на лактозе – 1 мг/мл
адсорбата. В отличие от предыдущей
работы авторы утверждают, что первичными
продуктами гидролиза являются 1,2- и
1,3-динитраты глицерина, есть следы
мононитрата. Например, при pH
13 через 10 мин разложилось 34,6 % НГЦ и
получилось 6,6
% 1,2-ДНГ, 25,2 % 1,3-ДНГ и 30,3 %
![]() ,
,![]() не обнару-жено.
не обнару-жено.
В течение 30 мин наблюдали снижение концентрации 1,2-ДНГ и рост концентрации 1,3-ДНГ.
Видимо, здесь сказывается присутствие лактозы в концентрациях, в 9 раз больших, чем НГЦ. Авторы указывают на появление восстановленного глутатиона.
Многими авторами отмечается, что НГЦ в растворах щёлочи омыляется с выделением примерно 2 моль нитрита натрия и 1 моля нитрата натрия, при этом расходуется 5 моль NaOH на 1 моль НГЦ. Следовательно, здесь играют большую роль реакции выделения водорода из углерода, несущего нитратную группу (-элиминирование), с образованием альдегидов или кетонов, которые в щелочной среде не могут сохраняться в неизменном виде. Они вступают в реакции конденсации, образуя высокомолекулярные продукты (альдегидные смолы), превращаются в оксикислоты по реакции Канницаро и т.д. Именно на эти вторичные реакции расходуется дополнительно 2 моль щёлочи сверх теоретически необходимых трёх моль.
Выполненные нами кинетические исследования по гидролизу НГЦ в щёлочных растворах показали, что накопление в растворе нитритов и нитратов начинается сразу после введения НГЦ в раствор, конец реакции характеризуется прекращением выделения этих продуктов и прекращением расходования щёлочи. Следовательно, вторичные реакции щёлочи с продуктами гидролиза идут несравненно с более высокими скоростями, нежели непосредственный гидролиз. Эти продукты не могут быть обнаружены или выделены в первоначальном виде.
Соотношение нитритов и нитратов в ходе реакции остаётся постоянным, хотя абсолютная величина его колеблется от 1,6 до 2,6. Оно связано с изменением температуры и, соответственно, с различием в величинах энергии активации отдельных реакций. Влияние концентрации щёлочи обусловлено изменением скоростей реакции полупродуктов гидролиза НГЦ со щёлочью.
Поскольку для НГЦ возможна реализация всех моделей гидролиза, существование которых подтверждено при гидролизе простых нитратов, то в качестве промежуточных продуктов можно было ожидать образование моно- и динитратов глицерина, моно- и динитратов глицеринового альдегида или диоксиацетона, а также продуктов их последующего превращения. Поэтому предварительно исследован гидролиз этих нитроэфиров. Полученные результаты позволили убедительно показать, по какому механизму гидролиза проходит первая скорость, определяющая стадия этого процесса.
α,γ-Динитрат глицерина (ДНГ) гидролизуется в основном по двум направлениям одновременно с выделением 1,95 моль нитрата из 1 моль ДНГ. Это образование нитрата глицидола (НГл) и мононитрата глицерина (МНГ). При пониженной температуре и щёлочности раствора образуется больше МНГ, а с ростом температуры и щёлочности в основном образуется нитрат глицидола. 2,5 % ДНГ гидролизуется до нитрата глицеринового альдегида, выделяя 0,05 моль нитрита и 0,005 моль аммиака.
Нитрат глицидола далее одновременно гидролизуется до глицидола и гидратируется до мононитрата глицерина. При pH 8 скорости этих реакций одинаковы, а при pH 9 85 % НГл превращается в глицидол и 15 % в МНГ. Весь азот нитратной группы выделяется в виде нитрата.
α-Мононитрат глицерина гидролизуется только в направлении образования глицидола, который далее гидратируется с раскрытием цикла до глицерина. Весь азот также выделяется в виде нитрата.
Таким
образом, α,γ-динитрат глицерина почти
целиком в щелочной среде превращается
в глицерин с выделением 2 моль
![]() .
Поскольку при гидролизе нитроглицерина
образование глицерина не обнаруживается,
то ДНГ не может быть промежуточным
продуктом гидролиза НГЦ.
.
Поскольку при гидролизе нитроглицерина
образование глицерина не обнаруживается,
то ДНГ не может быть промежуточным
продуктом гидролиза НГЦ.
Следующим промежуточным продуктом гидролиза НГЦ могут быть динитраты глицеринового альдегида и диоксиацетона, которые образуются по механизму выделения α-водорода, несущего нитратную группу (ECO2). При этом азот выделяется в виде нитритов.
Из 1 моль динитрата глицеринового альдегида (ДНГА) выделяется около 2 моль нитрата натрия, а количество нитрита натрия колеблется от 0,002 до 0,14 моль. Расход щёлочи сначала совпадает с количеством образующихся нитрат-ионов, затем начинает преобладать, достигая 2,72 моль на 1 моль ДНГА и более. Гидролиз идёт одновременно в двух направлениях: до мононитрата глицеринового альдегида (механизм SN2) и до нитрата оксиакрилового альдегида (механизм E2), причём второе направление преобладает. Далее оба этих продукта гидроли-зуются по механизму нуклеофильного замещения SN2 уже с меньшей скоростью. Конечные продукты – глицериновый альдегид, оксиакриловый альдегид и его изомер диоксиацетон. Превращения глицеринового альдегида в щелочной среде исследованы в работе [73]:
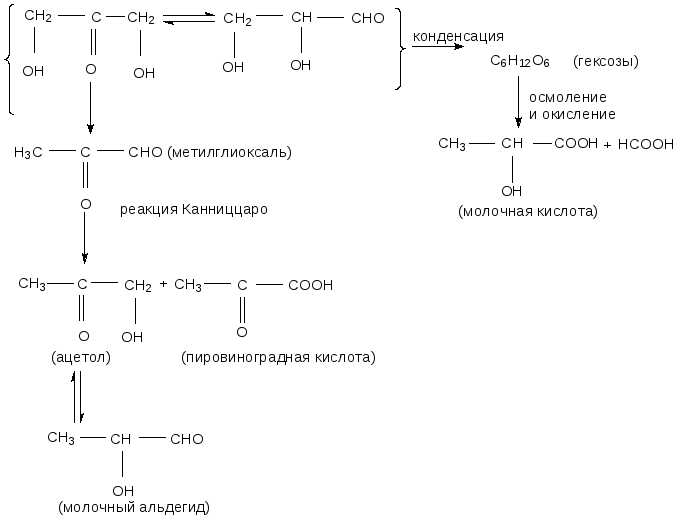
Динитрат диоксиацетона (ДНДА) весьма нестойкое соединение, в щелочной среде гидролизуется чрезвычайно быстро, что затрудняет кинетические исследования. Тем не менее показано, что итогом полного гидролиза ДНДА является выделение примерно равных количеств нитритов и нитратов. Причём сначала скорость выделения нитритов выше, затем ниже, чем нитратов, и только к концу реакции их количества становятся равными. Продукты гидролиза по структуре близки к продуктам гидролиза динитрата глицеринового альдегида.
На основании представленных моделей гидролиза возможных промежуточных продуктов гидролиза НГЦ ясно, что механизм нуклеофильного замещения в качестве первой стадии гидролиза неприемлем.
Возможны только Е2 и ЕСО2 механизмы по следующим направлениям:
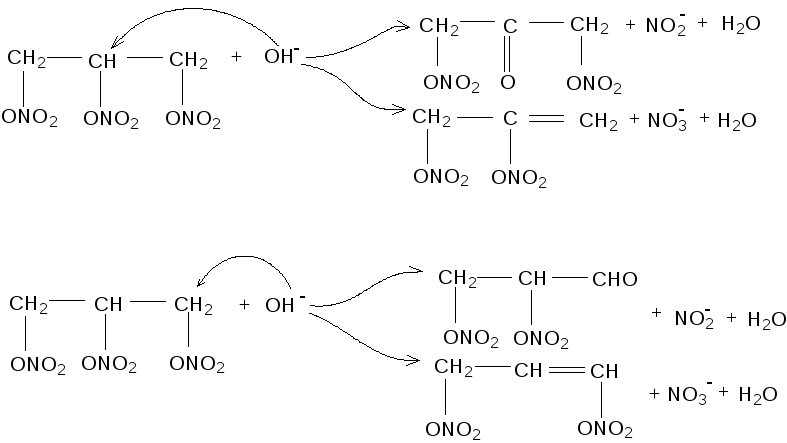
Анализ гидролизуемых растворов на содержание олефинов с использованием брома по методике [74] показал, что из 1 моль НГЦ образуется от 0,04 до 0,15 моль олефинов. Следовательно, основным направлением гидролиза НГЦ являются реакции α-элиминирования водорода с образованием динитратов диоксиацетона или глицеринового альдегида. Альдегиды и кетоны качественно обнаруживаются в реакционной среде реакцией серебряного зеркала с азотнокислым серебром и аммиаком в щёлочной среде, а также реакцией с бисульфитом натрия.
Из результатов гидролиза динитрата глицеринового альдегида следует, что он не может быть промежуточным продуктом при гидролизе НГЦ. Иначе из НГЦ образовывалось бы 2 моль нитрат-иона и только 1 моль нитрит-ионов, что не подтверждается экспериментами. Основным продуктом первой стадии гидролиза НГЦ является динитрат диоксиацетона, что подтверждается соотношением в продуктах реакции нитрит- и нитрат-ионов. У НГЦ 2:1, у ДНГА 1:1.
Также проведён ряд экспериментов по контролю за содержанием НГЦ в растворе полярографическим методом при добавлении гидроокиси тетрабутиламмония, который восстановление первичных и вторичных нитратных групп у НГЦ разделяет на две волны, давая информацию о скоростях исчезновения нитратных групп у первичного и вторичного углеродов.
На рисунке 4.9 представлены кинетические кривые гидролиза НГЦ при 35 °C. Константы скорости гидролиза приведены в таблице 4.21.
группы
Рисунок 4.9 – Кинетические кривые расходования НГЦ и образования NaNO2 и NaNO3 при гидролизе: t=35 ºС,
[NaOH] = 7610-4 моль/л, [НГЦ] = 7,3710-4 моль/л
Таблица 4.21 – Константы скорости гидролиза НГЦ
по первичным и вторичным нитратным группам
|
Температура, °C |
Константа скорости гидролиза, л/моль·с | |
|
по вторичной нитратной группе |
по первичным нитратным группам | |
|
35 40 45 50 55 60 |
0,0304 0,0403 0,070 0,088 0,10 0,248 |
0,0187 0,0307 0,0444 0,0540 0,060 0,185 |
Условия экспериментов: начальная концентрация НГЦ 7,32 моль/л, начальная концентрация NaOH 64,5–75,9 моль/л.
Очевидно, что гидролиз НГЦ идёт по вторичной нитратной группе через динитрат диоксиацетона.
В производственных условиях стабилизацию НГЦ проводят в щелочных растворах, приготавливаемых с применением кальцинированной соды. В этих растворах концентрация ионов гидроксила определяется как температурой, так и значением констант диссоциации этой соли. Кроме того, в растворе присутствует второй нуклеофильный агент – бикарбонатный ион, концентрация которого равна концентрации гидроксильных ионов и, следовательно, он может участвовать в гидролитических реакциях с НГЦ.
Эксперименты
с растворами соды проводились при
постоянном значении величины рH
за счёт дозировки содового раствора в
ходе гидролиза НГЦ. Кинетические кривые
роста концентрации
![]() и
и![]() и расхода соды обрабатывались по закону
скорости 1-го порядка. Полученные значения
пересчитаны на константы скорости 2-го
порядка делением их на концентрацию
ионов гидроксила в растворе (таблица
4.22). В нескольких опытах в исходный
раствор введены нитрит и нитрат натрия,
которые увеличивают ионную силу раствора
и присутствуют в реальных условиях
стабилизации НГЦ.
и расхода соды обрабатывались по закону
скорости 1-го порядка. Полученные значения
пересчитаны на константы скорости 2-го
порядка делением их на концентрацию
ионов гидроксила в растворе (таблица
4.22). В нескольких опытах в исходный
раствор введены нитрит и нитрат натрия,
которые увеличивают ионную силу раствора
и присутствуют в реальных условиях
стабилизации НГЦ.
Таблица 4.22 – Константы скорости гидролиза НГЦ
в содовом растворе
|
Условия опыта |
K, л/моль·с |
Соотношение
| ||
|
по Na2CO3 |
по
|
по
| ||
|
PH 9; 73°C |
- |
1,66 |
1,60 |
1,65/1,35 |
|
PH 9; 72°C |
0,88 |
0,89 |
0,89 |
1,75/1,25 |
|
PH 9,2; 70°C; 2,15
моль/моль
|
- |
- |
1,07 |
1,95/1,05 |
|
PH 9,15; 70°C; 1,39
моль/моль
|
- |
1,18 |
0,86 |
1,95/1,05 |
|
PH 9,15; 70°C; 1,0
моль/моль
|
1,34 |
0,85 |
0,97 |
1,95/1,05 |
|
PH 9; 70°C; 2,0
моль/моль 1,2
моль/моль
|
1,19 |
1,37 |
1,19 |
1,65/1,35 |
По сравнению с гидролизом в растворах NaOH гидролиз в растворах соды в ряде опытов отличается изменением соотношения нитритов и нитратов в пользу последних. Это могло быть связано с участием в реакциях гидролиза бикарбонатных ионов с образованием эфиров угольной кислоты. Присутствие нитритов и нитратов не влияло на скорость реакции. Расход соды при pH 9 во всех опытах составлял 5 моль/моль НГЦ. Следовательно, в этих условиях сода гидролизуется только до бикарбоната с выделением одного моля ионов гидроксила. При снижении pH до 7, когда будет замечена вторая ступень гидролиза соды до карбонатных ионов с выделением второго гидроксила, максимальный расход соды должен снижаться до 2,5 моль/моль НГЦ.
В отличие от водных щелочных растворов проведение гидролиза НГЦ в 80 %-ном этиловом спирте без добавления в него едкого натра сопровождается изменением механизма этого процесса. Присутствующие в низких концентрациях этокси-анионы, являясь достаточно сильными нуклеофильными агентами, гидролизуют НГЦ до α,γ-динитрата глицерина, концентрация которого при 75 °C со временем возрастала, одновременно выделялся нитрат натрия.
Вероятные направления идущего с большими скоростями гидролиза динитрата диоксиацетона могут быть представлены в следующем виде:
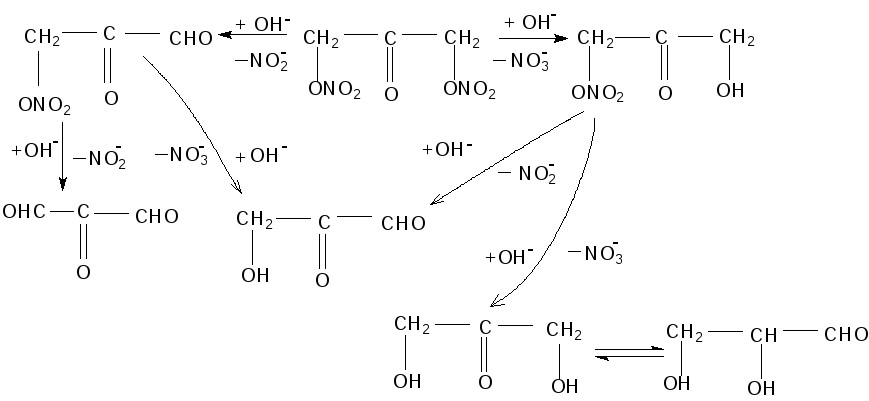
Образующиеся оксикетоны, оксиальдегиды и смешанный диальдегидкетон в щелочной среде вступают в реакции конденсации с образованием смолистой массы, окрашенной в светлокоричневый цвет.
Межмолекулярная и внутримолекулярная реакция Канниццаро ведёт к образованию оксикислот:
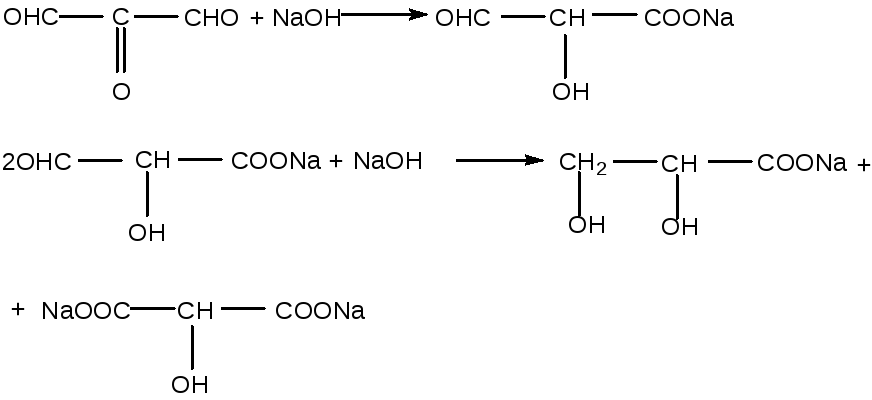
Выделение CO2 из поликислот ведёт к образованию оксикислот или кислот с меньшей длиной углеродного скелета. В частности, обнаружено образование 0,1 моль щавелевой кислоты.
