
- •Оглавление
- •Введение (как пользоваться учебно-методическим пособием)
- •Занятие № 1 классификация, номенклатура и структурная изомерия органических соединений. Электронное строение атомов элементов-органогенов
- •Блок информации
- •Классификация соединений по строению углеродного скелета
- •Важнейшие классы органических соединений
- •Построение названия органического соединения
- •Пример названия по заместительной номенклатуре iupac
- •Характеристические (функциональные) группы, их обозначение по номенклатуре iupac и соответствующие им классы органических соединений
- •Названия важнейших углеводородных радикалов
- •Валентное состояние и строение атома углерода в алифатических углеводородах
- •Правила техники безопасности при работе в химической лаборатории
- •Занятие № 2 химическая связь в органических молекулах. Классификация химических реакций. Реакционная способность алканов. Алкенов и алкадиенов
- •План изучения темы
- •Бромирование непредельных соединений
- •Окисление алкенов в мягких условиях (реакция Вагнера)
- •Блок информации
- •Типы химических связей атомов в молекулах органических соединений
- •Характеристика ковалентных связей
- •Свойства насыщенных углеводородов (алканов)
- •Свойства ненасыщенных углеводородов ряда этилена (алкенов)
- •Блок информации для выполнения самостоятельной работы
- •Конформации молекул алифатических углеводородов
- •Вопросы для тестового контроля
- •Занятие № 3 взаимное влияние атомов в молекулах органических соединений. Реакционная способность ароматических углеводородов
- •Влияние заместителей на последующее электрофильное замещение в ароматическом ядре
- •Вопросы для тестового контроля
- •Занятие № 4 химические свойства галогеналканов, спиртов и фенолов
- •План изучения темы
- •Получение этилхлорида из этилового спирта
- •Дегидратация этилового спирта
- •Свойства фенолов
- •Указания по выполнению самостоятельной работы № 2
- •Указания по выполнению самостоятельной работы № 3
- •Вопросы для тестового контроля
- •Заполните схему!
- •15. Возрастание кислотных свойств соединений:
- •Реакции окисления спиртов
- •31. Заполните схему!
- •Заполните схему!
- •Занятие № 5 кислотно-основные свойства органических соединений. Реакционная способность аминов
- •Получение этиленгликолята меди (II)
- •Образование фенолята натрия и разложение его кислотой
- •Сравнение основности алифатических и ароматических аминов
- •Блок информации
- •Значения pKa некоторых кислот Бренстеда
- •Кислотность различных классов соединений
- •Свойства первичных алифатических аминов
- •Вопросы для тестового контроля
- •3. Метиламин
- •Занятие № 6 реакционная способность оксосоединений
- •План изучения темы
- •Диспропорционирование формальдегида в водных растворах
- •Отношение ацетальдегида и ацетона к окислению щелочными растворами оксидов тяжёлых металлов
- •Открытие ацетона переводом его в йодоформ
- •Блок информации
- •Свойства альдегидов
- •Вопросы для тестового контроля
- •Занятие № 7 химические свойства карбоновых кислот и их функциональных производных
- •План работы на предстоящем занятии
- •Открытие щавелевой кислоты
- •Получение этилацетата
- •Блок информации
- •Свойства насыщенных монокарбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Производные угольной кислоты
- •Указания по выполнению самостоятельной работы № 4
- •Вопросы для тестового контроля
- •Занятие № 8 итоговое занятие по теме «гомофункциональные производные углеводородов»
- •Занятие № 9 гетерофункциональные алифатические соединения - метаболиты и биорегуляторы
- •Доказательство наличия двух карбоксильных групп в винной кислоте
- •Доказательство наличия гидроксильных групп в винной кислоте
- •Блок информации
- •Классификация кислород- и азотсодержащих гетерофункциональных соединений
- •Свойства α-гидроксикислот
- •Специфические свойства α-, β-, γ-гидроксикислот
- •Свойства α-аминокислот
- •Специфические свойства α-, β-, γ-аминокислот
- •Вопросы для тестового контроля
- •Занятие № 10 гетерофункциональные соединения бензольного ряда. Биологически активные производные пятичленных гетероциклических соединений
- •Свойства пятичленных гетероциклов с одним гетероатомом (π-избыточных систем)
- •Свойства пятичленных гетероциклов с двумя гетероатомами
- •Электронное строение молекулы пиррола
- •Типы атомов азота в гетероциклах
- •Указания по выполнению самостоятельной работы № 6
- •Указания по выполнению самостоятельной работы № 7
- •В опросы для тестового контроля
- •Занятие № 11 Биологически важные производные шестичленных гетероциклов. Производные пурина
- •Растворимость мочевой кислоты и её натриевой соли в воде
- •Открытие мочевой кислоты (мурексидная проба)
- •Блок информации
- •Свойства шестичленных гетероциклов (π-недостаточных систем)
- •Электронное строение молекулы пиридина
- •Задания для тестового контроля
- •Занятие № 12 итоговое занятие по теме «метаболиты и родоначальники важнейших групп лекарственных препаратов»
- •Занятие № 13 углеводы. Моносахариды
- •Доказательство наличия гидроксильных групп в глюкозе
- •Восстановление гидроксида меди (II) глюкозой в щелочной среде (проба Троммера)
- •Восстановление аммиачного раствора оксида серебра глюкозой (реакция Толленса, реакция «серебряного зеркала»)
- •Химические свойства глюкозы (продолжение)
- •Химические свойства глюкозы (продолжение)
- •Вопросы для тестового контроля
- •Занятие № 14 углеводы. Дисахариды и полисахариды
- •Сравнение свойств лактозы и сахарозы
- •Качественная реакция на крахмал
- •Блок информации
- •Классификация полисахаридов
- •Указания по выполнению самостоятельной работы № 8
- •Задания для тестового контроля
- •Занятие № 15
- •Реакция на присутствие серусодержащих α-аминокислот
- •Блок информации
- •Классификация аминокислот белков
- •Основные виды взаимодействий, фиксирующих вторичную и третичную структуру пептидов и белков
- •Указания по выполнению самостоятельной работы № 9
- •Вопросы для тестового контроля
- •Занятие № 16 нуклеиновые кислоты. Омыляемые липиды
- •Щелочной гидролиз (омыление) жира
- •Занятие № 17 итоговое занятие по теме «углеводы, аминокислоты, пептиды, белки, нуклеиновые кислоты, омыляемые липиды»
- •Занятие № 18 стероиды. Алкалоиды. Зачёт по практическим навыкам
- •План изучения материала
- •Общие реакции на алкалоиды
- •Блок информации
- •Родоначальные структуры стероидов
- •Классификация алкалоидов
- •Перечень практических навыков, выносимых на зачётное занятие
- •Примерные экзаменационные вопросы по биоорганической химии
- •Литература Основная
- •Дополнительная
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3.
Диспропорционирование формальдегида в водных растворах
Поместите в пробирку 2-3 капли формалина. Добавьте 1 каплю 0,2% раствора индикатора метилового красного. Покраснение раствора указывает на кислую реакцию среды.
Напишите схему реакции диспропорционирования формальдегида. Образование какого соединения обусловливает кислую реакцию среды? Характерна ли подобная реакция для водных растворов уксусного альдегида? Почему?
Отношение ацетальдегида и ацетона к окислению щелочными растворами оксидов тяжёлых металлов
Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»). Приготовьте аммиачный раствор оксида серебра. Для этого в пробирку поместите 2 капли раствора нитрата серебра, добавьте 2 капли 2н раствора гидроксида натрия и к полученному бурому осадку прибавьте 10% водный раствор аммиака до его полного растворения. Полученный раствор разделите на две пробирки. В 1-ю пробирку прибавьте 2 капли ацетальдегида, а во 2-ю – 2 капли ацетона. Осторожно нагрейте пробирки, не допуская кипения жидкости. Что вы наблюдаете? Объясните разный результат реакции в двух пробирках. Запишите схемы всех протекающих реакций.
Окисление гидроксидом меди (II). Поместите в две пробирки по 5 капель 2н раствора гидроксида натрия и воды, добавьте по 1 капле 2% раствора сульфата меди (II). К выпавшему осадку гидроксида меди (II) прибавьте в 1-ю пробирку 3 капли ацетальдегида, во 2-ю – 3 капли ацетона. Нагрейте пробирки. Что вы наблюдаете? Объясните разный результат реакции в двух пробирках. Запишите схемы всех протекающих реакций.
Открытие ацетона переводом его в йодоформ
В пробирку поместите 1 каплю раствора йода в йодиде калия и прибавьте по каплям 2н раствор гидроксида натрия почти до полного обесцвечивания раствора. К полученному раствору добавьте 1 каплю ацетона и нагрейте пробирку теплом рук. Зафиксируйте наблюдаемый результат реакции.
Запишите схему реакции образования йодоформа. Какие ещё соединения можно обнаружить с помощью йодоформной пробы? Как используется йодоформная проба на ацетон в клинических исследованиях?
Блок информации
Граф 13
Свойства альдегидов







АЛЬДОКСИМЫ R-CH=N-OH
СПИРТЫ R-CH2-OH

ГИДРАТЫ R-CH(OH)2
ГИДРАЗОНЫ,
ФЕНИЛГИДРА-ЗОНЫ R-CH=N-NH2 R-CH=N-NH-C6H5
ОКСИНИТ-РИЛЫ

HCN,OH-
ИМИНЫ R-CH=NH
R-CH=N-R’
ПОЛУАЦЕ-ТАЛИ,
АЦЕ-ТАЛИ
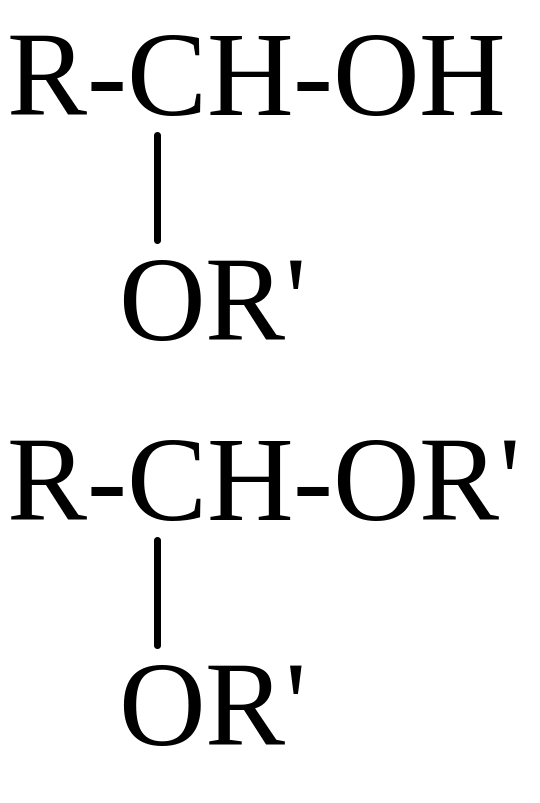
R’OH,
 HCl
HCl


Cu(OH)2
Ag(NH3)2OH

КАРБОНОВЫЕ
КИСЛОТЫ R-COOH

АЛЬДОЛИ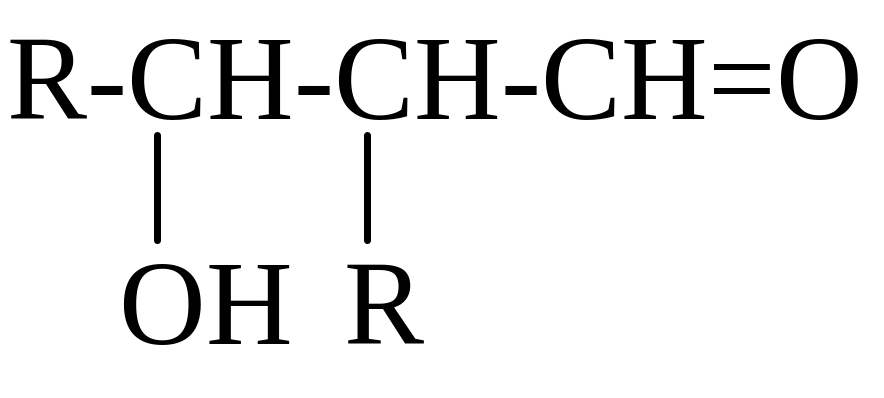
R-CH=O
OH-
