
- •Химия, ч. 2. Органическая химия
- •1. Информация о дисциплине
- •Предисловие
- •Место дисциплины в учебном процессе.
- •Содержание дисциплины и виды учебной работы
- •Содержание дисциплины по гос
- •Объем дисциплины и виды учебной работы
- •Раздел 1. Общие вопросы теоретической органической химии
- •1.2. Основные понятия органической химии
- •Раздел 2. Углеводороды
- •2.1. Алифатические углеводороды
- •2.2. Циклические углеводороды
- •Раздел 3. Важнейшие классы производных углеводородов (28 часов)
- •3.1. Гомофункциональные соединения
- •3.2. Гетероциклические и элементоорганические соединения
- •Раздел 4. Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях (вмс)
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины для студентов очной формы обучения
- •2.2.2. Тематический план дисциплины
- •2.2.3. Тематический план дисциплины
- •При использовании информационно-коммуникационных технологий
- •2.5. Практический блок Лабораторные работы
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект Введение
- •Раздел 1 Общие вопросы теоретической органической химии
- •Основные сырьевые источники органических соединений
- •1.2. Основные понятия органической химии
- •1. Циклоалканы
- •2. Циклоалкены, циклоалкины
- •Вопросы для самопроверки
- •Раздел 2
- •2.1. Алифатические углеводороды
- •Циклические углеводороды
- •Вопросы для самопроверки
- •Раздел 3 Важнейшие классы производных углеводородов
- •3.1. Гомофункциональные соединения
- •Свойства спиртов
- •Простые и сложные эфиры
- •Классификация аминов
- •3.2. Гетероциклические и элементоорганические соединения
- •Вопросы для самопроверки
- •Раздел 4 Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Характеристика некоторых клеев и клеевых композиций представлена в разделе 4.1.1. (пример 7). Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ предисловие
- •3.4.1. Общие указания
- •3.4.2. Охрана труда и техника безопасности правила техники безопасности при работе в лаборатории оказание первой помощи при несчастных случаях
- •Первая помощь при ожогах и отравлениях
- •Растворители, применяемые для приготовления охлаждающих смесей с твердой углекислотой
- •Методы очистки и выделения органических соединений
- •Определение основных физических констант органических веществ
- •3.4.4. Лабораторные синтезы органических соединений
- •Отчет №
- •6. Выводы по работе. Синтезы азокрасителей
- •Получение полимеров реакцией полимеризации
- •Мономеры и вспомогательные вещества
- •Винилацетат (с4н6о2)
- •Пероксид бензоила (с14н10о4)
- •Получение полимеров реакцией поликонденсации
- •Мономеры и вспомогательные вещества
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольную работу и методические указания к ее выполнению
- •Распределение задач по шифрам для студентов специальности 150501.65
- •Контрольная работа
- •4.1.1. Примеры решения контрольных задач
- •Свойства отечественных полиэпоксидных смол
- •Свойства эпоксидных клеевых соединений в зависимости от природы отвердителя
- •4.2. Текущий контроль
- •Каменноугольная смола является источником…
- •Правильные ответы на тренировочный тест рубежного контроля
- •4.3. Итоговый контроль
- •Приложения
- •1. Основные сырьевые источники органических соединений
- •2. Углеводороды и радикалы (алкилы)
- •6. Краткая характеристика наиболее типичных полимеров, получаемых реакцией поликонденсации и методом полимераналогичных превращений
- •7. Полимерные композиционные материалы, свойства, области применения
- •О8. Свойства исходных соединений, применяемых в синтезах
Вопросы для самопроверки
Что называется гомологическим рядом, гомологической разностью? Приведите общую формулу ряда алканов, алкенов, алкинов и алкадиенов.
Дайте определение понятиям σ и π-связей.
Изобразите схему озонирования несимметричного диэтилэтилена с по-следующим расщеплением озонида водой.
Какие продукты образуются по реакции М.Г. Кучерова с ацетиленом?
Опишите простейшие химические пробы, которые позволяют различить соединения в следующих парах: а) циклопропан и пропилен; б) циклобутан и бутен-1; в) циклогексанол и бромциклогексан.
Изобразите все возможные структуры бензола.
Раздел 3 Важнейшие классы производных углеводородов
Теоретический материал третьего раздела лежит в основе решения некоторых задач, представленных в группах 21-30, 31-40 и 41-50 и будет полезен при выполнении лабораторных работ № 1-4. Усвоив темы третьего раздела, студент сумеет пройти тестирование, сдав рубежный тест №3.
3.1. Гомофункциональные соединения
Галогенопроизводные углеводородов – наиболее реакционноспособный класс органических соединений. Получают галогенопроизводные из алканов (прямое галогенирование предельных углеводородов), алкенов, алкинов (непря
мое галогенирование ненасыщенных углеводородов с образованием моно- и дигалогенпроизводных) и спиртов (замещение гидроксильной группы на галоген). Поляризация связи С→Hal определяет их реакционную способность и склонность к реакциям нуклеофильного замещения (см. прил. 3), которые имеют исключительно важное значение в органическом синтезе.
Дигалогенпроизводные алканов. Алкены легко реагируют с хлором и
бромом с образованием вицинальных дигалогенидов – соединений, которые содержат два атома галогена у соседних атомов углерода.

Замещение кислорода карбонильной группы на галоген. Этот способ ис-пользуется для получения геминальных хлорпроизводных альдегидов и кетонов и методически не отличается от получения хлорангидридов кислот. Часто для перевода >С=О в >CCl2 применяют PCl5. Для этого алифатический кетон или альдегид приливают к взятому с небольшим избытком тонкоизмельченному PCl5.
RCOCH2R´ + PCl5 → RCCl2-CH2R´ + POCl3
Галогеналкены. Алкены обычно присоединяют галоген по двойной связи. При галогенировании алкенов атомы водорода, находящиеся у атома углерода, связанного двойной связью (винильные водороды), замещаются с трудом. С другой стороны, атомы водорода, связанные с атомами углерода, при двойной связи (аллильные водороды) особенно активны в реакциях замещения.

Галогенарены. В синтезе соединений ароматического ряда галогениро-вание является одной из важнейших реакций. При этом наиболее широкое применение имеет хлорирование; бромирование используется значительно реже, иодирование лишь в отдельных случаях.
Прямое галогенирование в кольцо и в боковую цепь. Бромирование бензола и его гомологов (так же как и хлорирование) в кольцо протекает в присутствии катализаторов, в качестве которых чаще всего используют галогениды металлов (FeBr3, AlBr3, AlCl3, ZnCl2). Галогенирование ядра в этих условиях приводит в основном к орто- и пара-изомерам (если речь идет о гомологах бензола). Аналогичные результаты получены и для других алкил-
бензолов; бромирование протекает так же, как и хлорирование.
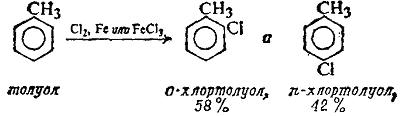
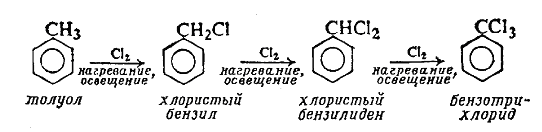
Галогенирование толуола в боковую цепь может дать последовательно моно-, ди- и трихлорпроизводные, являющиеся важными полупродуктами в синтезе спиртов, альдегидов и кислот.
Атомы водорода, находящиеся у атома углерода, связанного с арома-тическим кольцом, называются бензильными водородами и являются необы-чайно подвижными:
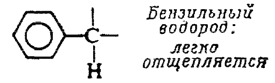
Прямое галогенирование гетероциклических соединений, обладающих ароматическим характером, возможно, но практического значения не имеет. Фуран, пиррол, тиофен галогенируются легче бензола, а пиридин труднее.
Кислородсодержащие производные алифатических и ароматиче-
ских углеводородов. Существует огромное число органических соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кисло-
рода содержится в различных функциональных группах, определяющих принадлежность соединения к определенному классу.
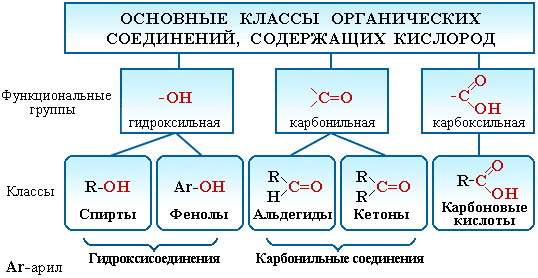
СПИРТЫ – соединения алифатического ряда, содержащие одну или не-сколько гидроксильных групп. Общая формула спиртов с одной гидроксигруп-
пой R–OH: метиловый спирт (метанол) CH3-OH; этиловый спирт (этанол) CH3CH2-OH.
Строение гидроксильной группы. Свойства спиртов и фенолов определя-
ются строением гидроксильной группы, характером ее химических связей, стро
ением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Из-за различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,5) электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
![]()
Распределение электронной плотности на атомах молекулы определяет ее реакционную способность: полярный характер связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву.
. Спирты:
классифицируют по числу гидроксильных групп на одноатомные, (если одна группа –ОН), многоатомные (две и более групп -ОН);
различают спирты первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH в зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа;
подразделяются по строению радикалов, связанных с атомом кисло-рода, на предельные, или алканолы (например, СH3CH2–OH), непредельные, или алкенолы (CH2=CH–CH2–OH), и ароматические (C6H5CH2–OH).
Номенклатура спиртов. Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Нумерация ведется от ближайшего к ОН-группе конца цепи. По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова спирт. Например:
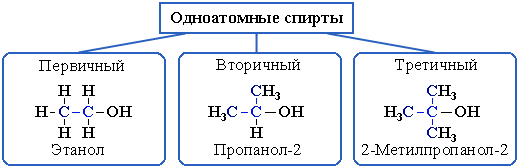
Этиловый спирт Изопропиловый спирт Третичный бутиловый спирт
В названиях многоатомных спиртов (полиолов) положение и число гид-роксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

Водородные связи и физические свойства. Следствием полярности свя-зи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей.
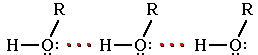
Ассоциация молекул ROH
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т. кип. метанола +64,5 оС).
При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают (табл. 1).
Таблица 1
