
- •Химия, ч. 2. Органическая химия
- •1. Информация о дисциплине
- •Предисловие
- •Место дисциплины в учебном процессе.
- •Содержание дисциплины и виды учебной работы
- •Содержание дисциплины по гос
- •Объем дисциплины и виды учебной работы
- •Раздел 1. Общие вопросы теоретической органической химии
- •1.2. Основные понятия органической химии
- •Раздел 2. Углеводороды
- •2.1. Алифатические углеводороды
- •2.2. Циклические углеводороды
- •Раздел 3. Важнейшие классы производных углеводородов (28 часов)
- •3.1. Гомофункциональные соединения
- •3.2. Гетероциклические и элементоорганические соединения
- •Раздел 4. Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях (вмс)
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины для студентов очной формы обучения
- •2.2.2. Тематический план дисциплины
- •2.2.3. Тематический план дисциплины
- •При использовании информационно-коммуникационных технологий
- •2.5. Практический блок Лабораторные работы
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект Введение
- •Раздел 1 Общие вопросы теоретической органической химии
- •Основные сырьевые источники органических соединений
- •1.2. Основные понятия органической химии
- •1. Циклоалканы
- •2. Циклоалкены, циклоалкины
- •Вопросы для самопроверки
- •Раздел 2
- •2.1. Алифатические углеводороды
- •Циклические углеводороды
- •Вопросы для самопроверки
- •Раздел 3 Важнейшие классы производных углеводородов
- •3.1. Гомофункциональные соединения
- •Свойства спиртов
- •Простые и сложные эфиры
- •Классификация аминов
- •3.2. Гетероциклические и элементоорганические соединения
- •Вопросы для самопроверки
- •Раздел 4 Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Характеристика некоторых клеев и клеевых композиций представлена в разделе 4.1.1. (пример 7). Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ предисловие
- •3.4.1. Общие указания
- •3.4.2. Охрана труда и техника безопасности правила техники безопасности при работе в лаборатории оказание первой помощи при несчастных случаях
- •Первая помощь при ожогах и отравлениях
- •Растворители, применяемые для приготовления охлаждающих смесей с твердой углекислотой
- •Методы очистки и выделения органических соединений
- •Определение основных физических констант органических веществ
- •3.4.4. Лабораторные синтезы органических соединений
- •Отчет №
- •6. Выводы по работе. Синтезы азокрасителей
- •Получение полимеров реакцией полимеризации
- •Мономеры и вспомогательные вещества
- •Винилацетат (с4н6о2)
- •Пероксид бензоила (с14н10о4)
- •Получение полимеров реакцией поликонденсации
- •Мономеры и вспомогательные вещества
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольную работу и методические указания к ее выполнению
- •Распределение задач по шифрам для студентов специальности 150501.65
- •Контрольная работа
- •4.1.1. Примеры решения контрольных задач
- •Свойства отечественных полиэпоксидных смол
- •Свойства эпоксидных клеевых соединений в зависимости от природы отвердителя
- •4.2. Текущий контроль
- •Каменноугольная смола является источником…
- •Правильные ответы на тренировочный тест рубежного контроля
- •4.3. Итоговый контроль
- •Приложения
- •1. Основные сырьевые источники органических соединений
- •2. Углеводороды и радикалы (алкилы)
- •6. Краткая характеристика наиболее типичных полимеров, получаемых реакцией поликонденсации и методом полимераналогичных превращений
- •7. Полимерные композиционные материалы, свойства, области применения
- •О8. Свойства исходных соединений, применяемых в синтезах
3.4.4. Лабораторные синтезы органических соединений
Ведение рабочего журнала. К выполнению лабораторных работ допуска
ются студенты, прослушавшие курс лекций по дисциплине «Органическая хи-
мия», ознакомленные с правилами техники безопасности и сдавшие коллокви –ум по теме выполняемой лабораторной работы.
При выполнении лабораторного практикума по органической химии
студенты составляют в рабочем журнале отчет по синтезу каждого вещества.
При оформлении отчета пункты 1−4 заполняются до выполнения синтеза и
проверяются преподавателем. Получив разрешение на проведение работы
(пункт 4), студенты проводят синтез и очистку заданного вещества (пункт 5), затем сдают полученный препарат и защищают отчет, сделав выводы по работе (пункт 6). Форма отчета приведена ниже.
Зачет по работе __________
«_____»_____________200 г.
Отчет №
студент ______________ шифр ___________ специальность_________
по синтезу ________________________________________________________
1. Уравнение реакции (с указанием названий всех исходных соединений и продуктов реакции).
2. Загрузка реактивов.
3. Схема установки.
4. Разрешение преподавателя на проведение синтеза_____ «___»_____ 200 г.
5. Описание хода синтеза по форме:
№ опера ции |
Время |
Основные этапы синтеза |
Наблюдения |
1 |
2 |
3 |
4 |
6. Выводы по работе. Синтезы азокрасителей
В лабораторной и промышленной практике широко применяются ароматические диазосоединения, что связано с их высокой реакционной способностью и возможностью получения на их основе широкого ряда практически ценных органических соединений.
ДИАЗОСОЕДИНЕНИЯ. Соли диазония редко выделяют из раствора в индивидуальном виде и в большинстве случаев сразу же вводят в дальнейшие превращения. Тем не менее многие соли арендиазония с некоторыми противо-ионами (SbF6ˉ, BF4ˉ) нерастворимы в воде и достаточно стабильны при хране-нии их в сухом виде в течение длительного времени. Такие соли называют стабильными формами диазосоединений или диазосолями. К ним относятся соли
![]() (X
ˉ
= Clˉ,
Brˉ,
NO3ˉ,
HSO4ˉ
и т. д.)
(X
ˉ
= Clˉ,
Brˉ,
NO3ˉ,
HSO4ˉ
и т. д.)
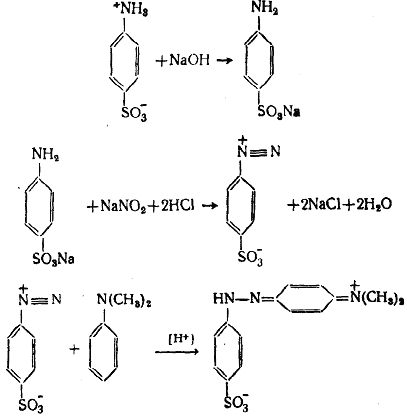
ДИАЗОТИРОВАНИЕ ─ реакция между азотистой кислотой и солями первичных ароматических аминов (П. Грисс 1858):
ArNH2
+ 3HX + NaNO2
![]() ArN
ArN![]() Xˉ
+ NaX + НХ
+ 2H2O.
Xˉ
+ NaX + НХ
+ 2H2O.
Как видно из уравнения, для диазотирования применяется не свободная азотистая кислота, которая очень неустойчива, а азотистая кислота in statu nascendi, выделяющаяся из нитрита натрия при действии минеральной кислоты, чаще всего соляной или серной. Диазотирование аминов проводят следующим образом.
Амин растворяют в воде, содержащей три эквивалента соляной кислоты (если это требуется, то при нагревании), и раствор хорошо охлаждают льдом; при этом гидрохлорид амина обычно кристаллизуется. Затем, поддерживая температуру 0-5 оС, постепенно приливают по каплям водный раствор нитрита натрия до тех пор, пока проба реакционной смеси, взятая через 5 мин после добавления нитрита, не даст положительной реакции с иодкрахмальной бумагой,1 что свидетельствует о наличии избытка азотистой кислоты. Для контроля кислотности пользуются реакцией на конго красный: бумага конго в присутствии сильных минеральных кислот синеет.
Гидрохлорид амина во время процесса диазотирования растворяется,
oбразуя прозрачный раствор гораздо лучше растворимой соли диазония. Один эквивалент соляной кислоты связывается с амином, образуя анион, второй реагирует с нитритом натрия, выделяя азотистую кислоту, а третий поддерживает кислотность, необходимую для стабилизации соли диазония, предотвращая вторичные превращения, например, образование диазоаминосое-
динения:
ArN Clˉ + ArNH2 Ar-N=N-NH-Ar + HCl.
Хлористый фенилдиазоний C6H5N Clˉ, продукт взаимодействия соляно-кислого анилина и азотистой кислоты при 0 оС в присутствии избытка соляной кислоты (см. прил. 7), представляет собой ионизированную соль, хорошо растворимую в воде и нерастворимую в эфире и других органических растворителях. В водном растворе хлористый фенилдиазоний полностью диссоциирован.
В совершенно сухом твердом кристаллическом состоянии он очень чувствителен к удару, а при слабом нагревании взрывается с большой силой. Для получения хлористого фенилдиазония в кристаллическом состоянии в качестве источника азотистой кислоты применяют смесь органического нитрита и органической кислоты в эфире. При этом соль диазония, как единственное нерастворимое в эфире вещество, выпадает в осадок.
C6H5NН3+
Clˉ
+ C5H11ONO
+ CH3COOH
![]() C6H5N
Clˉ
+ CH3COOC5H11
C6H5N
Clˉ
+ CH3COOC5H11
Продукт реакции чрезвычайно неустойчив и требует осторожного обращения. Однако для проведения почти всех реакций с участием соли диазония нет необходимости выделять соли в твердом виде, так как эти реакции с успехом осуществимы и со свежеприготовленными водными растворами.
Различают две группы реакций, в которые вступают диазониевые соли:
Реакции с выделением азота;
Реакции без выделения азота.
Реакции с выделением азота. Существует ряд синтетических приемов получения соединений различных классов путем замены диазогруппы на дру-гую группировку или водород.
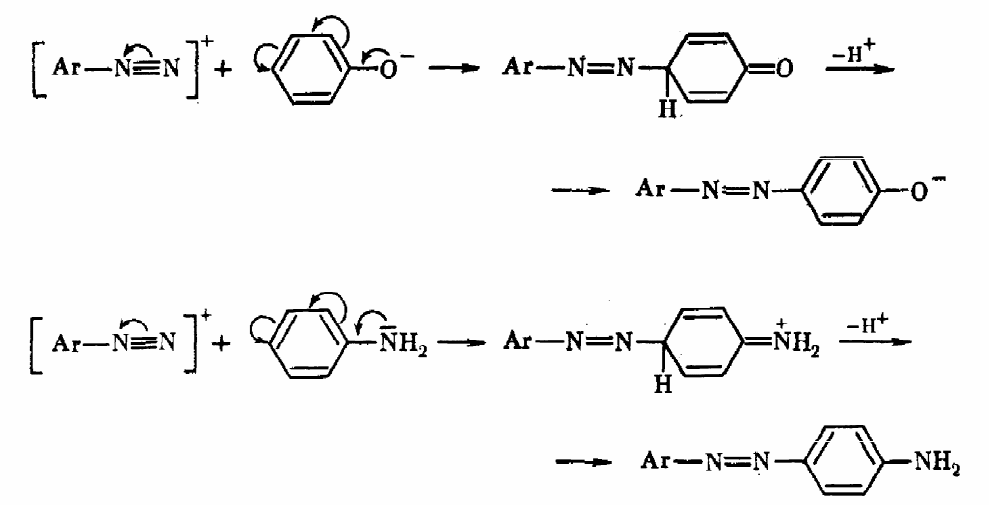
Реакции без выделения азота. АЗОСОЕДИНЕНИЯ. АЗОСОЧЕТАНИЕ ─ взаимодействие диазосоединений с ароматическими аминами и фенолами (нафтолами); оно приводит к образованию ярко окрашенных азокрасителей. Это наиболее важная в практическом отношении реакция ароматических диазосоединений.
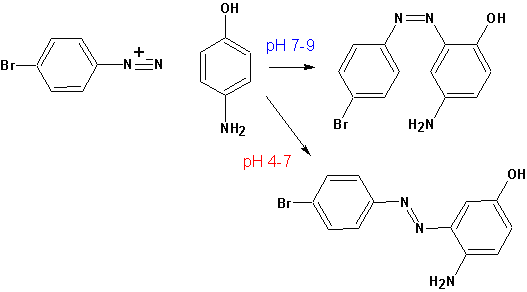
В реакциях различают два компонента ─ диазосоставляющую (соль диазония) и азосоставляющую (активированную ароматическую систему), которые, как правило, содержат ауксохромные (углубляющие цвет и способ-
ствующие связыванию красителей волокном) группы (NH2, NHR, NR2, OH). Наиболее реакционноспособные диазосоставляющие образуются в жестких условиях. При сочетании происходит электрофильная атака активиро
в анной
ароматической системы атомом азота и
выделения азота не происходит. Атаке
подвергаются положения, наиболее
обогащенные электронной плотностью.
Простейшее азосоединение, в котором
два ароматических кольца связаны между
собой хромофорной
(способствующей поглощению света в
видимой области спектра) азогруппой
–N=N-,
– это азобензол, но сам по себе азобензол
красителем не является.
анной
ароматической системы атомом азота и
выделения азота не происходит. Атаке
подвергаются положения, наиболее
обогащенные электронной плотностью.
Простейшее азосоединение, в котором
два ароматических кольца связаны между
собой хромофорной
(способствующей поглощению света в
видимой области спектра) азогруппой
–N=N-,
– это азобензол, но сам по себе азобензол
красителем не является.
Только после введения в молекулу азобензола амино- или гидроксильной группы она приобретает свойства красителя.

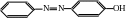
Следовательно, простейшими азокрасителями являются оксиазобензол и аминоазобензол.
Практическое значение имеют азокрасители более сложного строения.
В результате реакции азосочетания образуются красители: 4-окси-азобензола (1) и 4-N,N-диметиламиноазобензола (2):
1
2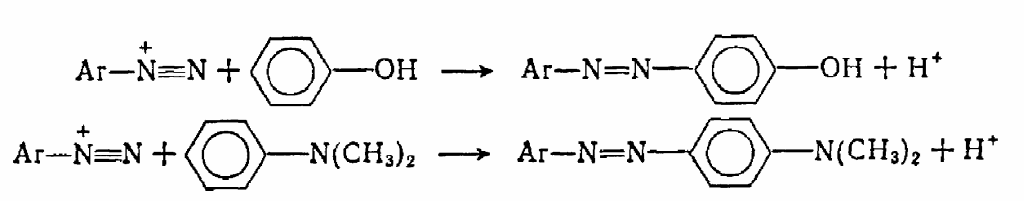
Замещение происходит преимущественно в п-положение, если оно занято – в о-положение. Условия проведения реакции азосочетания зависят, прежде всего, от строения азосоставляющих:
Реакция азосочетания широко применяется в технике для приготовления огромного числа марок азокрасителей, дающих наибольшее разнообразие сре-
ди всех типов синтетических красителей.
Скорость реакции сочетания с аминами в интервале рН 2-6 возрастает с понижением кислотности до тех пор, пока концентрация свободного амина не достигнет максимума. При сочетании с фенолами при изменении рН в интерва-
ле 5-8 скорость реакции, наоборот, возрастает с повышением рН, поскольку образуется большее количество способного к реакциям феноксииона.
Так как соли диазония изменяются в щелочном растворе, постепенно превращаясь в анти-диазотаты, не способные вступать в реакцию азосочета-
ния, то для правильного проведения этого процесса раствор хлористого фенилдиазония следует при перемешивании медленно приливать к охлажден-
ному щелочному раствору фенола. Щелочь берется в количестве, достаточном для нейтрализации образующихся органических и неорганических кислот и для поддержания соответствующей основности реакционной среды. Сочетание протекает настолько быстро, что возможность разрушения диазосоставляющей исключается.
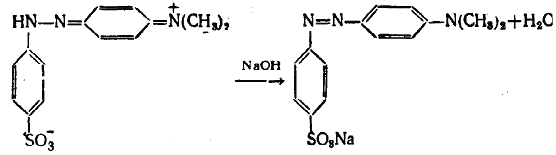
Аналогичным образом хлористый фенилдиазоний сочетается с N,N- ди-метиланилином. Реакция протекает в водной среде, нейтральной или слегка подкисленной, и приводит к образованию п-(N,N-диметиламино)-азобензола.
В кислой среде азокрасители присоединяют протон по азогруппе, что сопровождается перестройкой связей в бензольном цикле, несущем амино- (или окси-) группу, и изменением цвета (индикаторные свойства):

Полученная соль азокрасителя имеет хиноидную, а не бензоидную структуру. Присоединение протона произошло не к диметиламиногруппе, а к азоту азогруппы в результате реакции с перенесением реакционного центра, но аммонийным стал все же азот диметиламиногруппы.
Наличие цветности азокрасителей связано с мезомерией их структуры, выражающейся для приведенного выше примера двумя предельными структурами:
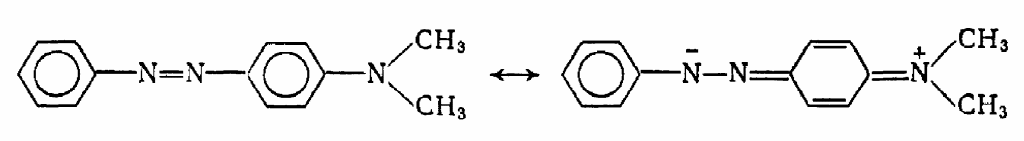
Вес первой структуры больше, но как видно из направления атаки протона, вторая тоже дает себя ясно знать.
Если в азосоставляющей имеются одновременно амино- и гидрокси-группа, то в зависимости от рН среды сочетание проводится при активирую-
щем влиянии либо амино-, либо гидроксигруппы. Практически в таких случаях первоначально проводят сочетание в слабокислой среде, где ориентацию оказывает аминогруппа.
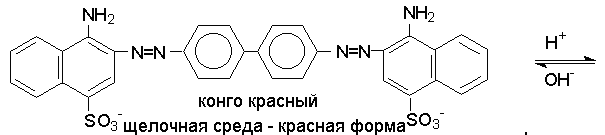
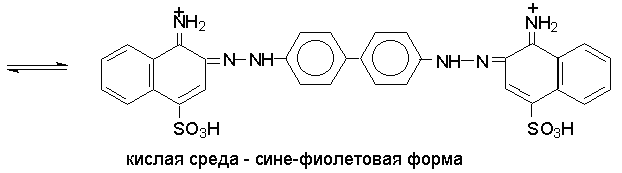
В результате комбинации солей диазония из различных ароматических аминов с различными азосоставляющими и подбора условий могут быть по-лучены самые разнообразные азокрасители. Многие азокрасители в зави-симости от рН среды изменяют строение, а следовательно и окраску. Такие азо-красители находят применение в качестве индикаторов, например, метилоранж (работа 2), метиловый красный, конго красный и др., а краситель кислотный красный С используется при крашении шерсти и хлопка.
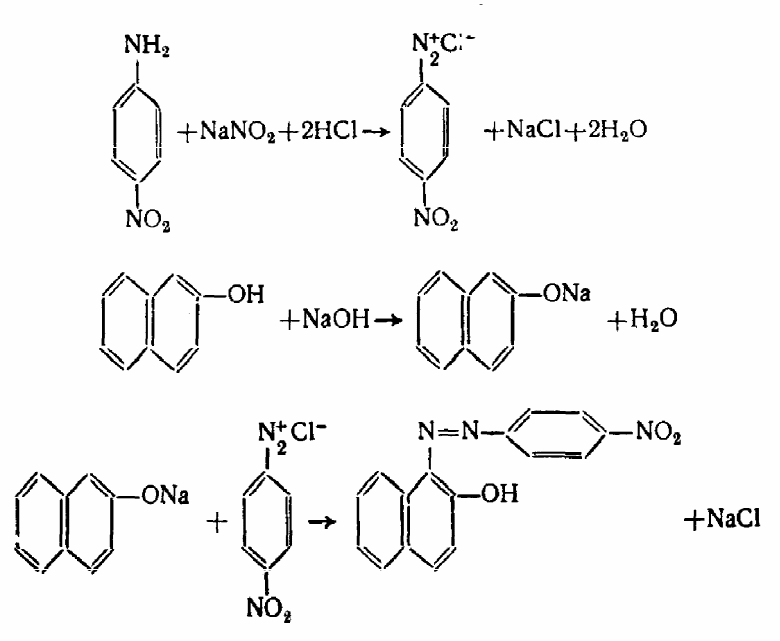
Работа 1. п-Нитроанилиновый красный (п-нитробензолазо-β-нафтол)
Реакция азосочетания нафтола с п-нитрофенилдиазонием.
Ц е л ь: ознакомление со способом получения красителя ряда нафталина и его свойствами.
-
Загрузка реактивов:
пара-нитроанилин – 0,5 г;
нитрит натрия – 0,3 г;
-Нафтол – 0,5 г;
ацетат натрия – 1,0 г;
соляная кислота (6 н.) – 1,5 мл;
гидроксид натрия (8 н.) – 2 мл;
хлорид натрия – 1 г.
Посуда:
стакан (50 мл) - 3 шт.;
стеклянная палочка;
цилиндр (10 мл);
ледяная баня;
фарфоровая чашка;
установка для фильтрования;
термометр.
В ы п о л н е н и е р а б о т ы. 0,5 г п-нитроанилина растворяют в стаканчике в 4,5 мл горячей воды, прибавляя 0,8 мл 6 н. соляной кислоты. По охлаждении раствора в бане с водой, льдом и солью до 0 оС прибавляют еще 0,7 мл соляной кислоты той же концентрации и 5 мл воды.
Охладив полученный раствор льдом до 0 оС, его диазотируют, прибавляя по каплям при перемешивании стеклянной палочкой 2 мл 2 н. раствора нитрита натрия (при выпадении осадка добавляют еще соляной кислоты той же концентрации до его растворения).
По окончании диазотирования (проба на иодкрахмальную бумагу) раствор оставляют стоять в течение получаса, после чего, если нужно, его фильтруют и прибавляют к нему раствор 1 г ацетата натрия в 3,5 мл воды (раствор №1).
В отдельном стаканчике растворяют 0,5 г β-нафтола в 2 мл 8 н. раствора гидроксида натрия и доводят горячей водой до 33 мл (раствор № 2). По охлаждении отфильтрованный прозрачный раствор № 2 небольшими порциями, при перемешивании, прибавляют к раствору № 1 и добавляют 1 г хлорида натрия. Выделившийся краситель отсасывают на воронке Бюхнера, промывают на фильтре 20%-ным раствором хлорида натрия и сушат на воздухе. Выход красителя 1 г.
С в о й с т в а к р а с и т е л я.
Необходимые реактивы: 2 % раствор -нафтола (2 г -нафтола растворить в 98 мл дистиллированной воды); 1 н. раствор гидроксида натрия (4 г щелочи растворить в 100 мл дистиллированной воды); 2 н. раствор ацетата натрия (16,4 г соли растворить в 100 мл воды); хлористый п-нитрофенилдиазоний (7 г п-нитроанилина растворяют при нагревании в 12,5 мл концентрированной соляной кислоты и 150 мл воды). Раствор охлаждают до 0 ОС в воде со льдом и затем быстро, при энергичном перемешивании приливают к нему охлажденный раствор 3,5 г нитрита натрия в 20 мл воды. Реакционную смесь оставляют в ледяной воде на 30-40 минут. Раствор диазотированного п-нитроанилина (желтого цвета) должен быть прозрачным. В холодильнике он хранится 10-12 дней.
Ледяное крашение. Полоску белой хлопчатобумажной ткани пропитывают 2 % раствором -нафтола в 1 н. растворе гидроксида натрия. Ткань отжимают, развешивают на стеклянных палочках и высушивают над плиткой или в сушильном шкафу. Высушенную ткань помещают в фарфоровую чашку и обливают раствором хлористого п-нитрофенилдиазония, а затем добавляют 2 н. раствор уксуснокислого натрия, при этом ткань окрашивается в красный цвет. Опишите свои наблюдения.
Литература: [13], [17].
Работа 2. Гелиантин (метилоранж)
Метод диазотирования и азосочетания
.
Ц е л ь: получение гелиантина (метилоранжа) и ознакомление с его свойствами как индикатора и красителя.
-
Загрузка реактивов:
сульфаниловая кислота – 1 г;
диметиланилин – 1 мл;
нитрит натрия – 0,4 г;
соляная кислота (1 н. раствор) – 10 мл;
гидроксид натрия (2 н. раствор) – 2,5 мл;
соляная кислота (2 н. раствор) – 5 мл.
Посуда:
стакан (100 мл) – 3 шт.;
стеклянная палочка;
цилиндр (10 мл);
установка для фильтрования;
охлаждающая баня;
термометр;
чашечка Петри.
В ы п о л н е н и е р а б о т ы. В маленьком стаканчике растворяют 1 г диметиланилина в 10 мл 1 н. соляной кислоты (раствор № 1).
В другом стаканчике растворяют 1 г сульфаниловой кислоты в 2,5 мл 2 н. раствора гидроксида натрия (раствор № 2).
В третьем стаканчике растворяют 0,4 г нитрита натрия в 5 мл воды (раствор № 3).
Раствор № 2 смешивают с раствором № 3 и получают раствор № 4, кото-
рый охлаждают льдом и приливают при помешивании к 2,5 мл 2 н. соляной кислоты. Полученный раствор (раствор № 5) постепенно превращается в сус-
пензию из-за выделяющегося белого порошкообразного осадка соли диазония п-диазобензолсульфокислоты, который не отделяют, а используют в виде взвеси. Он более устойчив, чем другие соли диазония, и может храниться несколько часов.
Охлажденный раствор № 1 приливают при перемешивании к взвеси п-диазобензолсульфокислоты. Через 5-10 мин образуется густая паста устойчивой к кислоте модификации красителя красного цвета. Для получения натриевой соли красителя к пасте добавляют 2 н. раствор гидроксида натрия до явно щелочной реакции, хорошо перемешивают и нагревают образовавшуюся смесь до кипения. При этом основная часть красителя переходит в раствор. Смесь охлаждают в ледяной бане. Через некоторое время выделяются оранжево-коричневые листочки натриевой соли красителя. Через 1 час осадок отсасывают и сушат при 30-40 оС. Выход гелиантина 90 %. Продукт можно перекристаллизовать из небольшого количества воды.
Гелиантин (метиловый оранжевый, натриевая соль 4-диметиламино-азобензол-4-сульфокислоты) – кристаллическое вещество оранжевого цвета (допускается коричневатый оттенок), легко растворим в горячей воде, нера-створим в спирте. Молекулярная масса 327,34.
С в о й с т в а к р а с и т е л я. Гелиантин является одним из общеупотребляемых кислотно-щелочных цветных индикаторов. В щелочной среде гелиантин имеет желтый цвет, в нейтральной – оранжевый, а в кислой – красный цвет. Интервал перехода окраски при рН от 3,0 до 4,4 (от красной к оранжево-желтой).
Необходимые реактивы: метиловый оранжевый – 0,1 г; 4 н. раствор серной кислоты (19,2 г разбавить в 100 мл дистиллированной воды).
Крашение шерсти и шелка кислотными красителями. Растворяют 0,1 г метилового оранжевого в 50 мл воды. Раствор разливают в два стакана. В один из них добавляют 5 мл 4 н. раствора серной кислоты. Затем в оба стакана опускают кусочки белой шерстяной (или шелковой) ткани. Растворы с тканью кипятят 5 минут. Затем ткань вынимают и высушивают на воздухе, развесив на стеклянных палочках.
Наблюдается ли различие в интенсивности окраски кусочков ткани? Как влияет кислотность среды на процесс окраски ткани? Укажите хромофорную и ауксохромную группы в гелиантине.
Литература: [3], [17].
Работа 3. Черный анилин
Окисление анилина хромовой смесью.
Анилиновый черный (черный анилин) – азиновый краситель. Сложная смесь веществ, строение которых не установлено.
Ц е л ь: установление способности анилина к окислению и ознакомление со свойствами красителя черного анилина.
-
Загрузка реактивов:
анилин – 0,5 мл;
бихромат калия – 2 г;
серная кислота ( d=1.84) – 3 мл.
Посуда:
пробирка широкогорлая;
обратный воздушный холодильник;
стакан;
цилиндр;
чашки Петри – 2 шт.
В ы п о л н е н и е р а б о т ы. В пробирке встряхивают 1 мл анилина с 10 мл воды.
К 1 мл полученной анилиновой воды прибавляют 4 мл хромовой смеси
(2 г бихромата калия растворяют в 5 мл воды и осторожно прибавляют 3 мл концентрированной серной кислоты). Смесь нагревают с обратным воздушным холодильником во избежание выбросов серной кислоты, при этом наблюдается изменение цвета смеси от темно-зеленого через темно-синий и далее до черного. Выпадающий в осадок краситель называется черным анилином.
С в о й с т в а к р а с и т е л я. Анилиновый черный образуется непосредственно на волокне: смесь солянокислого анилина, окислителя (К2Сr2О7) и катализатора. Окисление проводится при рН = 3,5—4,0.
При окислении анилина в растворе получается пигмент глубоко черный (в виде порошка его применяют для крашения пластмасс, изготовления копировальной бумаги, краски для лент пишущих машин, лакокрасочных материалов).
Необходимые реактивы: анилиновая вода – 10 мл; 10 % раствор бихрома-та калия (10 г окислителя растворить в 90 мл дистиллированной воды); серная кислота (раствор 1:1) – 5 мл.
Крашение. Ткань (хлопок, шерсть, шелк) пропитать раствором соли
(10 мл анилиновой воды с 5 мл разбавленной 1:1 серной кислоты), а затем раствором окислителя К2Сr2О7 (10 % раствор). Нерастворимый черный анилин откладывается в порах волокна, так как окисление происходит на самой ткани. Наблюдается ли различие в окрашивании тканей разных видов?
Литература: [17].
