- •Химия, ч. 2. Органическая химия
- •1. Информация о дисциплине
- •Предисловие
- •Место дисциплины в учебном процессе.
- •Содержание дисциплины и виды учебной работы
- •Содержание дисциплины по гос
- •Объем дисциплины и виды учебной работы
- •Раздел 1. Общие вопросы теоретической органической химии
- •1.2. Основные понятия органической химии
- •Раздел 2. Углеводороды
- •2.1. Алифатические углеводороды
- •2.2. Циклические углеводороды
- •Раздел 3. Важнейшие классы производных углеводородов (28 часов)
- •3.1. Гомофункциональные соединения
- •3.2. Гетероциклические и элементоорганические соединения
- •Раздел 4. Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях (вмс)
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины для студентов очной формы обучения
- •2.2.2. Тематический план дисциплины
- •2.2.3. Тематический план дисциплины
- •При использовании информационно-коммуникационных технологий
- •2.5. Практический блок Лабораторные работы
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект Введение
- •Раздел 1 Общие вопросы теоретической органической химии
- •Основные сырьевые источники органических соединений
- •1.2. Основные понятия органической химии
- •1. Циклоалканы
- •2. Циклоалкены, циклоалкины
- •Вопросы для самопроверки
- •Раздел 2
- •2.1. Алифатические углеводороды
- •Циклические углеводороды
- •Вопросы для самопроверки
- •Раздел 3 Важнейшие классы производных углеводородов
- •3.1. Гомофункциональные соединения
- •Свойства спиртов
- •Простые и сложные эфиры
- •Классификация аминов
- •3.2. Гетероциклические и элементоорганические соединения
- •Вопросы для самопроверки
- •Раздел 4 Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Характеристика некоторых клеев и клеевых композиций представлена в разделе 4.1.1. (пример 7). Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ предисловие
- •3.4.1. Общие указания
- •3.4.2. Охрана труда и техника безопасности правила техники безопасности при работе в лаборатории оказание первой помощи при несчастных случаях
- •Первая помощь при ожогах и отравлениях
- •Растворители, применяемые для приготовления охлаждающих смесей с твердой углекислотой
- •Методы очистки и выделения органических соединений
- •Определение основных физических констант органических веществ
- •3.4.4. Лабораторные синтезы органических соединений
- •Отчет №
- •6. Выводы по работе. Синтезы азокрасителей
- •Получение полимеров реакцией полимеризации
- •Мономеры и вспомогательные вещества
- •Винилацетат (с4н6о2)
- •Пероксид бензоила (с14н10о4)
- •Получение полимеров реакцией поликонденсации
- •Мономеры и вспомогательные вещества
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольную работу и методические указания к ее выполнению
- •Распределение задач по шифрам для студентов специальности 150501.65
- •Контрольная работа
- •4.1.1. Примеры решения контрольных задач
- •Свойства отечественных полиэпоксидных смол
- •Свойства эпоксидных клеевых соединений в зависимости от природы отвердителя
- •4.2. Текущий контроль
- •Каменноугольная смола является источником…
- •Правильные ответы на тренировочный тест рубежного контроля
- •4.3. Итоговый контроль
- •Приложения
- •1. Основные сырьевые источники органических соединений
- •2. Углеводороды и радикалы (алкилы)
- •6. Краткая характеристика наиболее типичных полимеров, получаемых реакцией поликонденсации и методом полимераналогичных превращений
- •7. Полимерные композиционные материалы, свойства, области применения
- •О8. Свойства исходных соединений, применяемых в синтезах
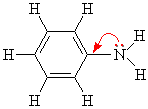
Классификация аминов
АМИНЫ |
Первичные |
Вторичные |
Третичные |
Алифатические (жирные) |
CH3NH2 Метиламин |
(CH3)2NH Диметиламин |
(CH3)3N Триметиламин |
Ароматические |
C6H5NH2 Фениламин (анилин) |
(C6H5)2NH Дифениламин |
(C6H5)3N Трифениламин |
Смешанные |
– |
C6H5-NH-СН3 Метилфениламин (N-Метиланилин) |
C6H5-N(СН3)2 Диметилфениламин (N, N -Диметиланилин) |
Изомерия аминов. Для аминов характерна структурная изомерия:
углеродного скелета, начиная с С4H9NH2;
положения аминогруппы, начиная с С3H7NH2;
изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
Возможна оптическая изомерия (пространственная), начиная с С4H9NH2:
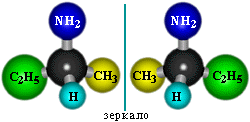
Физические свойства. Связь N–H является полярной, поэтому первич-ные и вторичные амины образуют межмолекулярные водородные связи (неско-лько более слабые, чем Н-связи с участием группы О–Н). Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H).
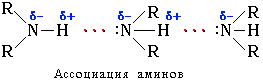
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
![]()
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Аромати-
ческие амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
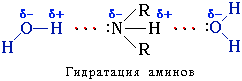
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде умень-шается, т. к. увеличиваются пространственные препятствия образованию водо-родных связей. Ароматические амины в воде практически не растворяются.
Химические свойства. В аминах имеются связи С–Н и С–C, а также связи N–H и N–C. Связи азота с углеродом или водородом – полярные кова-лентные.
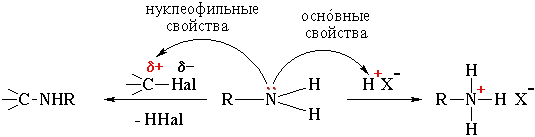
Исходя из распределения электронной плотности в молекуле и наличия неподеленной пары электронов на азоте (см. вышеприведенную схему), можно считать, что амины обладают основными и нуклеофильными свойствами.
Нуклеофильность - способность частицы предоставить электронную пару на образование связи с углеродом. Кроме того, атом азота в аминах имеет самую низкую для этого элемента степень окисления (-3). Поэтому амины мо-гут вступать в реакции окисления по связям C–N и N–H, проявляя восста-новительные свойства.
Амины, также как и аммиак, обладают свойствами оснований (акцеп-торов протона) и нуклеофильных реагентов (частиц, способных предоставить пару электронов для связи с атомом углерода).
Основность аминов. Для аминов характерны ярко выраженные основные свойства (за что их часто называют органическими основаниями). Водные растворы алифатических аминов проявляют щелочную реакцию, т. к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
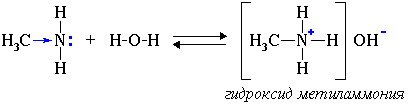
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота. Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет
+I-эффекта. По этой причине электронная пара атома азота удерживается менее
прочно и легче взаимодействует с протоном. Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону электронами. Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. |
анилин |
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида. Взаимодействуя с кислотами, амины образуют соли – твердые вещества, хорошо растворимые в воде.
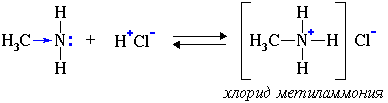
Основность простейших аминов (в растворе) возрастает в ряду:
C6H5NH2 < NH3 < (CH3)3N < CH3NH2 < (CH3)2NH.
АРИЛАМИНЫ. Анилин (фениламин) С6H5NH2 – важнейший из аро-матических аминов. Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 оС, т. пл. -6 оС). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства. Для анилина характерны реакции как по амино-группе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
Практическое значение имеет реакция анилина с азотистой кислотой при пониженной температуре (около 0 оС). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений (см. стр. 108).
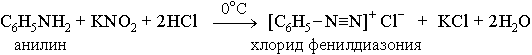
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
![]()
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
ТИОСПИРТЫ (меркаптаны, тиолы) и ТИОЭФИРЫ (сульфиды).
Тиолы (или меркаптаны) представляют собой производные сероводо-
рода аналогично тому, как спирты являются производными воды. Общая формула тиоспиртов, иначе называемых тиолами или меркаптанами R ─ SH:
C2H5SH этилмеркаптан, этантиол (систематическая номенклатура);
(C2H5)2S диэтилсульфид, этилтиоэтан.
Подобно сероводороду как алифатические, так и ароматические тиолы обладают характерным неприятным запахом. Они содержатся в сырой нефти, которую подвергают каталитическому обессериванию. Образующийся при этом сероводород используют для получения серной кислоты.
Этил- и изоамилмеркаптаны имеют практическое значение и приме-няются при одорации бытового газа. Так как природный газ практически не имеет запаха, добавление незначительного количества изоамилмеркаптана дает возможность легко обнаружить утечку в газопроводе.
Тиоэфиры. Органические сульфиды или тиоэфиры R––S – R′ легко могут быть получены по реакции замещения алкильных производных при действии солей тиолов или путем присоединения тиолов к алкенам:
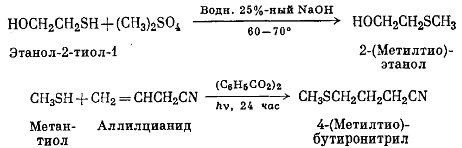
Сульфокислоты. Помимо карбоновых кислот существует еще один класс важных органических кислот – сульфокислоты (сульфоновые кислоты). Они имеют важное промышленное значение в качестве детергентов (моющих средств) – они употребляются в виде натриевых солей RSO3Na. Многие промышленные детергенты представляют собой алкиларилсульфонаты натрия: С9-15Н19-31 – Аr – SO3 ˉNa+
Основное преимущество сульфонатов натрия в качестве детергентов перед натриевыми солями жирных кислот, используемыми в обычных мылах, заключается в том, что соответствующие кальциевые и магниевые соли раство-римы в гораздо большей степени и при использовании жесткой воды сульфо-наты не образуют хлопьев.
Сульфокислотные группы часто вводятся в молекулы органических сое-динений для того, чтобы повысить их растворимость в воде; это имеет особо важное значение в промышленности красителей, где часто требуется придать водорастворимость окрашенным органическим молекулам при использовании их в качестве красителей в водной среде.