- •Химия, ч. 2. Органическая химия
- •1. Информация о дисциплине
- •Предисловие
- •Место дисциплины в учебном процессе.
- •Содержание дисциплины и виды учебной работы
- •Содержание дисциплины по гос
- •Объем дисциплины и виды учебной работы
- •Раздел 1. Общие вопросы теоретической органической химии
- •1.2. Основные понятия органической химии
- •Раздел 2. Углеводороды
- •2.1. Алифатические углеводороды
- •2.2. Циклические углеводороды
- •Раздел 3. Важнейшие классы производных углеводородов (28 часов)
- •3.1. Гомофункциональные соединения
- •3.2. Гетероциклические и элементоорганические соединения
- •Раздел 4. Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях (вмс)
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины для студентов очной формы обучения
- •2.2.2. Тематический план дисциплины
- •2.2.3. Тематический план дисциплины
- •При использовании информационно-коммуникационных технологий
- •2.5. Практический блок Лабораторные работы
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект Введение
- •Раздел 1 Общие вопросы теоретической органической химии
- •Основные сырьевые источники органических соединений
- •1.2. Основные понятия органической химии
- •1. Циклоалканы
- •2. Циклоалкены, циклоалкины
- •Вопросы для самопроверки
- •Раздел 2
- •2.1. Алифатические углеводороды
- •Циклические углеводороды
- •Вопросы для самопроверки
- •Раздел 3 Важнейшие классы производных углеводородов
- •3.1. Гомофункциональные соединения
- •Свойства спиртов
- •Простые и сложные эфиры
- •Классификация аминов
- •3.2. Гетероциклические и элементоорганические соединения
- •Вопросы для самопроверки
- •Раздел 4 Высокомолекулярные соединения
- •4.1. Общие представления о высокомолекулярных соединениях
- •4.2. Методы синтеза высокомолекулярных соединений
- •4.3. Промышленные органические полимеры
- •Характеристика некоторых клеев и клеевых композиций представлена в разделе 4.1.1. (пример 7). Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ предисловие
- •3.4.1. Общие указания
- •3.4.2. Охрана труда и техника безопасности правила техники безопасности при работе в лаборатории оказание первой помощи при несчастных случаях
- •Первая помощь при ожогах и отравлениях
- •Растворители, применяемые для приготовления охлаждающих смесей с твердой углекислотой
- •Методы очистки и выделения органических соединений
- •Определение основных физических констант органических веществ
- •3.4.4. Лабораторные синтезы органических соединений
- •Отчет №
- •6. Выводы по работе. Синтезы азокрасителей
- •Получение полимеров реакцией полимеризации
- •Мономеры и вспомогательные вещества
- •Винилацетат (с4н6о2)
- •Пероксид бензоила (с14н10о4)
- •Получение полимеров реакцией поликонденсации
- •Мономеры и вспомогательные вещества
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольную работу и методические указания к ее выполнению
- •Распределение задач по шифрам для студентов специальности 150501.65
- •Контрольная работа
- •4.1.1. Примеры решения контрольных задач
- •Свойства отечественных полиэпоксидных смол
- •Свойства эпоксидных клеевых соединений в зависимости от природы отвердителя
- •4.2. Текущий контроль
- •Каменноугольная смола является источником…
- •Правильные ответы на тренировочный тест рубежного контроля
- •4.3. Итоговый контроль
- •Приложения
- •1. Основные сырьевые источники органических соединений
- •2. Углеводороды и радикалы (алкилы)
- •6. Краткая характеристика наиболее типичных полимеров, получаемых реакцией поликонденсации и методом полимераналогичных превращений
- •7. Полимерные композиционные материалы, свойства, области применения
- •О8. Свойства исходных соединений, применяемых в синтезах
Растворители, применяемые для приготовления охлаждающих смесей с твердой углекислотой
Растворитель |
Минимальная температура, С |
Эфир Ацетон Этанол Этанол при пониженном давлении Этиленгликоль Диэтиловый эфир диэтиленгликоля Моноэтиловый эфир этиленгликольацетата |
-90 -86 -75 -100 -15 -52 -77 |
Методы очистки и выделения органических соединений
Полученные при синтезе вещества, как правило, содержат некоторое количество примесей (исходные вещества, не вступившие в реакцию, побоч-
ные продукты, растворители, механические примеси и т.п.). Чтобы избавиться от них, применяют разнообразные методы очистки и разделения органических веществ, выбор которых зависит, в основном, от агрегатного состояния соединения.
Декантация – простейший прием отделения частиц твердого вещества от жидкости, состоящий в простом сливании жидкости с осадка. В этом случае, однако, невозможно достичь полного разделения в отличии от фильтрования [2].
Фильтрование – процесс отделения твердых компонентов смеси, находящихся в осадке, от маточных растворов (жидких компонентов) посредством пористой перегородки – фильтра. В качестве фильтра обычно применяют различной пористости фильтровальную бумагу, а также ткани, ас-
бест, пористое стекло или вату. Фильтрование проводят либо при нормальном, либо при пониженном давлении.
Фильтрование при атмосферном давлении – наиболее простой и часто применяемый в лабораторной практике способ, не требующий сложных приспособлений. Для этого необходимы стеклянная воронка и фильтр. Фильт-
ры могут быть двух видов: простые и складчатые (рис. 13 и 14). Последние имеют большую фильтрующую поверхность, что ускоряет процесс фильтрования.

Рис. 13. Изготовление гладкого фильтра Рис. 14. Изготовление складчатого фильтра из из круглого листа фильтровальной бумаги прямоугольного листа фильтровальной бумаги
Фильтрование при пониженном давлении применяют для ускорения процесса фильтрования. Аппаратура для фильтрования состоит из колбы Бунзена 1 и воронки Бюхнера 2 (рис. 15), которые присоединяют к водоструйному насосу 3 через предохранительную склянку 4.
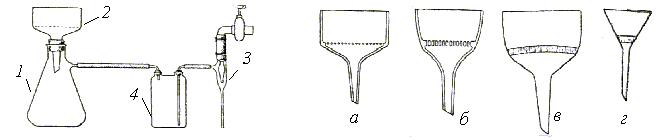
Рис. 15. Аппаратура для отсасывания
Кристаллизация или перекристаллизация – процесс образования и роста кристаллов из раствора, расплава или газовой среды. Кристаллизация из раствора – один из важнейших методов, применяемых для очистки твердых органических веществ. Основан он на различной растворимости органического вещества и сопутствующих ему примесей в данном растворителе при различных температурах. Процесс перекристаллизации включает в себя:
1) приготовление нагретого насыщенного раствора вещества в подходящем растворителе;
2) фильтрование горячего раствора от нерастворившихся и механических примесей;
3) охлаждение раствора с последующей кристаллизацией;
4) отделение кристаллов от маточного раствора;
5) сушку кристаллов.
При выборе растворителя руководствуются старым правилом: «подобное растворяется в подобном». Это означает, что соединения одного класса взаимно растворимы, например, высшие спирты растворяются в низших, простые эфиры растворимы в сложных эфирах и т. д. В общем, полярные соединения растворимы в полярных растворителях, таких как вода, спирты, кетоны, кислоты, и значительно менее – в неполярных растворителях, таких как четыреххлористый углерод или бензол.
Хорошо подобранный растворитель при температуре, близкой к точке кипения, должен растворять в пять раз больше вещества, чем при комнатной температуре. Если очищаемое вещество хорошо растворяется в растворителе при нагревании, но плохо кристаллизуется из него при охлаждении, кристаллизацию проводят из смеси различных растворителей, умело подобрав их соотношение. Часто смеси растворителей готовят из смеси спирта и воды, спирта и эфира, ацетона и воды, ацетона и петролейного эфира. При подборе растворителя следует обращать внимание на то, чтобы температура кипения растворителя была ниже температуры плавления вещества на 10…15 С, иначе вещество может выделиться в виде масла.
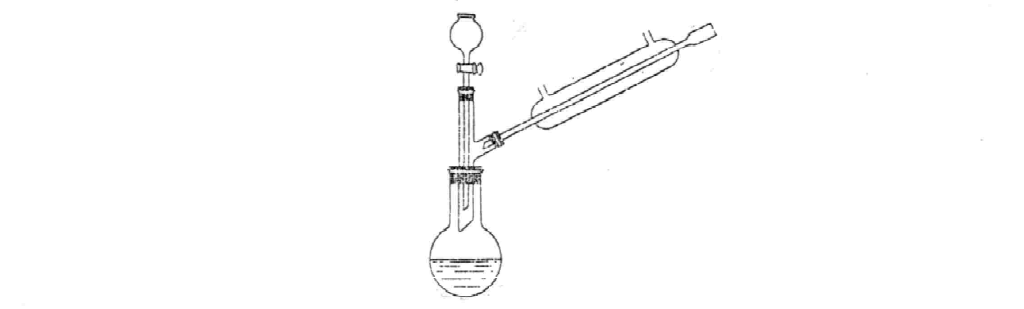 Рис.
16. Прибор для перекристаллизации веществ
Рис.
16. Прибор для перекристаллизации веществ
При этом необходимо учитывать следующие требования к растворите-
лям:
растворитель должен хорошо растворять вещество при нагревании и плохо – при охлаждении;
растворитель не должен химически взаимодействовать с очищае-
мым веществом;
растворитель желательно применять в минимальном количестве (иначе растворенное вещество не будет полностью выделяться при охлажде-
нии) [8].
При использовании легковоспламеняющихся растворителей (диоксан, бензол, этиловый спирт и др.) растворение необходимо вести при осторожном нагревании в круглодонной колбе (рис. 16) с обратным водяным холодильни-
ком.
Иногда твердый неочищенный продукт содержит окрашенные загряз-
нения или примеси продуктов полимеризации. Эти загрязнения трудно отде-
ляются кристаллизацией и могут быть извлечены из раствора до перекристал-
лизации при помощи различных сорбентов, например, активированного угля,
которые хорошо обесцвечивают водные растворы [8].
Экстракция. Под экстракцией (извлечением) понимают процесс пере-
хода вещества из одной фазы в другую. Этот процесс основан на различной растворимости веществ в двух несмешивающихся фазах. В процессе развития науки об экстракции сформировались названия ее различных типов: мацерация, дигерирование, перколяция, перфорация, экстрагирование и др. [2].
Наибольшее применение имеет экстракция вещества из водного раствора каким-либо органическим растворителем. Этот процесс наиболее эффективен, если вещество в органическом растворителе растворяется значительно лучше, чем в воде. Распределение вещества между двумя жидкими фазами подчиняется закону Нернста
![]() ,
(1)
,
(1)
где СА – концентрация растворенного вещества в одной фазе;
СВ - концентрация растворенного вещества во второй фазе.
Из формулы видно, что отношение концентраций растворенного вещества в двух жидких несмешивающихся фазах, находящихся в равновесии, является постоянной величиной при данной температуре. Это отношение концентраций называется коэффициентом распределения (К).
Список растворителей, наиболее употребляемых для экстракции, приведен в таблице 5.
При выборе растворителя в каждом конкретном случае необходимо учитывать следующие факторы [2]:
1. Взаимная растворимость фаз. Наиболее эффективны те растворители, которые лишь ограниченно растворимы друг в друге. Растворители, наименее растворимые друг в друге, расположены в табл. 3 на максимальном удалении друг от друга.
2. Растворимость данного вещества и селективность растворителя. Как правило, вещества, в которых преобладают гидрофобные группы (длинные алифатические цепи, бензольные ядра и т.д.), лучше растворимы в растворителях с низкой диэлектрической проницаемостью (они находятся в начале таблицы). И наоборот, растворители с высокой диэлектрической проницаемостью, размещенные в конце этой таблицы, удобно использовать для экстракции веществ, имеющих гидрофильные группы.
3. Устойчивость вещества в растворе. Как правило, вещества в растворе гораздо менее стабильны, чем в твердом состоянии. Например, при
Таблица 5
Некоторые наиболее употребляемые для экстракции растворители
Растворитель |
Т. кип., С |
Удельный вес |
Гексан Бензол Толуол Тетрахлорэтилен Четыреххлористый углерод Хлороформ Диэтиловый эфир Ацетон Диоксан Этилацетат Нитробензол Первичный амиловый спирт Этиловый спирт Метиловый спирт Ледяная уксусная кислота Вода |
68,7 80 111 121 77 61 35 56 101 77 211 138 78 65 118 100 |
0,65 0,88 0,87 1,62 1,60 1,50 0,72 0,79 1,03 0,90 1,22 0,89 0,79 0,79 1,05 1,00 |
экстрагировании органических кислот спиртом необходимо учитывать воз-
можность этерификации. Наоборот, сильнощелочная среда может ускорить гидролиз сложных эфиров, взятых в качестве растворителя.
4. Чистота и устойчивость растворителя. Растворитель должен упариваться без остатка и не должен содержать примесей, влияющих на результаты анализа.
5. Различие удельных весов обеих фаз (на 0,1…0,2). От этого фактора в значительной степени зависит скорость расслаивания фаз.
6. Склонность к образованию эмульсий. Часто, особенно при экстрагиро-
вании щелочных растворов, образуются эмульсии, которые можно разрушить, добавляя небольшие количества противовспенивающих веществ (спирт, ацетон, бензол), или оставив стоять на некоторое время для расслаивания.
7. Простота в обращении и безопасность. Следует помнить, что такие растворители, как эфир, сероуглерод, углеводороды, очень легко воспламеняя-
ются.
8. Легкость удаления растворителя из экстракта. Для экстракции из водных растворов наиболее часто используют эфир, бензол, хлороформ, дихлорэтан, этилацетат и др. В тех случаях, когда экстрагируемое вещество обладает относительно высокой растворимостью в экстрагируемой фазе (особенно в воде), применяют метод высаливания. Для этого к раствору добавляют сухие соли, обладающие высокой растворимостью в воде (NaCl, MgSO4, (NH4)2SO4, K2CO3 и т.д.). При этом меняется плотность раствора и экстракция облегчается.
Проведение
экстрагирования.
Экстрагирование вещества проводят в
делительной воронке (рис. 12, в,
г).
Предварительно необходимо смазать кран
и пробку делительной воронки смазкой
и убедиться в их герметичности. В
делительную воронку наливают раствор
вещества и экстрагирующий растворитель,
например эфир, причем общее количество
жидкости не должно превышать
![]() объёма воронки, а объём растворителя
должен составлять
объёма воронки, а объём растворителя
должен составлять
![]() часть
от объёма раствора. Воронку закрывают
пробкой и, придерживая одной рукой
пробку, а другой - кран, осторожно
встряхивают воронку, держа ее в
горизонтальном положении.
часть
от объёма раствора. Воронку закрывают
пробкой и, придерживая одной рукой
пробку, а другой - кран, осторожно
встряхивают воронку, держа ее в
горизонтальном положении.
Затем воронку поворачивают пробкой вниз и открывают кран для выравнивания избыточного давления, возникающего в результате испарения эфира. Затем воронку опять встряхивают в горизонтальном положении. Осто-рожное встряхивание и выравнивание давления производят до тех пор, пока воздушное пространство над жидкостью не насытится парами растворителя. В этом случае при открывании крана не будет характерного шипения. После этого встряхивание проводят еще несколько раз. По окончании встряхивания воронку закрепляют в штативе при помощи лапки и кольца. Дав смеси расслоиться, слои разделяют, спуская нижний слой в колбочку через кран, а верхний – через верхнее отверстие воронки.
Экстракцию повторяют до тех пор, пока вещество перестанет переходить в растворитель, в чем можно убедиться, испаряя каплю экстрак-
та на часовом стекле. В том случае, когда трудно определить, какой из слоев водный, каплю каждого из слоев приливают в пробирки с водой и определяют, в какой пробирке происходит смешивание. В случае окрашенных растворов экстрагирование проводят до тех пор, пока не прекратится окрашивание растворителя.
При работе с сильнокислыми, щелочными или раздражающими раство-
рами следует надевать резиновые перчатки и защитные очки.
Необходимо помнить, что при добавлении к кислому раствору раствора соды выделяется углекислый газ, что приводит к повышению давления в воронке. При встряхивании может выбить пробку. Повышенное давление следует снижать осторожно, открыв кран воронки.
Полученный экстракт очищают от посторонних веществ (чаще всего кислот и оснований), увлеченных с растворителем при экстракции. Для этого экстракт промывают: встряхивают несколько раз с разбавленным водным раствором щелочи (лучше соды) или кислоты и несколько раз затем промываютводой. После этого экстракт высушивают подходящим осушителем.
Осушение. Осушение – это операция, при которой из твердого, жидкого или газообразного вещества или смеси веществ удаляется небольшое количество посторонней жидкости или ее паров [2]. Обычно под осушением понимают удаление воды или водяных паров или же операцию, с помощью которой после проведения перекристаллизации удаляют остатки органического растворителя.
Для осушения газов, жидкостей и твердых веществ очень часто употребляют химические реагенты, отнимающие воду. Их можно разделить по способу связывания ими влаги на три основные группы.
1. Гигроскопичные вещества, образующие с водой гидраты. Они пред-
ставляют собой безводные соли, либо низшие гидраты, переходящие при контакте с водой в более устойчивые высшие гидраты. Из осушителей этой группы наиболее часто употребляют безводные CaCl2, CaBr2, NaOH, KOH, Na2SO4, MgSO4, Mg(ClO4)2, Mg(ClO4)2·H2O, Ba(ClO4)2, CaSO4.
2. Вещества, связывающие воду в результате химической реакции. К этой группе осушителей принадлежат металлы и их сплавы, окислы металлов и неметаллов: Na, K, Ca, CaH2, CaC2, CaO, BaO, B2O3, P2O5.
3. Вещества, поглощающие воду за счет физической адсорбции: силика-гель, цеолиты, Al2O3.
Способ высушивания определяется природой вещества, его агрегатным состоянием и характером растворителя [8].
Твердые вещества обычно сушат на воздухе при комнатной температуре или в сушильном шкафу при повышенной температуре (температура в шкафу должна быть значительно ниже температуры плавления вещества). Для более эффективного высушивания применяют эксикаторы, на дно которых помеща-
ют подходящие осушители (P2O5, безводные CaCl2, MgSO4 и др.). Для ускоре-
ния процесса высушивания используют вакуум-эксикатор.
Жидкие вещества высушивают с помощью твердых неорганических веществ, способных поглощать воду и образовывать при этом кристаллогид-
раты (первая группа осушителей). Жидкость или раствор встряхивают с небольшим количеством (не более 1-3 % от массы раствора) подходящего осушителя, так как слишком большое количество осушителя вызывает потерю вещества. Колбу, содержащую жидкость и осушитель, закрывают пробкой с хлоркальциевой трубкой (рис. 9, а) и оставляют стоять некоторое время до полного устранения влаги.
Осушающие агенты должны быть инертны к осушаемому веществу, не должны в нем растворяться и должны иметь возможно большую осушающую эффективность. Для осушения основных типов органических жидкостей во всех случаях можно употреблять сульфаты натрия, магния и кальция.
Перегонка ─ процесс отделения жидких веществ от нелетучих примесей или разделения летучих веществ с различной температурой кипения [8]. Это достигается нагреванием жидкости до кипения и последующей конденсацией ее паров в холодильнике. При перегонке чистого вещества температура кипения постоянна, так как состав жидкости и пара одинаков.
Зависимость температуры кипения от давления. Давление паров жидкости сильно возрастает с температурой. Когда давление пара становится равным внешнему давлению, оказываемому на поверхность жидкости, последняя начинает кипеть. Как правило, при этих условиях температура жидкости больше не повышается. С усилением нагревания кипящей жидкости повышается скорость парообразования.
Температурой кипения называется температура, при которой давление пара жидкости в каждой точке над ее поверхностью равно внешнему давлению. Внешнее давление на жидкость оказывают атмосферный воздух, другие газы, пары и т. д. Температура кипения при 760 мм рт.ст. называется нормальной температурой кипения. Чем ниже внешнее давление, тем ниже температура кипения жидкости.
Существуют три способа перегонки жидкости:
а) при нормальном давлении (простая и фракционная перегонка);
б) при пониженном давлении (перегонка в вакууме);
в) с водяным паром.
Простая перегонка при атмосферном давлении. Этот способ приме-
няют, если разница в температурах кипения веществ, входящих в состав разделяемой смеси, не менее 80-100 оС или если основное вещество необходимо отделить от нелетучих примесей.
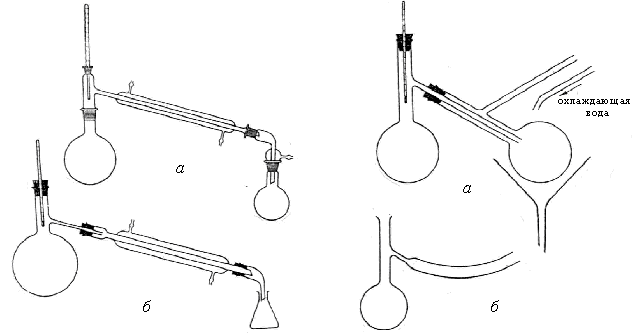
Простейший прибор для перегонки состоит из перегонной колбы, холодильника, алонжа и приемника. Термометр, показывающий температуру кипения перегоняемой жидкости, размещают так, чтобы шарик ртути находился чуть ниже боковой трубки (рис. 17, а, б) и полностью омывался парами.
Водяное охлаждение можно применять при перегонке жидкостей, кипя-щих до 120 С. При перегонке веществ с более высокой температурой кипения подачу холодной воды следует прекратить и охлаждать пары только нагретой водой, имеющейся в рубашке холодильника, или вообще выпустить воду из холодильника.
Следует помнить, что при слишком быстрой перегонке любой водяной
Рис. 17. Приборы для простой перегонки |
холодильник может дать трещину. При температуре кипения перегоняе-мой жидкости выше 160 С рекомен-дуется пользоваться воздушным холо- дильником. Чтобы жидкость кипела равно- мерно, в колбу помещают «кипелки» ─ кусочки пористого материала (например, обожженныйнеглазурован- ный фарфор или стеклянные капилля- ры, запаянные с одного конца и погру женные в жидкость другим концом). Скорость перегонки регулируется скоростью поступления жидкости в приемник (не более 1-2 капель в секунду). |
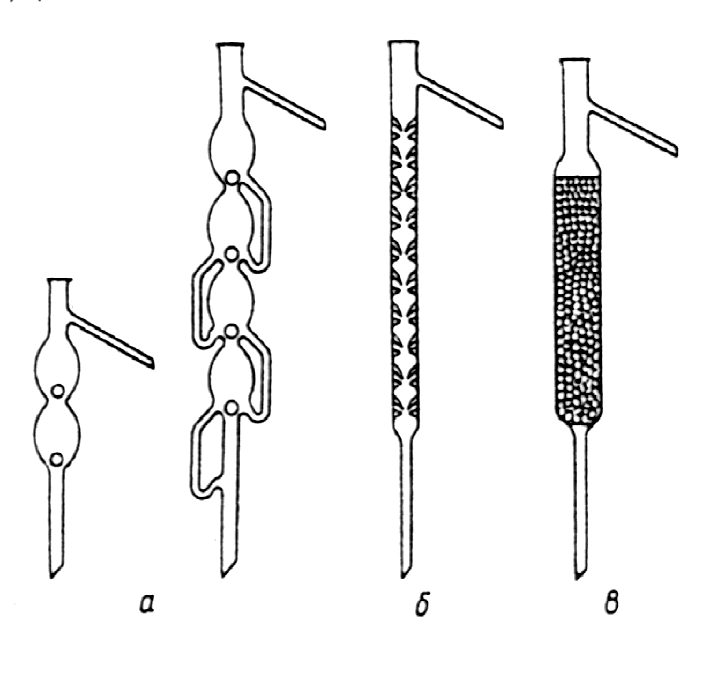
Фракционная перегонка. Если перегоняемая смесь состоит из компонентов, температуры кипения которых близки и которые не образуют азеотропных смесей, применяют дробную, или фракционную, перегонку. Для этого обычно используют дефлегматоры (рис. 18) и ректификационные колонки. В них часть паров перегоняемой смеси конденсируется за счет охлаж-
Рис. 18. Дефлегматоры: а – шариковые; б – елочный; в – с насадкой |
дения наружным воздухом), превра-щаясь в жидкость, обогащенную срав-нительно высококипящим компонен-том. Оставшийся пар, наоборот, обога-щается более летучей частью смеси. Таким образом, пары, проходящие через колонку, богаче летучим компонентом, по сравнению с парами, находящимися над перегоняемой жидкостью. Жидкость (конденсат), стекающая в колбу, наоборот, содер-жит высококипящие вещества. Если температура кипения перегоняемых |
жидкостей не выше 80 оС (спирт, ацетон, эфир, бензол и пр.), то нагревание проводят на водяной бане.
Перегонка в вакууме. Если перегоняемые вещества полностью или частично разлагаются при температуре кипения (при атмосферном давлении), применяют перегонку при пониженном давлении. Это приводит к снижению
температуры кипения веществ, а также устраняется возможность их разложе-
ния.
Вакуум-перегонку ведут с такой же скоростью, как и перегонку при атмосферном давлении, в защитных очках или защитным щитком. Категори-
чески запрещается при наличии вакуума в системе делать какие-либо исправления в перегонной установке.
Перегонка с водяным паром. Этот метод применяют:
1) для разделения смесей веществ, из которых только одно летуче с водяным паром;
2) для очистки веществ от смолистых примесей;
3) если она обеспечивает более полное разделение летучих веществ, нежели перегонка под уменьшенным давлением. Установка для перегонки с водяным паром изображена на рис. 19.
Водяной пар получают в металлическом паровике 5, который должен быть снабжен доходящей почти до самого дна предохранительной трубкой 8. Через трубку при охлаждении парообразователя может поступать воздух. Чтобы избежать значительного увеличения объема перегоняемой жидкости за счет конденсации водяных паров и предотвратить переполнение перегонной колбы водой, ее нужно нагревать. Трубка 6, по которой пар поступает в колбу, должна доходить до самого ее дна. Это позволяет наиболее экономно расходовать водяной пар. Перегонку ведут до тех пор, пока дистиллят не перестанет разделяться на две фазы. После того как начнет перегоняться одна вода, открывают зажим 10 и лишь после этого прекращают нагревание парообразователя.
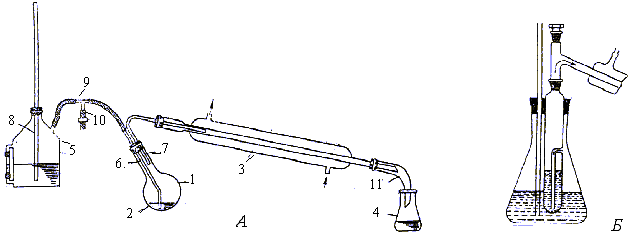
Рис. 19. Установка для перегонки с водяным паром:
1 – круглодонная колба с длинным горлом; 2 – перегоняемое вещество и вода; 3 – холоди- льник; 4 – приемник; 5 – парообразователь; 6 – трубка, по которой поступает пар; 7 – пароотводная трубка; 8 – предохранительная трубка; 9 – тройник; 10 – винтовой зажим; 11 – алонж.