
- •НАВЧАЛЬНИЙ ПОСІБНИК
- •1. ТЕХНІКА БЕЗПЕКИ В ХІМІЧНІЙ ЛАБОРАТОРІЇ
- •1.1. ЗАГАЛЬНІ ПРАВИЛА РОБОТИ В ХІМІЧНІЙ ЛАБОТАТОРІЇ
- •1.2. НАДАННЯ ПЕРШОЇ ДОПОМОГИ
- •2. УСТАТКУВАННЯ І ТЕХНІКА ВИКОНАННЯ ЛАБОРАТОРНИХ РОБІТ
- •2.1. ХІМІЧНИЙ ЛАБОРАТОРНИЙ ПОСУД
- •2.2. НЕСКЛЯНИЙ ПОСУД
- •2.3. ХІМІЧНІ РЕАКТИВИ ТА ЇХ ЗБЕРІГАННЯ
- •2.3.1. Зберігання хімічних реактивів
- •2.3.2. Користування реактивами
- •2.3.3. Класифікація реактивів
- •2.4. МЕТОДИ ОЧИСТКИ ТА ВИДІЛЕННЯ ОРГАНІЧНИХ РЕЧОВИН
- •2.4.1. Очищення методом кристалізації
- •ДОСЛІД 1. ПЕРЕКРИСТАЛІЗАЦІЯ БЕНЗОЙНОЇ КИСЛОТИ
- •ДОСЛІД 2. ОЧИЩЕННЯ ЩАВЛЕВОЇ КИСЛОТИ
- •2.4.2. Очищення методом сублімації
- •ДОСЛІД 1. СУБЛІМАЦІЯ НАФТАЛІНУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.3. Перегонка або дистиляція
- •ДОСЛІД 1. ПРОСТА ПЕРЕГОНКА ЕТАНОЛУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.4. ВИЗНАЧЕННЯ ОСНОВНИХ ФІЗИЧНИХ КОНСТАНТ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ ПЛАВЛЕННЯ
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ КИПІННЯ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ПОКАЗНИКА ЗАЛОМЛЕННЯ РІДИНИ
- •Контрольні запитання та завдання
- •2.4.5. ЗНЕВОДНЕННЯ ОРГАНІЧНИХ РЕАКТИВІВ
- •2.4.6. Фільтрування
- •Фільтрування через паперові фільтри
- •Правила фільтрування
- •Промивання осадів
- •Правила роботи з центрифугою.
- •ДОСЛІД 1. ЗРІВНОВАЖЕННЯ ЦЕНТРИФУЖНИХ ПРОБІРОК
- •ДОСЛІД 2. ЦЕНТРИФУГУВАННЯ РОЗЧИНІВ
- •3. РОЗЧИНИ ХІМІЧНИХ РЕАКТИВІВ ТА ЇХ ПРИГОТУВАННЯ
- •3.1. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
- •3.2. РОЗРАХУНКИ ДЛЯ ПРИГОТУВАННЯ РОЗЧИНІВ ПЕВНОЇ КОНЦЕНТРАЦІЇ
- •3.3. ПРИГОТУВАННЯ РОЗЧИНІВ ІЗ ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ РЕЧОВИНИ
- •ДОСЛІД 1. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ)
- •ДОСЛІД 2. ПРИГОТУВАННЯ РОЗЧИНУ МЕНШОЇ КОНЦЕНТРАЦІЇ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ) ІЗ РОЗЧИНУ З БІЛЬШОЮ КОНЦЕНТРАЦІЄЮ
- •ДОСЛІД 5. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •ДОСЛІД 6. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ ЕКВІВАЛЕНТУ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •Приготувати 1 л 0,1 н розчину H2SO4.
- •Розчини з молярною концентрацією еквіваленту розчиненої речовини готують аналогічно молярним, тільки беруть наважку речовини, що відповідає не молярній масі речовини, а молярній масі еквіваленту речовини.
- •3.4. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
- •Контрольні запитання та завдання
- •4. ЯКІСНИЙ ЕЛЕМЕНТНИЙ АНАЛІЗ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИДОЗМІНЕННЯ ОРГАНІЧНОЇ РЕЧОВИНИ ЗА ПРОЖАРЮВАННЯ
- •ДОСЛІД 2. ВІДКРИТТЯ КАРБОНУ ТА ГІДРОГЕНУ
- •ДОСЛІД 3. ВІДКРИТТЯ НІТРОГЕНУ
- •ДОСЛІД 4. ВІДКРИТТЯ СУЛЬФУРУ
- •ДОСЛІД 5. ВІДКРИТТЯ ГАЛОГЕНІВ
- •Контрольні запитання та завдання
- •5. ВУГЛЕВОДНІ
- •5.1. НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ МЕТАНУ З НАТРІЙ АЦЕТАТУ
- •ДОСЛІД 2. ОДЕРЖАННЯ МЕТАНУ СУХОЮ ПЕРЕГОНКОЮ ДЕРЕВИНИ
- •ДОСЛІД 3. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ МЕТАНУ
- •ДОСЛІД 4. БРОМУВАННЯ ОКТАНУ
- •Контрольні запитання та завдання
- •5.2. НЕНАСИЧЕНІ ЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКЕНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ ЕТЕНУ
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО ЕТЕНУ
- •ДОСЛІД 3. М’ЯКЕ ОКИСНЕННЯ ЕТИЛЕНУ (РЕАКЦІЯ ВАГНЕРА)
- •ДОСЛІД 4. ГОРІННЯ ЕТЕНУ
- •ДОСЛІД 5. ВЗАЄМОДІЯ КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТИ З ВУГЛЕВОДНЯМИ
- •5.3. НЕНАСИЧЕНІ АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКІНИ)
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО АЦЕТИЛЕНУ
- •ДОСЛІД 3. ОКИСНЕННЯ АЦЕТИЛЕНУ
- •ДОСЛІД 4. УТВОРЕННЯ АЦЕТИЛЕНІДІВ
- •Утворення аргентум(І) ацетиленіду
- •Утворення купрум(І) ацетиленіду
- •6. АРОМАТИЧНІ ВУГЛЕВОДНІ (АРЕНИ)
- •ДОСЛІД 1. БРОМУВАННЯ БЕНЗЕНУ ТА ТОЛУЕНУ
- •ДОСЛІД 2. НІТРУВАННЯ БЕНЗЕНУ
- •ДОСЛІД 3. СУЛЬФУВАННЯ ТОЛУЕНУ
- •ДОСЛІД 4. ОКИСНЕННЯ АРОМАТИЧНИХ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. НІТРУВАННЯ НАФТАЛІНУ
- •Контрольні запитання та завдання
- •7. ГАЛОГЕНПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 1. ГІДРОЛІЗ ХЛОРОФОРМУ
- •ДОСЛІД 2. ОДЕРЖАННЯ ЙОДОФОРМУ З ЕТАНОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ХЛОРЕТАНУ
- •ДОСЛІД 4. КОЛЬОРОВА РЕАКЦІЯ НА ГАЛАГЕНОПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. ВИЗНАЧЕННЯ ЧИСТОТИ ХЛОРОФОРМУ
- •ДОСЛІД 6. ОДЕРЖАННЯ БРОМЕТАНУ
- •8. СПИРТИ
- •8. СПИРТИ
- •ДОСЛІД 1. РОЗЧИННІСТЬ СПИРТІВ У ВОДІ
- •ДОСЛІД 2. ВИЯВЛЕННЯ НАЯВНОСТІ ВОДИ У ЕТАНОЛІ ТА ЙОГО ЗНЕВОДНЕННЯ
- •ДОСЛІД 3. РЕАКЦІЯ СПИРТІВ НА ЛАКМУС
- •ДОСЛІД 4. РЕАКЦІЯ З СІРКОВУГЛЕЦЕМ ТА ЛУГОМ НА ПЕРВИННІ ТА ВТОРИННІ СПИРТИ (КСАНТОГЕНОВА ПРОБА)
- •ДОСЛІД 5. РЕАКЦІЇ НА ФУНКЦІОНАЛЬНУ (ГІДРОКСИЛЬНУ) ГРУПУ СПИРТІВ. ЯКІСНА РЕАКЦІЯ НА ПЕРВИННІ, ВТОРИННІ ТА ТРЕТИННІ СПИРТИ. РЕАКЦІЯ З РОЗЧИНОМ ЦИНК ХЛОРИДУ
- •ДОСЛІД 6. РЕАКЦІЯ З МЕТАЛІЧНИМ НАТРІЄМ. ГІДРОЛІЗ АЛКОГОЛЯТУ НАТРІЮ
- •ДОСЛІД 7. ОТРИМАННЯ ДІЕТИЛОВОГО ЕТЕРУ (ЕФІРУ)
- •ДОСЛІД 8. ОКИСНЕННЯ ЕТАНОЛУ
- •ДОСЛІД 9. ОКИСНЕННЯ СПИРТІВ КАЛІЙ ДИХРОМАТОМ
- •ДОСЛІД 10. ЯКІСНА РЕАКЦІЯ НА ГЛІКОЛІ ТА БАГАТОАТОМНІ СПИРТИ З КУПРУМ(II) ГІДРОКСИДОМ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •9. ФЕНОЛИ
- •Практичне значення фенолів
- •ДОСЛІД 1. КОЛЬОРОВІ (ЯКІСНІ) РЕКЦІЇ ФЕНОЛІВ І НАФТОЛІВ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 2. РОЗЧИННІСТЬ ФЕНОЛУ У ВОДІ
- •ДОСЛІД 3. КИСЛОТНІ ВЛАСТИВОСТІ ФЕНОЛУ. ОДЕРЖАННЯ НАТРІЙ ФЕНОЛЯТУ
- •ДОСЛІД 4. ДІЯ БРОМНОЇ ВОДИ НА ФЕНОЛ
- •ДОСЛІД 5. НІТРУВАННЯ ФЕНОЛУ
- •ДОСЛІД 6. КОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ (УТВОРЕННЯ ФЕНОЛОФОРМАЛЬДЕГІДНОЇ СМОЛИ)
- •10. АЛЬДЕГІДИ ТА КЕТОНИ
- •Практичне значення альдегідів та кетонів
- •ДОСЛІД 1. РЕАКЦІЯ З ФУКСИНСУЛЬФІТНОЮ КИСЛОТОЮ (РЕАКЦІЯ ШИФФА, ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 2. РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА” (ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 4. РЕАКЦІЯ З РЕАКТИВОМ ФЕЛІНГА (ЯКІСНА РЕАКЦІЯ НА АЛЬДЕГІДИ)
- •ДОСЛІД 5. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ АМОНІАЧНИМ РОЗЧИНОМ АРГЕНТУМ(І) ГІДРОКСИДУ
- •ДОСЛІД 6. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ РОЗЧИНОМ КАЛІЙ МАНГАНАТУ(VІІ)
- •ДОСЛІД 7. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ КИСНЕМ ПОВІТРЯ
- •ДОСЛІД 8. ПОЛІМЕРИЗАЦІЯ ФОРМАЛЬДЕГІДУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ТА ГІДРОЛІЗ ГЕКСАМЕТИЛЕНТЕТРАМІНУ (УРОТРОПІНУ)
- •ДОСЛІД 10. ОДЕРЖАННЯ МУРАШИНОГО ТА ОЦТОВОГО АЛЬДЕГІДІВ ОКИСНЕННЯМ СПИРТІВ
- •ДОСЛІД 11. РЕАКЦІЯ ДИСМУТАЦІЇ (РЕАКЦІЯ КАННІЦЦАРО)
- •ДОСЛІД 12. ОДЕРЖАННЯ АЦЕТОНУ ІЗ КАЛЬЦІЙ АЦЕТАТУ
- •ДОСЛІД 13. УТВОРЕННЯ ЙОДОФОРМУ ІЗ АЦЕТОНУ. ЯКІСНІ РЕАКЦІЇ НА АЦЕТОН
- •Контрольні запитання та завдання
- •11. КАРБОНОВІ КИСЛОТИ
- •11.1. ОДНООСНОВНІ (МОНОКАРБОНОВІ) КИСЛОТИ
- •ДОСЛІД 1. ДИСОЦІАЦІЯ ОЦТОВОЇ КИСЛОТИ
- •ДОСЛІД 2. ДОБУВАННЯ ФЕРУМ(ІІІ) АЦЕТАТУ ТА ЙОГО ГІДРОЛІЗ
- •ДОСЛІД 3. ВИТІСНЕННЯ СЛАБКИХ КИСЛОТ БІЛЬШ СИЛЬНИМИ З ЇХ СОЛЕЙ (РЕАКЦІЯ З НАТРІЙ КАРБОНАТОМ)
- •ДОСЛІД 4. ОДЕРЖАННЯ МУРАШИНОЇ (МЕТАНОВОЇ) КИСЛОТИ ІЗ ХЛОРОФОРМУ
- •ДОСЛІД 5. ОКИСНЕННЯ НАСИЧЕНИХ КАРБОНОВИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ НЕНАСИЧЕНОЇ (ОЛЕЇНОВОЇ) КИСЛОТИ
- •ДОСЛІД 7. БРОМУВАННЯ ОЛЕЇНОВОЇ КИСЛОТИ
- •ДОСЛІД 9. ІЗОМЕРИЗАЦІЯ ОЛЕЇНОВОЇ КИСЛОТИ В ЕЛАЇДИНОВУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ ІЗ МИЛА
- •Контрольні запитання та завдання
- •11.2. ДВОХОСНОВНІ (ДИКАРБОНОВІ) КИСЛОТИ
- •Фізичні властивості дикарбонових кислот
- •Практичне значення дикарбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ НАТРІЙ ОКСАЛАТУ
- •ДОСЛІД 2. РОЗКЛАДАННЯ ОКСАЛАТНОЇ (ЕТАНДІОВОЇ) КИСЛОТИ ПРИ НАГРІВАННІ (РЕАКЦІЯ ДЕКАРБОКСИЛУВАННЯ)
- •ДОСЛІД 3. ОКИСНЕННЯ ОКСАЛАТНОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ ОКСАЛАТНОЇ КИСЛОТИ З ЛУГОМ
- •ДОСЛІД 5. ОДЕРЖАННЯ АНГІДРИДУ БУРШТИНОВОЇ КИСЛОТИ
- •Контрольні запитання та завдання
- •11.3. ГІДРОКСИКИСЛОТИ ТА ОКСОКИСЛОТИ
- •ДОСЛІД 1. ВЗАЄМОДІЯ ГІДРОКСИКИСЛОТ З ФЕРУМ(ІІІ) ХЛОРИДОМ (ЯКІСНА РЕАКЦІЯ НА ГІДРОКСИКИСЛОТИ)
- •ДОСЛІД 2. ОКИСНЕННЯ МОЛОЧНОЇ ТА ВИННОЇ КИСЛОТ
- •ДОСЛІД 3. ОДЕРЖАННЯ КИСЛОЇ ТА СЕРЕДНЬОЇ КАЛІЄВИХ СОЛЕЙ ВИННОЇ КИСЛОТИ
- •ДОСЛІД 4. ОДЕРЖАННЯ СЕГНЕТОВОЇ СОЛІ
- •ДОСЛІД 5. ВЗАЄМОДІЯ СЕГНЕТОВОЇ СОЛІ З КУПРУМ(ІІ) ГІДРОКСИДОМ (ОДЕРЖАННЯ РЕАКТИВУ ФЕЛІНГА)
- •ДОСЛІД 6. РОЗКЛАДАННЯ ЛИМОННОЇ (ЦИТРАТНОЇ КИСЛОТИ) СУЛЬФАТНОЮ КИСЛОТОЮ
- •Контрольні запитання та завдання
- •11.4. АРОМАТИЧНІ КИСЛОТИ. ФЕНОЛОКИСЛОТИ
- •Практичне значення ароматичних карбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ БЕНЗОЙНОЇ КИСЛОТИ З ТОЛУЕНУ
- •ДОСЛІД 2. ОЧИЩЕННЯ БЕНЗОЙНОЇ КИСЛОТИ СУБЛІМАЦІЄЮ
- •ДОСЛІД 3. РОЗКЛАДАННЯ САЛІЦИЛОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ БЕНЗОЙНОЇ ТА САЛІЦИЛОВОЇ КИСЛОТ ІЗ ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 5. КОЛЬОРОВА РЕАКЦІЯ ФЕНІЛСАЛІЦИЛАТУ (САЛОЛУ) З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 6. ДІЯ БРОМНОЇ ВОДИ НА САЛІЦИЛОВУ ТА БЕНЗОЙНУ КИСЛОТИ
- •ДОСЛІД 7. ОКИСНЕННЯ КОРИЧНОЇ КИСЛОТИ
- •ДОСЛІД 8. КОЛЬОРОВІ РЕАКЦІЇ ГАЛОВОЇ КИСЛОТИ І ТАНІНУ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 9. ОДЕРЖАННЯ ФЕНОЛФТАЛЕЇНУ
- •Контрольні запитання та завдання
- •12. ЕСТЕРИ
- •Практичне значення естерів
- •ДОСЛІД 1. ДОБУВАННЯ ЕТИЛЕТАНОАТУ (ЕТИЛАЦЕТАТУ)
- •ДОСЛІД 3. ДОБУВАННЯ ІЗОАМІЛМЕТИЛБУТАНОАТУ («ЯБЛУЧНОЇ ЕСЕНЦІЇ»)
- •ДОСЛІД 4. ДОБУВАННЯ ЕТИЛБЕНЗОАТУ
- •ДОСЛІД 6. ГІДРОЛІЗ АЦЕТИЛСАЛІЦИЛОВОЇ КИСЛОТИ (АСПІРИНУ)
- •Контрольні запитання та завдання
- •13.1. Прості ліпіди
- •Практичне значення жирів
- •ДОСЛІД 1. ОМИЛЕННЯ ЖИРІВ ЛУГОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ ГЛІЦЕРОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ З МИЛА
- •ДОСЛІД 4. УТВОРЕННЯ НЕРОЗЧИННОГО У ВОДІ МИЛА
- •ДОСЛІД 5. ВИЯВЛЕННЯ В ЖИРАХ ЗАЛИШКІВ НЕНАСИЧЕНИХ ЖИРНИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ РОСЛИННИХ ОЛІЙ
- •ДОСЛІД 7. ЕМУЛЬГУВАННЯ ЖИРІВ
- •ДОСЛІД 8. ВИЗНАЧЕННЯ ЙОДНОГО ЧИСЛА
- •ДОСЛІД 9. ВИЗНАЧЕННЯ КИСЛОТНОГО ЧИСЛА
- •Контрольні запитання та завдання
- •13.2. Складні ліпіди
- •13.3. Ізопреноїди
- •ДОСЛІД 1. ПЕРЕГОНКА ЖИВИЦІ
- •ДОСЛІД 2. ФРАКЦІОНУВАННЯ СКИПИДАРУ
- •ДОСЛІД 3. ДІЯ БРОМНОЇ ВОДИ НА СКИПИДАР
- •ДОСЛІД 4. ОКИСНЕННЯ СКИПИДАРУ КАЛІЙ МАНГАНАТОМ(VII)
- •ДОСЛІД 5. ОДЕРЖАННЯ ТЕРПІНЕОЛУ З ТЕРПІНГІДРАТУ
- •14. ВУГЛЕВОДИ
- •14.1. Моносахариди
- •Практичне значення моносахаридів
- •ДОСЛІД 1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ГЛЮКОЗІ
- •ДОСЛІД 3. ОКИСНЕННЯ АЛЬДОЗ АМОНІАЧНИМ РОЗЧИНОМ АРҐЕНТУМ(І) ГІДРОКСИДУ (РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА”)
- •ДОСЛІД 4. ВЗАЄМОДІЯ ГЛЮКОЗИ З РЕАКТИВОМ ФЕЛІНГА
- •ДОСЛІД 5. РЕАКЦІЯ СЕЛІВАНОВА НА ФРУКТОЗУ
- •ДОСЛІД 6. ВИЗНАЧЕННЯ АСКОРБІНОВОЇ КИСЛОТИ (ВІТАМІНУ С). ЯКІСНА РЕАКЦІЯ НА ВІТАМІН С
- •Контрольні запитання та завдання
- •14.2. Дисахариди
- •ДОСЛІД1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ДИСАХАРИДАХ
- •ДОСЛІД 2. ДІЯ РЕАКТИВУ ФЕЛІНГА НА ДИСАХАРИДИ
- •ДОСЛІД 3. ГІДРОЛІЗ (ІНВЕРСІЯ) САХАРОЗИ
- •ДОСЛІД 4. ЯКІСНА РЕАКЦІЯ НА САХАРОЗУ
- •Контрольні запитання та завдання
- •14.3. Полісахариди
- •Практичне значення полісахаридів
- •ДОСЛІД 1. КОЛЬОРОВА РЕАКЦІЯ НА КРОХМАЛЬ
- •ДОСЛІД 2. РЕАГУВАННЯ КРОХМАЛЮ НА РЕАКТИВ ФЕЛІНГА
- •ДОСЛІД 3. КИСЛОТНИЙ ГІДРОЛІЗ КРОХМАЛЮ
- •ДОСЛІД 4. КИСЛОТНИЙ ГІДРОЛІЗ КЛІТКОВИНИ (ЦЕЛЮЛОЗИ)
- •ДОСЛІД 5. ОДЕРЖАННЯ ШТУЧНОГО ПЕРГАМЕНТУ
- •ДОСЛІД 6. ХАРАКТЕРНІ РЕАКЦІЇ НА ЛІГНІН
- •Контрольні запитання та завдання
- •Практичне значення амінів
- •ДОСЛІД 1. ОТРИМАННЯ МЕТИЛАМІНУ З АЦЕТАМІДУ
- •ДОСЛІД 2. РЕАКЦІЯ ВОДНОГО РОЗЧИНУ МЕТИЛАМІНУ НА ІНДИКАТОРИ
- •ДОСЛІД 3. РЕАКЦІЯ ГАЗУВАТОГО МЕТИЛАМІНУ З КОНЦЕНТРОВАНОЮ СОЛЯНОЮ КИСЛОТОЮ
- •ДОСЛІД 4. РЕАКЦІЯ МЕТИЛАМІНУ З НІТРАТНОЮ(ІІІ) КИСЛОТОЮ
- •ДОСЛІД 6. УТВОРЕННЯ СОЛЕЙ АНІЛІНУ
- •ДОСЛІД 7. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ ХЛОРНОГО ВАПНА
- •ДОСЛІД 8. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ КАЛІЙ ДИХРОМАТУ
- •ДОСЛІД 9. ДІЯ БРОМНОЇ ВОДИ НА АНІЛІН
- •ДОСЛІД 10. КОНДЕНСАЦІЯ АНІЛІНУ З ФОРМАЛЬДЕГІДОМ
- •Контрольні запитання та завдання
- •16. ДІАЗОСПОЛУКИ ТА АЗОБАРВНИКИ
- •ДОСЛІД 1. ДІАЗОТУВАННЯ АНІЛІНУ
- •ДОСЛІД 2. ВПЛИВ ТЕМПЕРАТУРИ НА СОЛІ ФЕНІЛДІАЗОНІЮ
- •ДОСЛІД 3. УТВОРЕННЯ КИСЛИХ АЗОБАРВНИКІВ
- •ДОСЛІД 4. УТВОРЕННЯ ОСНОВНОГО АЗОБАРВНИКА
- •ДОСЛІД 5. ВПЛИВ РЕАКЦІЇ СЕРЕДОВИЩА НА ЗМІНИ КОЛЬОРУ ОСНОВНОГО АЗОБАРВНИКА
- •17. АМІДИ КИСЛОТ
- •ДОСЛІД 1. УТВОРЕННЯ СОЛЕЙ СЕЧОВИНИ З КИСЛОТАМИ
- •ДОСЛІД 2. ВЗАЄМОДІЯ СЕЧОВИНИ З НАТРІЙ ГІПОБРОМІТОМ (РЕАКЦІЯ А.П. БОРОДІНА)
- •ДОСЛІД 3. ГІДРОЛІЗ АМІДІВ КИСЛОТ
- •ДОСЛІД 4. УТВОРЕННЯ БІУРЕТУ
- •ДОСЛІД 5. РЕАКЦІЯ СЕЧОВИНИ З МЕРКУРІЙ(ІІ) НІТРАТОМ
- •ДОСЛІД 6. РЕАКЦІЯ СЕЧОВИНИ З НАТРІЙ НІТРАТОМ(ІІІ)
- •18. АМІНОКИСЛОТИ
- •18. АМІНОКИСЛОТИ
- •ДОСЛІД 2. РЕАКЦІЯ ГЛІЦИНУ З КУПРУМ(ІІ) ОКСИДОМ
- •ДОСЛІД 3. РЕАКЦІЯ ГЛІЦИНУ З FеCl3
- •ДОСЛІД 4. ДЕЗАМІНУВАННЯ АМІНОКИСЛОТ
- •ДОСЛІД 5. РЕАКЦІЯ АМІНОКИСЛОТ З НІНГІДРИНОМ
- •Контрольні запитання та завдання
- •19. БІЛКИ ТА ПЕПТИДИ
- •Функції білків
- •КОЛЬОРОВІ РЕАКЦІЇ БІЛКІВ
- •ДОСЛІД 1. БІУРЕТОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 2. КСАНТОПРОТЕЇНОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ СУЛЬФУРУ У БІЛКАХ. РЕАКЦІЯ БІЛКУ З ПЛЮМБУМ(ІІ) АЦЕТАТОМ
- •ДОСЛІД 4. ВИЗНАЧЕННЯ ТИРОЗИНУ У БІЛКАХ
- •ДОСЛІД 5. ДЕНАТУРАЦІЯ (КОАГУЛЯЦІЯ) БІЛКІВ ЗА НАГРІВАННЯ
- •ДОСЛІД 6. ДЕНАТУРАЦІЯ ТА ВИСОЛЮВАННЯ БІЛКІВ ПРИ ДІЇ РІЗНИХ РЕЧОВИН
- •ДОСЛІД 7. ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ БІЛКІВ
- •ДОСЛІД 8. ГОРІННЯ ЯК СПОСІБ РОЗПІЗНАВАННЯ БІЛКОВИХ МАТЕРІАЛІВ
- •Контрольні запитання та завдання
- •20. ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •Практичне значення гетероциклічних сполук
- •ДОСЛІД 1. ВІДНОВЛЕННЯ ІНДИГОКАРМІНУ ГЛЮКОЗОЮ
- •ДОСЛІД 2.ОДЕРЖАННЯ СЕРЕДНЬОЇ ТА КИСЛОЇ СОЛЕЙ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВИЯВЛЕННЯ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 5. ОДЕРЖАННЯ ФУРФУРОЛУ
- •ДОСЛІД 6. ОДЕРЖАННЯ КОФЕЇНУ З ЧАЮ
- •Контрольні запитання та завдання
- •Практичне значення алкалоїдів
- •ДОСЛІД 1. УТВОРЕННЯ НЕРОЗЧИННИХ СОЛЕЙ АЛКАЛОЇДІВ
- •ДОСЛІД 2. КОЛЬОРОВА РЕАКЦІЯ НА АЛКАЛОЇДИ З СУЛЬФАТНОЮ КИСЛОТОЮ
- •ДОСЛІД 3. РЕАКЦІЯ ХІНІНУ З БРОМНОЮ ВОДОЮ ТА АМОНІАКОМ. ТАЛЕЙОХІННА ПРОБА
- •Талейохін
- •Контрольні запитання та завдання
- •22. ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ
- •22.1. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ФЕНОЛОПЛАСТІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У КИСЛОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 2. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У ЛУЖНОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •22.2. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ПОЛІАМІДІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ КАРБАМІДУ З ФОРМАЛЬДЕГІДОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ “ЖИТТЄЗДАТНОСТІ” СМОЛИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •Контрольні запитання та завдання
- •22.3. ДЕСТРУКЦІЯ ПОЛІМЕРІВ
- •ДОСЛІД 2. ДЕПОЛІМЕРИЗАЦІЯ КАУЧУКУ (АБО ГУМИ)
- •ДОСЛІД 3. ДЕПОЛІМЕРИЗАЦІЯ ОРГАНІЧНОГО СКЛА
- •Контрольні запитання та завдання
- •22.4. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ РОЗЧИНІВ ПОЛІМЕРІВ
- •Розчинення та набрякання полімерів
- •Висолювання високомолекулярних сполук
- •ДОСЛІД 1. ДОСЛІДЖЕННЯ ШВИДКОСТІ НАБРЯКАННЯ
- •ДОСЛІД 2. ВИСОЛЮВАННЯ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК
- •Контрольні запитання та завдання
- •23. ОСНОВНІ ФІЗИКО-ХІМІЧНІ МЕТОДИ ДОСЛІДЖЕННЯ ОРГАНІЧНИХ І БІОХІМІЧНИХ СПОЛУК
- •23.1. ЗАГАЛЬНІ ПОЛОЖЕННЯ ОПТИЧНОЇ СПЕКТРОСКОПІЇ
- •23.2. ІНФРАЧЕРВОНА СПЕКТРОСКОПІЯ
- •ДОСЛІД 1. ВИВЧЕННЯ СПЕКТРІВ ПОГЛИНАННЯ РОЗЧИНІВ ФЕНОЛУ, АНІЛІНУ, ТИРОЗИНУ, РИБОФЛАВІНУ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ СПЕКТРУ ЗА ОКРЕМИМИ ДОВЖИНАМИ ХВИЛЬ.
- •ДОСЛІД 3. ВИЗНАЧЕННЯ НЕВІДОМОЇ КОНЦЕНТРАЦІЇ ВІДОМОЇ РЕЧОВИНИ ЗА ДОПОМОГОЮ КАЛІБРУВАЛЬНОГО ГРАФІКУ
- •23.4. Люмінесцентний аналіз
- •23.5. Флуоресцентний аналіз
- •23.6. Ядерний магнітний резонанс (ЯМР)
- •23.7. Протонний магнітний резонанс (ПМР)
- •23.8. Інші оптичні методи в кількісному аналізі
- •23.9. Емісійний спектральний аналіз
- •23.10. Атомно-абсорбційна спектроскопія
- •23.11. ЗАСТОСУВАННЯ ДЕЯКИХ МЕТОДІВ ХРОМАТОГРАФІЇ В АНАЛІЗІ ОРГАНІЧНИХ І БІОХІМІЧНИХ РЕЧОВИН
- •23.11.1. Адсорбційна хроматографія
- •23.11.2. Колонкова хроматографія
- •23.11.3. Сорбенти і розчинники
- •23.11.4.5. Тонкошарова і паперова хроматографія
- •ДОСЛІД 1. КІЛЬКІСНЕ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ ЗА ДОПОМОГОЮ ТОНКОШАРОВОЇ ХРОМАТОГРАФІЇ
- •23.11.5. Газова хроматографія
- •23.11.6. Газо-рідинна хроматографія (ГРХ)
- •23.2.8. Високоефективна рідинна хроматографія (ВЕРХ)
- •23.11.6. Афінна хроматографія
- •23.11.7. Іонообмінна хроматографія
- •23.11.8. Гель-хроматографія
- •23.11.9. Надкритична флюїдна хроматографія (НФХ)
- •23.12. Електрофорез
- •23.12. Комбіновані методи аналізу
- •ПРИГОТУВАННЯ НАЙВАЖЛИВІШИХ РЕАГЕНТІВ
- •СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ

10 |
10 |
10- |
|
|
Ядерні реакції під |
|
|
|
|
Ядер |
|
|
7 |
|
|||||||
|
10 |
|
дією γ-випромінювання |
|
|
|
|
10 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
2 |
|
3 |
|
|
|
|
|
4 |
|
|
5 |
|
6 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Рис. |
23.1.1. |
Принципова |
блок-схема |
|
спектрофотометру: |
||||||||||||||
1 – |
джерело |
випромінювання; |
2 |
– монохроматор; 3 – кюветне |
|||||||||||||||||
відділення; |
4 |
– приймач випромінювання; |
5 – |
підсилювач; 6 – |
|||||||||||||||||
реєстратор (відліковий чи записуючий пристрій) |
|
|
|
|
|
||||||||||||||||
|
|
В УФ-спектроскопії і в видимих спектрах для кількісної оцінки |
|||||||||||||||||||
поглинання випромінювання використовують пропускання Т: |
|||||||||||||||||||||
|
|
|
|
|
|
|
T = |
I |
|
|
|
(23.1.3) |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
I |
0 |
|
|
|
|
|
|
|
|
та оптичну густину А: |
A = lg |
I0 |
= -lgT |
|
(23.1.4) |
|
|||||||||||||||
|
|
|
|
||||||||||||||||||
I
23.2. ІНФРАЧЕРВОНА СПЕКТРОСКОПІЯ
Основні питання, які можуть бути вирішені при дослідженні органічних речовин за допомогою ІЧ-спектроскопії такі:
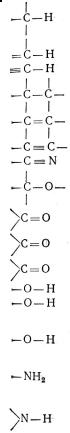
- дослідження будови сполук(наявність різних функціональних груп і більш складних фрагментів молекул);
-встановлення ідентичності сполук;
-контроль за ходом реакції;
-вивчення внутрішньомолекулярних чи міжмолекулярних взаємодій;
Як приклад, розглянемо в спрощеному вигляді проходження |
|
||||||||||
випромінювання |
|
в |
|
діапазоніn |
= 500 |
– 5000 см-1 |
через |
пари |
|
||
|
|
|
|
|
O |
|
|
|
|
|
|
формальдегіду |
H |
|
C |
. При |
зміні |
випромінювання |
від500 |
до |
|
||
|
|
||||||||||
5000 см-1 |
енергія |
|
H |
випромінювання |
відповідно |
зростає |
|||||
|
такого |
||||||||||
(зменшується довжина хвилі). Потік випромінювання, що проходить |
|
||||||||||
через пари формальдегіду, буде проходити без змін доти, поки його |
|
||||||||||
енергія не буде точно відповідати по величині енергії, яка здатна виз- |
|
||||||||||
вати зміну валентних кутів між атомами гідрогену в молекулі. Такого |
|
||||||||||
типу коливання атомів носять назвудеформаційних коливань і бува- |
|
||||||||||
ють двох |
видів: симетричні і |
антисиметричні. |
Це |
збудження |
|
||||||
відбувається в області енергії, що відповідає хвильовому числу 1500
248
см-1. В цих умовах відбувається резонанс, внаслідок якого енергія випромінювання витрачається на збудження коливань і інтенсивність потоку енергії при проходженні крізь пари формальдегіду різко падає.
При подальшому зменшенні довжини хвилі(збільшенні енергії), настає момент, коли вона точно відповідає енергії, що визиває зміну подвійного зв’язку С=О (1754 см-1). Такого типу коливання називаються валентними. В області високої енергії(близько 2000 см-1) починає змінюватись довжина зв’язку С—Н– виникають
валентні симетричні і валентні антисиметричні коливання.
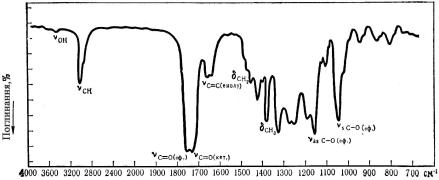
На рис. 23.2.1 приведені ІЧ-спектри ацетооцтового ефіру. Основні піки віднесені до коливань функціональних груп в молекулах.
Частоти, які проявляються в спектрах при наявності в сполуках певних хімічних груп, незалежно від того, до яких молекул ці групи належать, одержали назву характеристичних.
Деякі характеристичні частоти поглинання в інфрачервоній області приведені в табл. 23.2.1.
Рис. 23.2.1. ІЧ-спектр ацетооцтового ефіру
При дослідженні органічних речовин методом ІЧ-спектроскопії використовують таблиці частот коливань, зведених в довідники та атласи ІЧ-спектрів. На рис. 23.2.2, 23.2.3 наведено вигляд -ІЧ спектрометрів.
249

Рис. 23.2.2. Інфрачервоний аналізатор ІнфраЛЮМ
Рис. 23.2.3. Спектрофотометр МС 311 (IR спектрофотометр)
Таблиця 23.2.1 Деякі характеристичні частоти поглинання
в інфрачервоній області
Зв'язок |
Сполука |
Частота, см-1 |
Інтенсивність і |
|
|
|
характер смуги |
250
|
Алкани |
2850 |
– 2960 |
Сильна |
|
Алкені і арени |
3010 |
– 3100 |
Середня |
|
Алкіни |
3300 |
Сильна, різка |
|
|
Алкани |
600 |
– 1500 |
Слаба |
|
Алкени |
1620 |
– 1680 |
Змінна |
|
Алкіни |
2100 |
– 2260 |
» |
|
Нітрили |
2200 |
– 2300 |
» |
|
Спирти |
1000 |
– 1300 |
Сильна |
|
Альдегіди |
1720 |
– 1740 |
» |
|
Кетони |
1705 |
– 1725 |
» |
|
Кислоти |
1700 |
– 1750 |
» |
|
Спирти і феноли |
3590 |
– 3650 |
Змінна, різка |
|
Асоційовані за рахунок |
3200 |
– 3400 |
Сильна, широка |
|
водневих зв’язків (у |
|
|
|
|
спиртах і фенолах) |
|
|
|
|
Асоційовані за рахунок |
2500 |
– 3000 |
Змінна, широка |
|
водневих зв’язків (у ки- |
|
|
|
|
слотах) |
|
|
Середня |
|
Аміни первинні |
3300 |
– 3500 |
|
|
|
(подвійний пік) |
|
|
|
Аміни вторинні |
3300 |
– 3500 |
» |
|
(одинарний пік) |
|||
|
|
|
||
23.3. Ультрафіолетова спектроскопія і спектроскопія в видимій області.
УФ-спектроскопія і спектроскопія в видимій області дозволяє дослідити органічні речовини і вирішити такі питання:
-вивчити будову молекул і наявність в них певних угруповань, що мають кратні зв’язки (хромофори);
-аналітично визначити концентрації речовин на основі
закону Ламберта |
I = I0e-kd |
(23.3.1) |
і закону Бугера – Бера I = I0e-εcd |
(23.3.2) |
|
де I0 – інтенсивність падаючого випромінювання; I – інтенсивність випромінювання на виході;
251
d – товщина поглинаючого шару;
k – коефіцієнт поглинання, який залежить від довжини хвилі і
єіндивідуальною характеристикою речовини;
ε– коефіцієнт поглинання, характерний для речовини,
він залежить від довжини хвилі і не залежить від концентрації;
c – концентрація речовини в розчині.
Як правило, користуються логарифмічним записом законів:
|
A = lg |
|
I0 |
kd |
(23.3.3) |
||
|
|
|
|||||
|
|
I0 |
I |
|
|||
і |
A = lg |
ecd . |
(23.3.4) |
||||
|
|||||||
|
|
I |
|
||||
Слід відзначити, що |
закону Ламберта |
підпорядковані всі |
|||||
рівноваги, тоді як закон Бугера– Бера має певні обмеження, і відхилення від цього закону часто пов’язані з поведінкою речовини в розчині.
Спектри поглинання в ультрафіолетовій і видимій області визначаються змінами в енергії валентних електронів при електронних переходах. Ці спектри називають електронними і вони проявляються в інтервалі 200 – 1000 нм. Атоми в органічних молекулах можуть бути зв’язані простими і кратними(подвійними і потрійними) зв’язками. Електрони цих зв’язків(s- і p-зв’язки) мають різну енергію, і тому збуджуються випромінюванням з різною довжиною(енергією) хвилі. Найбільшої енергії потребує збудження простого С—С зв’язку.
Групи атомів, що обумовлюють поглинання в області від200 до 1000 нм називають хромофорними. До них відносяться групи, що
мають не менше одного кратного зв’язку: C=C; CºC; С=О; C=N;
S=O і ін. |
|
|
|
|
В |
табл. 23.3.1 |
приведені |
параметри |
поглинання основних |
типів простих органічних сполук в області200 – 1000 нм. Слід заува- |
||||
жити, що спряжене поглинання хромофорних груп завжди призводить |
||||
до зміни |
спектру |
поглинання. В |
зв’язку |
з цим сформульовано |
емпіричні правила залежності електронного спектру поглинання від взаємного розташування хромофорних груп в молекулі.
Таблиця 23.3.1 Параметри електронних спектрів простих органічних сполук
Хромофор |
Сполука |
p®p*-перехід |
n®p*-перехід |
|||
lмакс |
εмакс |
lмакс |
εмакс |
|||
|
|
|||||
252
|
Ацетальдегід |
— |
— |
293 |
12 |
|
Ацетон |
— |
— |
271 |
16 |
|
Оцтова кислота |
— |
— |
204 |
60 |
|
|
226 |
1100 |
— |
— |
|
Діазометан |
— |
— |
340 |
13 |
|
Нітрозобутан |
— |
— |
300 |
100 |
|
Етилнітрат |
— |
— |
270 |
12 |
|
Нітрометан |
— |
— |
271 |
19 |
|
Октилнітрит |
230 |
2200 |
370 |
56 |
|
Бутадієн |
217 |
20900 |
— |
— |
|
Мезитил оксид |
230 |
12600 |
327 |
40 |
|
|
|
|
|
|
Спектри |
|
поглинання |
ароматичних |
|
сполук |
пом |
||
відрізняються від спектрів аліфатичних сполук. Так, бензол поглинає |
|
|||||||
в двох областях спектру: при 196 нм і в області230 – 270 нм. При |
|
|||||||
введенні |
в |
бензольне |
кільце |
замісників |
спектр |
змінюється |
|
|
залежності |
від |
їх |
природи. Такі замісники, як OH, OCH3, NH3, NR3 |
|
||||
збільшують інтенсивність довгохвильової смуги майже в10 разів, а |
|
|||||||
сама смуга зсувається в бік довгих (хвильрис. 23.3.1). Для |
|
|||||||
гетероциклічних сполук інтенсивне вибіркове поглинання в видимій і |
|
|||||||
ультрафіолетовій області спектру проявляється для тих сполук, які |
|
|||||||
містять принаймні одне ненасичене хромофорне групування(тіофен, |
|
|||||||
пірол, піридин і ін.). |
|
|
|
|
|
|
||
На рис. 23.3.2 відображено залежність молярного коефіцієнту |
|
|||||||
поглинання |
від |
частоти |
для |
деяких біологічних |
речовин. Слід |
|
||
відзначити, що найбільш значні по висоті піки поглинання (ε > 2000) в основному обумовлені іонами металів, подвійними зв’язками, системами спряжених зв’язків в молекулах.
253
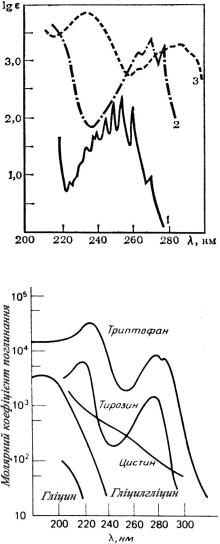
Рис. 23.3.1. УФ-спектри бензолу (1), фенолу (2), аніліну (3)
Рис. 23.3.2. УФ-спектри деяких амінокислот і дипептиду
Для більшості нуклеїнових кислот характеристичне поглинання спостерігається при 260 нм, а для білків, що містять ароматичні амінокислоти – при 280 нм. Фактично, всі застосування ультрафіолетової спектроскопії для вивчення макромолекул основані
254

на невеликій різниці в поглинанні, обумовленій зміною або форми молекул, або зовнішнього середовища (заміна розчинника).
СПЕКТРАЛЬНИЙ АНАЛІЗ ОРГАНІЧНОЇ РЕЧОВИНИ УЛЬТРАФІОЛЕТОВІЙ ТА ВИДИМІЙ ОБЛАСТІ СПЕКТРУ
В аналітичних дослідженнях і учбових лабораторіях широко застосовуються фотоколориметри (фотометри). Розроблені різні конструкції фотоелектроколориметрів, призначених для роботи в ближній УФ і видимій області спектру. В фотоелектроколориметрах (фотоелектричних фотометрах) (рис. 23.3.3) вимірюють інтенсивність немонохроматичного світлового потоку, що проходить через досліджуваний розчин, за допомогою фотоелементів. Світловий потік від джерела випромінювання (зазвичай лампи) проходить крізь світлофільтр, що пропускає випромінювання лише в певному інтервалі довжини хвиль,
через кювету з розчином, і |
попадає |
на фотоелемент, який |
|||
перетворює |
світлову |
енергію |
в |
фотострум, що |
реєструється |
відповідним приладом. Чим більше світлопоглинання досліджуваного розчину (чим більша його оптична густина), тим менша частина енергії світлового потоку попадає на фотоелемент.
Рис. 23.3.3. Фотометр фотоелектричний КФК-3-01-ЗОМЗ
Спектрофотометрія – один з найбільш досконалих серед методів абсорбційного молекулярного аналізу, що знайшов широке застосування. Цей метод оснований на використанні спеціальних приладів – спектрофотометрів, в яких світлові потоки регіструються в досить широкому інтервалі довжини хвиль: від » 185 нм до » 1100 нм (УФ, видимій і ближній до ІЧ області спектру), і забезпечує високий ступінь монохроматичності світла(0,2 – 5 нм), що проходить через досліджуване середовище (рис. 23.3.4). В більшості спектрофотометрів монохроматизація світлового потоку здійснюється за рахунок використання розкладаючих світло на спектр елементів
(диспергаторів). Такими елементами є призми або дифракційні
255
