
- •НАВЧАЛЬНИЙ ПОСІБНИК
- •1. ТЕХНІКА БЕЗПЕКИ В ХІМІЧНІЙ ЛАБОРАТОРІЇ
- •1.1. ЗАГАЛЬНІ ПРАВИЛА РОБОТИ В ХІМІЧНІЙ ЛАБОТАТОРІЇ
- •1.2. НАДАННЯ ПЕРШОЇ ДОПОМОГИ
- •2. УСТАТКУВАННЯ І ТЕХНІКА ВИКОНАННЯ ЛАБОРАТОРНИХ РОБІТ
- •2.1. ХІМІЧНИЙ ЛАБОРАТОРНИЙ ПОСУД
- •2.2. НЕСКЛЯНИЙ ПОСУД
- •2.3. ХІМІЧНІ РЕАКТИВИ ТА ЇХ ЗБЕРІГАННЯ
- •2.3.1. Зберігання хімічних реактивів
- •2.3.2. Користування реактивами
- •2.3.3. Класифікація реактивів
- •2.4. МЕТОДИ ОЧИСТКИ ТА ВИДІЛЕННЯ ОРГАНІЧНИХ РЕЧОВИН
- •2.4.1. Очищення методом кристалізації
- •ДОСЛІД 1. ПЕРЕКРИСТАЛІЗАЦІЯ БЕНЗОЙНОЇ КИСЛОТИ
- •ДОСЛІД 2. ОЧИЩЕННЯ ЩАВЛЕВОЇ КИСЛОТИ
- •2.4.2. Очищення методом сублімації
- •ДОСЛІД 1. СУБЛІМАЦІЯ НАФТАЛІНУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.3. Перегонка або дистиляція
- •ДОСЛІД 1. ПРОСТА ПЕРЕГОНКА ЕТАНОЛУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.4. ВИЗНАЧЕННЯ ОСНОВНИХ ФІЗИЧНИХ КОНСТАНТ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ ПЛАВЛЕННЯ
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ КИПІННЯ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ПОКАЗНИКА ЗАЛОМЛЕННЯ РІДИНИ
- •Контрольні запитання та завдання
- •2.4.5. ЗНЕВОДНЕННЯ ОРГАНІЧНИХ РЕАКТИВІВ
- •2.4.6. Фільтрування
- •Фільтрування через паперові фільтри
- •Правила фільтрування
- •Промивання осадів
- •Правила роботи з центрифугою.
- •ДОСЛІД 1. ЗРІВНОВАЖЕННЯ ЦЕНТРИФУЖНИХ ПРОБІРОК
- •ДОСЛІД 2. ЦЕНТРИФУГУВАННЯ РОЗЧИНІВ
- •3. РОЗЧИНИ ХІМІЧНИХ РЕАКТИВІВ ТА ЇХ ПРИГОТУВАННЯ
- •3.1. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
- •3.2. РОЗРАХУНКИ ДЛЯ ПРИГОТУВАННЯ РОЗЧИНІВ ПЕВНОЇ КОНЦЕНТРАЦІЇ
- •3.3. ПРИГОТУВАННЯ РОЗЧИНІВ ІЗ ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ РЕЧОВИНИ
- •ДОСЛІД 1. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ)
- •ДОСЛІД 2. ПРИГОТУВАННЯ РОЗЧИНУ МЕНШОЇ КОНЦЕНТРАЦІЇ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ) ІЗ РОЗЧИНУ З БІЛЬШОЮ КОНЦЕНТРАЦІЄЮ
- •ДОСЛІД 5. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •ДОСЛІД 6. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ ЕКВІВАЛЕНТУ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •Приготувати 1 л 0,1 н розчину H2SO4.
- •Розчини з молярною концентрацією еквіваленту розчиненої речовини готують аналогічно молярним, тільки беруть наважку речовини, що відповідає не молярній масі речовини, а молярній масі еквіваленту речовини.
- •3.4. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
- •Контрольні запитання та завдання
- •4. ЯКІСНИЙ ЕЛЕМЕНТНИЙ АНАЛІЗ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИДОЗМІНЕННЯ ОРГАНІЧНОЇ РЕЧОВИНИ ЗА ПРОЖАРЮВАННЯ
- •ДОСЛІД 2. ВІДКРИТТЯ КАРБОНУ ТА ГІДРОГЕНУ
- •ДОСЛІД 3. ВІДКРИТТЯ НІТРОГЕНУ
- •ДОСЛІД 4. ВІДКРИТТЯ СУЛЬФУРУ
- •ДОСЛІД 5. ВІДКРИТТЯ ГАЛОГЕНІВ
- •Контрольні запитання та завдання
- •5. ВУГЛЕВОДНІ
- •5.1. НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ МЕТАНУ З НАТРІЙ АЦЕТАТУ
- •ДОСЛІД 2. ОДЕРЖАННЯ МЕТАНУ СУХОЮ ПЕРЕГОНКОЮ ДЕРЕВИНИ
- •ДОСЛІД 3. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ МЕТАНУ
- •ДОСЛІД 4. БРОМУВАННЯ ОКТАНУ
- •Контрольні запитання та завдання
- •5.2. НЕНАСИЧЕНІ ЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКЕНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ ЕТЕНУ
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО ЕТЕНУ
- •ДОСЛІД 3. М’ЯКЕ ОКИСНЕННЯ ЕТИЛЕНУ (РЕАКЦІЯ ВАГНЕРА)
- •ДОСЛІД 4. ГОРІННЯ ЕТЕНУ
- •ДОСЛІД 5. ВЗАЄМОДІЯ КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТИ З ВУГЛЕВОДНЯМИ
- •5.3. НЕНАСИЧЕНІ АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКІНИ)
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО АЦЕТИЛЕНУ
- •ДОСЛІД 3. ОКИСНЕННЯ АЦЕТИЛЕНУ
- •ДОСЛІД 4. УТВОРЕННЯ АЦЕТИЛЕНІДІВ
- •Утворення аргентум(І) ацетиленіду
- •Утворення купрум(І) ацетиленіду
- •6. АРОМАТИЧНІ ВУГЛЕВОДНІ (АРЕНИ)
- •ДОСЛІД 1. БРОМУВАННЯ БЕНЗЕНУ ТА ТОЛУЕНУ
- •ДОСЛІД 2. НІТРУВАННЯ БЕНЗЕНУ
- •ДОСЛІД 3. СУЛЬФУВАННЯ ТОЛУЕНУ
- •ДОСЛІД 4. ОКИСНЕННЯ АРОМАТИЧНИХ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. НІТРУВАННЯ НАФТАЛІНУ
- •Контрольні запитання та завдання
- •7. ГАЛОГЕНПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 1. ГІДРОЛІЗ ХЛОРОФОРМУ
- •ДОСЛІД 2. ОДЕРЖАННЯ ЙОДОФОРМУ З ЕТАНОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ХЛОРЕТАНУ
- •ДОСЛІД 4. КОЛЬОРОВА РЕАКЦІЯ НА ГАЛАГЕНОПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. ВИЗНАЧЕННЯ ЧИСТОТИ ХЛОРОФОРМУ
- •ДОСЛІД 6. ОДЕРЖАННЯ БРОМЕТАНУ
- •8. СПИРТИ
- •8. СПИРТИ
- •ДОСЛІД 1. РОЗЧИННІСТЬ СПИРТІВ У ВОДІ
- •ДОСЛІД 2. ВИЯВЛЕННЯ НАЯВНОСТІ ВОДИ У ЕТАНОЛІ ТА ЙОГО ЗНЕВОДНЕННЯ
- •ДОСЛІД 3. РЕАКЦІЯ СПИРТІВ НА ЛАКМУС
- •ДОСЛІД 4. РЕАКЦІЯ З СІРКОВУГЛЕЦЕМ ТА ЛУГОМ НА ПЕРВИННІ ТА ВТОРИННІ СПИРТИ (КСАНТОГЕНОВА ПРОБА)
- •ДОСЛІД 5. РЕАКЦІЇ НА ФУНКЦІОНАЛЬНУ (ГІДРОКСИЛЬНУ) ГРУПУ СПИРТІВ. ЯКІСНА РЕАКЦІЯ НА ПЕРВИННІ, ВТОРИННІ ТА ТРЕТИННІ СПИРТИ. РЕАКЦІЯ З РОЗЧИНОМ ЦИНК ХЛОРИДУ
- •ДОСЛІД 6. РЕАКЦІЯ З МЕТАЛІЧНИМ НАТРІЄМ. ГІДРОЛІЗ АЛКОГОЛЯТУ НАТРІЮ
- •ДОСЛІД 7. ОТРИМАННЯ ДІЕТИЛОВОГО ЕТЕРУ (ЕФІРУ)
- •ДОСЛІД 8. ОКИСНЕННЯ ЕТАНОЛУ
- •ДОСЛІД 9. ОКИСНЕННЯ СПИРТІВ КАЛІЙ ДИХРОМАТОМ
- •ДОСЛІД 10. ЯКІСНА РЕАКЦІЯ НА ГЛІКОЛІ ТА БАГАТОАТОМНІ СПИРТИ З КУПРУМ(II) ГІДРОКСИДОМ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •9. ФЕНОЛИ
- •Практичне значення фенолів
- •ДОСЛІД 1. КОЛЬОРОВІ (ЯКІСНІ) РЕКЦІЇ ФЕНОЛІВ І НАФТОЛІВ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 2. РОЗЧИННІСТЬ ФЕНОЛУ У ВОДІ
- •ДОСЛІД 3. КИСЛОТНІ ВЛАСТИВОСТІ ФЕНОЛУ. ОДЕРЖАННЯ НАТРІЙ ФЕНОЛЯТУ
- •ДОСЛІД 4. ДІЯ БРОМНОЇ ВОДИ НА ФЕНОЛ
- •ДОСЛІД 5. НІТРУВАННЯ ФЕНОЛУ
- •ДОСЛІД 6. КОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ (УТВОРЕННЯ ФЕНОЛОФОРМАЛЬДЕГІДНОЇ СМОЛИ)
- •10. АЛЬДЕГІДИ ТА КЕТОНИ
- •Практичне значення альдегідів та кетонів
- •ДОСЛІД 1. РЕАКЦІЯ З ФУКСИНСУЛЬФІТНОЮ КИСЛОТОЮ (РЕАКЦІЯ ШИФФА, ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 2. РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА” (ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 4. РЕАКЦІЯ З РЕАКТИВОМ ФЕЛІНГА (ЯКІСНА РЕАКЦІЯ НА АЛЬДЕГІДИ)
- •ДОСЛІД 5. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ АМОНІАЧНИМ РОЗЧИНОМ АРГЕНТУМ(І) ГІДРОКСИДУ
- •ДОСЛІД 6. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ РОЗЧИНОМ КАЛІЙ МАНГАНАТУ(VІІ)
- •ДОСЛІД 7. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ КИСНЕМ ПОВІТРЯ
- •ДОСЛІД 8. ПОЛІМЕРИЗАЦІЯ ФОРМАЛЬДЕГІДУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ТА ГІДРОЛІЗ ГЕКСАМЕТИЛЕНТЕТРАМІНУ (УРОТРОПІНУ)
- •ДОСЛІД 10. ОДЕРЖАННЯ МУРАШИНОГО ТА ОЦТОВОГО АЛЬДЕГІДІВ ОКИСНЕННЯМ СПИРТІВ
- •ДОСЛІД 11. РЕАКЦІЯ ДИСМУТАЦІЇ (РЕАКЦІЯ КАННІЦЦАРО)
- •ДОСЛІД 12. ОДЕРЖАННЯ АЦЕТОНУ ІЗ КАЛЬЦІЙ АЦЕТАТУ
- •ДОСЛІД 13. УТВОРЕННЯ ЙОДОФОРМУ ІЗ АЦЕТОНУ. ЯКІСНІ РЕАКЦІЇ НА АЦЕТОН
- •Контрольні запитання та завдання
- •11. КАРБОНОВІ КИСЛОТИ
- •11.1. ОДНООСНОВНІ (МОНОКАРБОНОВІ) КИСЛОТИ
- •ДОСЛІД 1. ДИСОЦІАЦІЯ ОЦТОВОЇ КИСЛОТИ
- •ДОСЛІД 2. ДОБУВАННЯ ФЕРУМ(ІІІ) АЦЕТАТУ ТА ЙОГО ГІДРОЛІЗ
- •ДОСЛІД 3. ВИТІСНЕННЯ СЛАБКИХ КИСЛОТ БІЛЬШ СИЛЬНИМИ З ЇХ СОЛЕЙ (РЕАКЦІЯ З НАТРІЙ КАРБОНАТОМ)
- •ДОСЛІД 4. ОДЕРЖАННЯ МУРАШИНОЇ (МЕТАНОВОЇ) КИСЛОТИ ІЗ ХЛОРОФОРМУ
- •ДОСЛІД 5. ОКИСНЕННЯ НАСИЧЕНИХ КАРБОНОВИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ НЕНАСИЧЕНОЇ (ОЛЕЇНОВОЇ) КИСЛОТИ
- •ДОСЛІД 7. БРОМУВАННЯ ОЛЕЇНОВОЇ КИСЛОТИ
- •ДОСЛІД 9. ІЗОМЕРИЗАЦІЯ ОЛЕЇНОВОЇ КИСЛОТИ В ЕЛАЇДИНОВУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ ІЗ МИЛА
- •Контрольні запитання та завдання
- •11.2. ДВОХОСНОВНІ (ДИКАРБОНОВІ) КИСЛОТИ
- •Фізичні властивості дикарбонових кислот
- •Практичне значення дикарбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ НАТРІЙ ОКСАЛАТУ
- •ДОСЛІД 2. РОЗКЛАДАННЯ ОКСАЛАТНОЇ (ЕТАНДІОВОЇ) КИСЛОТИ ПРИ НАГРІВАННІ (РЕАКЦІЯ ДЕКАРБОКСИЛУВАННЯ)
- •ДОСЛІД 3. ОКИСНЕННЯ ОКСАЛАТНОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ ОКСАЛАТНОЇ КИСЛОТИ З ЛУГОМ
- •ДОСЛІД 5. ОДЕРЖАННЯ АНГІДРИДУ БУРШТИНОВОЇ КИСЛОТИ
- •Контрольні запитання та завдання
- •11.3. ГІДРОКСИКИСЛОТИ ТА ОКСОКИСЛОТИ
- •ДОСЛІД 1. ВЗАЄМОДІЯ ГІДРОКСИКИСЛОТ З ФЕРУМ(ІІІ) ХЛОРИДОМ (ЯКІСНА РЕАКЦІЯ НА ГІДРОКСИКИСЛОТИ)
- •ДОСЛІД 2. ОКИСНЕННЯ МОЛОЧНОЇ ТА ВИННОЇ КИСЛОТ
- •ДОСЛІД 3. ОДЕРЖАННЯ КИСЛОЇ ТА СЕРЕДНЬОЇ КАЛІЄВИХ СОЛЕЙ ВИННОЇ КИСЛОТИ
- •ДОСЛІД 4. ОДЕРЖАННЯ СЕГНЕТОВОЇ СОЛІ
- •ДОСЛІД 5. ВЗАЄМОДІЯ СЕГНЕТОВОЇ СОЛІ З КУПРУМ(ІІ) ГІДРОКСИДОМ (ОДЕРЖАННЯ РЕАКТИВУ ФЕЛІНГА)
- •ДОСЛІД 6. РОЗКЛАДАННЯ ЛИМОННОЇ (ЦИТРАТНОЇ КИСЛОТИ) СУЛЬФАТНОЮ КИСЛОТОЮ
- •Контрольні запитання та завдання
- •11.4. АРОМАТИЧНІ КИСЛОТИ. ФЕНОЛОКИСЛОТИ
- •Практичне значення ароматичних карбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ БЕНЗОЙНОЇ КИСЛОТИ З ТОЛУЕНУ
- •ДОСЛІД 2. ОЧИЩЕННЯ БЕНЗОЙНОЇ КИСЛОТИ СУБЛІМАЦІЄЮ
- •ДОСЛІД 3. РОЗКЛАДАННЯ САЛІЦИЛОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ БЕНЗОЙНОЇ ТА САЛІЦИЛОВОЇ КИСЛОТ ІЗ ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 5. КОЛЬОРОВА РЕАКЦІЯ ФЕНІЛСАЛІЦИЛАТУ (САЛОЛУ) З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 6. ДІЯ БРОМНОЇ ВОДИ НА САЛІЦИЛОВУ ТА БЕНЗОЙНУ КИСЛОТИ
- •ДОСЛІД 7. ОКИСНЕННЯ КОРИЧНОЇ КИСЛОТИ
- •ДОСЛІД 8. КОЛЬОРОВІ РЕАКЦІЇ ГАЛОВОЇ КИСЛОТИ І ТАНІНУ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 9. ОДЕРЖАННЯ ФЕНОЛФТАЛЕЇНУ
- •Контрольні запитання та завдання
- •12. ЕСТЕРИ
- •Практичне значення естерів
- •ДОСЛІД 1. ДОБУВАННЯ ЕТИЛЕТАНОАТУ (ЕТИЛАЦЕТАТУ)
- •ДОСЛІД 3. ДОБУВАННЯ ІЗОАМІЛМЕТИЛБУТАНОАТУ («ЯБЛУЧНОЇ ЕСЕНЦІЇ»)
- •ДОСЛІД 4. ДОБУВАННЯ ЕТИЛБЕНЗОАТУ
- •ДОСЛІД 6. ГІДРОЛІЗ АЦЕТИЛСАЛІЦИЛОВОЇ КИСЛОТИ (АСПІРИНУ)
- •Контрольні запитання та завдання
- •13.1. Прості ліпіди
- •Практичне значення жирів
- •ДОСЛІД 1. ОМИЛЕННЯ ЖИРІВ ЛУГОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ ГЛІЦЕРОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ З МИЛА
- •ДОСЛІД 4. УТВОРЕННЯ НЕРОЗЧИННОГО У ВОДІ МИЛА
- •ДОСЛІД 5. ВИЯВЛЕННЯ В ЖИРАХ ЗАЛИШКІВ НЕНАСИЧЕНИХ ЖИРНИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ РОСЛИННИХ ОЛІЙ
- •ДОСЛІД 7. ЕМУЛЬГУВАННЯ ЖИРІВ
- •ДОСЛІД 8. ВИЗНАЧЕННЯ ЙОДНОГО ЧИСЛА
- •ДОСЛІД 9. ВИЗНАЧЕННЯ КИСЛОТНОГО ЧИСЛА
- •Контрольні запитання та завдання
- •13.2. Складні ліпіди
- •13.3. Ізопреноїди
- •ДОСЛІД 1. ПЕРЕГОНКА ЖИВИЦІ
- •ДОСЛІД 2. ФРАКЦІОНУВАННЯ СКИПИДАРУ
- •ДОСЛІД 3. ДІЯ БРОМНОЇ ВОДИ НА СКИПИДАР
- •ДОСЛІД 4. ОКИСНЕННЯ СКИПИДАРУ КАЛІЙ МАНГАНАТОМ(VII)
- •ДОСЛІД 5. ОДЕРЖАННЯ ТЕРПІНЕОЛУ З ТЕРПІНГІДРАТУ
- •14. ВУГЛЕВОДИ
- •14.1. Моносахариди
- •Практичне значення моносахаридів
- •ДОСЛІД 1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ГЛЮКОЗІ
- •ДОСЛІД 3. ОКИСНЕННЯ АЛЬДОЗ АМОНІАЧНИМ РОЗЧИНОМ АРҐЕНТУМ(І) ГІДРОКСИДУ (РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА”)
- •ДОСЛІД 4. ВЗАЄМОДІЯ ГЛЮКОЗИ З РЕАКТИВОМ ФЕЛІНГА
- •ДОСЛІД 5. РЕАКЦІЯ СЕЛІВАНОВА НА ФРУКТОЗУ
- •ДОСЛІД 6. ВИЗНАЧЕННЯ АСКОРБІНОВОЇ КИСЛОТИ (ВІТАМІНУ С). ЯКІСНА РЕАКЦІЯ НА ВІТАМІН С
- •Контрольні запитання та завдання
- •14.2. Дисахариди
- •ДОСЛІД1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ДИСАХАРИДАХ
- •ДОСЛІД 2. ДІЯ РЕАКТИВУ ФЕЛІНГА НА ДИСАХАРИДИ
- •ДОСЛІД 3. ГІДРОЛІЗ (ІНВЕРСІЯ) САХАРОЗИ
- •ДОСЛІД 4. ЯКІСНА РЕАКЦІЯ НА САХАРОЗУ
- •Контрольні запитання та завдання
- •14.3. Полісахариди
- •Практичне значення полісахаридів
- •ДОСЛІД 1. КОЛЬОРОВА РЕАКЦІЯ НА КРОХМАЛЬ
- •ДОСЛІД 2. РЕАГУВАННЯ КРОХМАЛЮ НА РЕАКТИВ ФЕЛІНГА
- •ДОСЛІД 3. КИСЛОТНИЙ ГІДРОЛІЗ КРОХМАЛЮ
- •ДОСЛІД 4. КИСЛОТНИЙ ГІДРОЛІЗ КЛІТКОВИНИ (ЦЕЛЮЛОЗИ)
- •ДОСЛІД 5. ОДЕРЖАННЯ ШТУЧНОГО ПЕРГАМЕНТУ
- •ДОСЛІД 6. ХАРАКТЕРНІ РЕАКЦІЇ НА ЛІГНІН
- •Контрольні запитання та завдання
- •Практичне значення амінів
- •ДОСЛІД 1. ОТРИМАННЯ МЕТИЛАМІНУ З АЦЕТАМІДУ
- •ДОСЛІД 2. РЕАКЦІЯ ВОДНОГО РОЗЧИНУ МЕТИЛАМІНУ НА ІНДИКАТОРИ
- •ДОСЛІД 3. РЕАКЦІЯ ГАЗУВАТОГО МЕТИЛАМІНУ З КОНЦЕНТРОВАНОЮ СОЛЯНОЮ КИСЛОТОЮ
- •ДОСЛІД 4. РЕАКЦІЯ МЕТИЛАМІНУ З НІТРАТНОЮ(ІІІ) КИСЛОТОЮ
- •ДОСЛІД 6. УТВОРЕННЯ СОЛЕЙ АНІЛІНУ
- •ДОСЛІД 7. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ ХЛОРНОГО ВАПНА
- •ДОСЛІД 8. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ КАЛІЙ ДИХРОМАТУ
- •ДОСЛІД 9. ДІЯ БРОМНОЇ ВОДИ НА АНІЛІН
- •ДОСЛІД 10. КОНДЕНСАЦІЯ АНІЛІНУ З ФОРМАЛЬДЕГІДОМ
- •Контрольні запитання та завдання
- •16. ДІАЗОСПОЛУКИ ТА АЗОБАРВНИКИ
- •ДОСЛІД 1. ДІАЗОТУВАННЯ АНІЛІНУ
- •ДОСЛІД 2. ВПЛИВ ТЕМПЕРАТУРИ НА СОЛІ ФЕНІЛДІАЗОНІЮ
- •ДОСЛІД 3. УТВОРЕННЯ КИСЛИХ АЗОБАРВНИКІВ
- •ДОСЛІД 4. УТВОРЕННЯ ОСНОВНОГО АЗОБАРВНИКА
- •ДОСЛІД 5. ВПЛИВ РЕАКЦІЇ СЕРЕДОВИЩА НА ЗМІНИ КОЛЬОРУ ОСНОВНОГО АЗОБАРВНИКА
- •17. АМІДИ КИСЛОТ
- •ДОСЛІД 1. УТВОРЕННЯ СОЛЕЙ СЕЧОВИНИ З КИСЛОТАМИ
- •ДОСЛІД 2. ВЗАЄМОДІЯ СЕЧОВИНИ З НАТРІЙ ГІПОБРОМІТОМ (РЕАКЦІЯ А.П. БОРОДІНА)
- •ДОСЛІД 3. ГІДРОЛІЗ АМІДІВ КИСЛОТ
- •ДОСЛІД 4. УТВОРЕННЯ БІУРЕТУ
- •ДОСЛІД 5. РЕАКЦІЯ СЕЧОВИНИ З МЕРКУРІЙ(ІІ) НІТРАТОМ
- •ДОСЛІД 6. РЕАКЦІЯ СЕЧОВИНИ З НАТРІЙ НІТРАТОМ(ІІІ)
- •18. АМІНОКИСЛОТИ
- •18. АМІНОКИСЛОТИ
- •ДОСЛІД 2. РЕАКЦІЯ ГЛІЦИНУ З КУПРУМ(ІІ) ОКСИДОМ
- •ДОСЛІД 3. РЕАКЦІЯ ГЛІЦИНУ З FеCl3
- •ДОСЛІД 4. ДЕЗАМІНУВАННЯ АМІНОКИСЛОТ
- •ДОСЛІД 5. РЕАКЦІЯ АМІНОКИСЛОТ З НІНГІДРИНОМ
- •Контрольні запитання та завдання
- •19. БІЛКИ ТА ПЕПТИДИ
- •Функції білків
- •КОЛЬОРОВІ РЕАКЦІЇ БІЛКІВ
- •ДОСЛІД 1. БІУРЕТОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 2. КСАНТОПРОТЕЇНОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ СУЛЬФУРУ У БІЛКАХ. РЕАКЦІЯ БІЛКУ З ПЛЮМБУМ(ІІ) АЦЕТАТОМ
- •ДОСЛІД 4. ВИЗНАЧЕННЯ ТИРОЗИНУ У БІЛКАХ
- •ДОСЛІД 5. ДЕНАТУРАЦІЯ (КОАГУЛЯЦІЯ) БІЛКІВ ЗА НАГРІВАННЯ
- •ДОСЛІД 6. ДЕНАТУРАЦІЯ ТА ВИСОЛЮВАННЯ БІЛКІВ ПРИ ДІЇ РІЗНИХ РЕЧОВИН
- •ДОСЛІД 7. ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ БІЛКІВ
- •ДОСЛІД 8. ГОРІННЯ ЯК СПОСІБ РОЗПІЗНАВАННЯ БІЛКОВИХ МАТЕРІАЛІВ
- •Контрольні запитання та завдання
- •20. ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •Практичне значення гетероциклічних сполук
- •ДОСЛІД 1. ВІДНОВЛЕННЯ ІНДИГОКАРМІНУ ГЛЮКОЗОЮ
- •ДОСЛІД 2.ОДЕРЖАННЯ СЕРЕДНЬОЇ ТА КИСЛОЇ СОЛЕЙ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВИЯВЛЕННЯ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 5. ОДЕРЖАННЯ ФУРФУРОЛУ
- •ДОСЛІД 6. ОДЕРЖАННЯ КОФЕЇНУ З ЧАЮ
- •Контрольні запитання та завдання
- •Практичне значення алкалоїдів
- •ДОСЛІД 1. УТВОРЕННЯ НЕРОЗЧИННИХ СОЛЕЙ АЛКАЛОЇДІВ
- •ДОСЛІД 2. КОЛЬОРОВА РЕАКЦІЯ НА АЛКАЛОЇДИ З СУЛЬФАТНОЮ КИСЛОТОЮ
- •ДОСЛІД 3. РЕАКЦІЯ ХІНІНУ З БРОМНОЮ ВОДОЮ ТА АМОНІАКОМ. ТАЛЕЙОХІННА ПРОБА
- •Талейохін
- •Контрольні запитання та завдання
- •22. ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ
- •22.1. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ФЕНОЛОПЛАСТІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У КИСЛОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 2. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У ЛУЖНОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •22.2. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ПОЛІАМІДІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ КАРБАМІДУ З ФОРМАЛЬДЕГІДОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ “ЖИТТЄЗДАТНОСТІ” СМОЛИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •Контрольні запитання та завдання
- •22.3. ДЕСТРУКЦІЯ ПОЛІМЕРІВ
- •ДОСЛІД 2. ДЕПОЛІМЕРИЗАЦІЯ КАУЧУКУ (АБО ГУМИ)
- •ДОСЛІД 3. ДЕПОЛІМЕРИЗАЦІЯ ОРГАНІЧНОГО СКЛА
- •Контрольні запитання та завдання
- •22.4. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ РОЗЧИНІВ ПОЛІМЕРІВ
- •Розчинення та набрякання полімерів
- •Висолювання високомолекулярних сполук
- •ДОСЛІД 1. ДОСЛІДЖЕННЯ ШВИДКОСТІ НАБРЯКАННЯ
- •ДОСЛІД 2. ВИСОЛЮВАННЯ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК
- •Контрольні запитання та завдання
- •23. ОСНОВНІ ФІЗИКО-ХІМІЧНІ МЕТОДИ ДОСЛІДЖЕННЯ ОРГАНІЧНИХ І БІОХІМІЧНИХ СПОЛУК
- •23.1. ЗАГАЛЬНІ ПОЛОЖЕННЯ ОПТИЧНОЇ СПЕКТРОСКОПІЇ
- •23.2. ІНФРАЧЕРВОНА СПЕКТРОСКОПІЯ
- •ДОСЛІД 1. ВИВЧЕННЯ СПЕКТРІВ ПОГЛИНАННЯ РОЗЧИНІВ ФЕНОЛУ, АНІЛІНУ, ТИРОЗИНУ, РИБОФЛАВІНУ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ СПЕКТРУ ЗА ОКРЕМИМИ ДОВЖИНАМИ ХВИЛЬ.
- •ДОСЛІД 3. ВИЗНАЧЕННЯ НЕВІДОМОЇ КОНЦЕНТРАЦІЇ ВІДОМОЇ РЕЧОВИНИ ЗА ДОПОМОГОЮ КАЛІБРУВАЛЬНОГО ГРАФІКУ
- •23.4. Люмінесцентний аналіз
- •23.5. Флуоресцентний аналіз
- •23.6. Ядерний магнітний резонанс (ЯМР)
- •23.7. Протонний магнітний резонанс (ПМР)
- •23.8. Інші оптичні методи в кількісному аналізі
- •23.9. Емісійний спектральний аналіз
- •23.10. Атомно-абсорбційна спектроскопія
- •23.11. ЗАСТОСУВАННЯ ДЕЯКИХ МЕТОДІВ ХРОМАТОГРАФІЇ В АНАЛІЗІ ОРГАНІЧНИХ І БІОХІМІЧНИХ РЕЧОВИН
- •23.11.1. Адсорбційна хроматографія
- •23.11.2. Колонкова хроматографія
- •23.11.3. Сорбенти і розчинники
- •23.11.4.5. Тонкошарова і паперова хроматографія
- •ДОСЛІД 1. КІЛЬКІСНЕ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ ЗА ДОПОМОГОЮ ТОНКОШАРОВОЇ ХРОМАТОГРАФІЇ
- •23.11.5. Газова хроматографія
- •23.11.6. Газо-рідинна хроматографія (ГРХ)
- •23.2.8. Високоефективна рідинна хроматографія (ВЕРХ)
- •23.11.6. Афінна хроматографія
- •23.11.7. Іонообмінна хроматографія
- •23.11.8. Гель-хроматографія
- •23.11.9. Надкритична флюїдна хроматографія (НФХ)
- •23.12. Електрофорез
- •23.12. Комбіновані методи аналізу
- •ПРИГОТУВАННЯ НАЙВАЖЛИВІШИХ РЕАГЕНТІВ
- •СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
23.2.8. Високоефективна рідинна хроматографія (ВЕРХ)
Газорідинна хроматографія (ГРХ), незважаючи на її широкі можливості, не може застосовуватись для розділення і визначення речовин з високою молекулярною масою (більше 300), нелетких, термічно
нестійких, іоногенних |
сполук. Ці |
недоліки |
відсутні |
в |
методі |
високоефективної рідинної хроматографії(ВЕРХ). |
Цей вид |
рідинної |
|
||
хроматографії високого тиску оснований на тих же принципах, що і ГРХ, тільки замість газу-носія застосовують потік рідини, як рухому фазу, що не змішується з рідкою нерухомою фазою хроматографічної колонки.
Розділення |
компонентів |
відбувається |
внаслідок |
відмінності |
||
коефіцієнтів розподілення між двома рідкими фазами– рухомою і неру- |
||||||
хомою. |
|
|
|
|
|
|
Важливою |
особливістю |
ВЕРХ |
,є що те |
температура |
||
хроматографічної колонки може бути кімнатною, що дозволяє хроматографу вати білки, амінокислоти, вуглеводи і інші нестійкі сполуки. Мо-
лярна маса речовин, що здатні розділятися, може |
досягати 2000 і |
більше. На рис. 23.11.6.2 приведена система |
ВЕРХ. Розділення |
компонентів з використанням ВЕРХ може бути основане на таких принципах: адсорбція, розподілення, іонний обмін, ексклюзія.
Колонки в ВЕРХ заповнюють твердими пористими частинками розміром 5 – 10 мкм (силікагель, алюмогель, полімерні сорбенти і ін.), поверхня яких вкрита тонкою плівкою рідкої речовини(нерухома фаза) під великим тиском. Малі розміри часток сорбенту і заповнення ними колонки під тиском робить простір між ними дуже малим. Це підвищує
взаємодію речовин, які рухаються через сорбент. |
|
|
|
||||
Для розділення |
полярних |
речовин використовують |
полярні |
НФ |
|||
(нерухома фаза) і відносно мало полярні РФ(рухома фаза). Неполярні |
|||||||
речовини розділяють на неполярних НФ з застосуванням полярних РФ. |
|
||||||
Метод |
ВЕРХ |
має |
ряд |
переваг |
над |
іншими |
метод |
хроматографії: |
|
|
|
|
|
|
|
-швидкість проведення аналізу перевищує більшість інших існуючих методів;
-колонки з сорбентом для ВЕРХ багаторазового використання і не потребують відновлення чи регенерації;
-відтворюваність результатів різних проб дуже висока;
-управління дослідом, аналізом, обробкою інформації, та оформлення кінцевих результатів повністю автоматизовані;
-робоча температура термостатування лежить між температу-
рою замерзання і кипіння рухомої фази(частіше в межах 20 – 50 °С);
281

Рис. 23.11.6.2. Схема пристрою для
ВЕРХ
ВЕРХ дуже широко застосовується для розділення і визначення самих різноманітних речовин: оптично-активних сполук, білків, нуклеїнових і амінокислот, полісахаридів, барвників, вибухових речовин, біологічних об’єктів, лікарських препаратів і т.д. Метод використовують для проведення профільного хроматографічного аналізу медичнобіологічних об’єктів у випадку їх патологічних відхилень від норми.
23.11.6. Афінна хроматографія
Афінна (споріднена) хроматографія розглядається як окремий принцип розділення в рідинній хроматографії і використовується для специфічного виділення окремих речовин, переважно білків.
Суть методу полягає у тому, що до поверхні сорбенту(S) прикріплюють (імобілізують) певну речовину (І) – антитіло, яка високоспецифічно здатна зв'язувати якийсь клас речовин– антиген (фермент, імуноглобулін, рецептор, гормон та ін). Таким імобілізованим сорбентом (S-І) заповнюють колонку і пропускають суміш речовин, яка
282
містить речовину, необхідну для виділення (Р). Ця речовина обов'язково зв'яжеться з сорбентом«афінним» шляхом, найчастіше ковалентним зв'язком (S-І-Р). Усі інші компоненти суміші пройдуть вниз по колонці без будь-якого зв'язування. Після ретельної промивки колонки інертним розчином, проводять відмивання речовини, яка зв'язалась афінно. Цього досягають шляхом елюювання розчином, який викликає дисоціацію комплексу (S-І) + (Р).
Виділення речовин цим методом буде залежати від природи іммобілізованої речовини (І), яка у кожному конкретному випадку різна і служить для дуже вузької але специфічної ролі.
23.11.7. Іонообмінна хроматографія
Метод |
іонообмінної |
хроматографії |
оснований |
на |
яви |
||
іонообмінної |
адсорбції. |
між |
нерухомою |
твердою |
фазою– |
||
іонообмінником |
(сорбент) і |
рухомою |
рідкою фазою– розчином, |
що |
|||
містить іони, які |
обмінюються з іонами |
сорбенту. При іонному обміні |
з |
||||
сорбентом десорбується певна кількість іонів, а з розчину поглинається така ж кількість інших іонів того ж знаку у суворо еквівалентному
співвідношенні. |
|
|
|
|
|
||
|
В якості сорбенту використовують іонообмінники(іоніти), які за- |
|
|||||
звичай знаходяться в твердій фазі і нерозчинні у воді. Іоніти складають- |
|
||||||
ся з матриці, в якій розподілені дві іоногенні групи. Одна з них фіксована |
|
||||||
і міцно зв’язана з матрицею, тоді як інші протийони (йони протилежного |
|
||||||
знаку) не так міцно зв’язані і здатні переходити в розчин, обмінюючись з |
|
||||||
одноіменними йонами (катіони – з катіонами, аніони – з аніонами) з роз- |
|
||||||
чину. |
Іоніти, |
що |
обмінюються катіонами |
з |
розчину називаються |
||
катіонітами, а ті, які обмінюються аніонами – аніонітами. Відомі і |
|
||||||
амфотерні іоніти, які здатні обмінюватися і катіонами і аніонами. |
|
||||||
Розділення іонів з рідкої рухомої фази здійснюється за рахунок різної |
|
||||||
здатності цих йонів до йонного обміну з іонітом. |
|
|
|
||||
|
Іоніти, що застосовують в іонообмінній хроматографії, бувають |
|
|||||
неорганічного і органічного походження; природними і синтетичними. |
|
||||||
Найбільшого |
розповсюдження знайшли |
синтетичні |
іонообмінні смоли, |
|
|||
які |
отримують |
поліконденсацією |
і |
|
полімеризацією, |
сти |
|
паразаміщених фенолів, формальдегіду і інших сполук. Для зшивки |
|
||||||
полімерних ланцюгів додають дивінілбензен. В одержані полімерні |
|
||||||
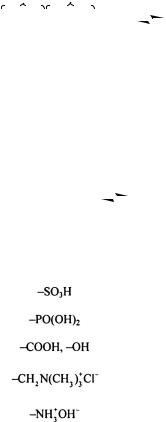
матриці різними способами вводять ті чи інші |
іоногенні групи(-SO3H; |
|
|||||
NH3+OH- і ін.). Неорганічні сорбенти одержують, прививаючи до матриці (наприклад, силікагелю), різні іоногенні чи комплексоутворюючі групи. Запропоновано значне число різних іонообмінних смол для використання в ролі іонообмінників. Деякі з них приведені в табл. 23.11.7.1.
283
Реакцію іонного обміну в колонці |
хроматографа схематично |
||||||||||||||
можна записати таким чином: |
|
|
|
|
|
||||||||||
матриця |
іоногенна група |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3-Me++ H+ |
|
R |
|
|
|
|
SO3-H+ + Me+ |
|
|
R |
|
|||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
||||||||||
катіоніт в Н+-формі
Врозглянутій схемі катіоніт в Н-формі складається з матриці R—
ііоногенної групи SO3-H+. Від’ємно заряджена група SO3- міцно зв’язана ковалентним зв’язком з матрицею, і в іонообмінному процесі участі не
бере. Протиіон H+ може легко відщеплятися і обмінюватися на катіон
+ |
|
|
|
|
|
|
|
|
|
|
|
||
металу Ме, який перейшов з рідкої фази в тверду фазу сорбенту, |
|||||||||||||
утримується іоногенною групою SO3-Ме+, а іон, що перейшов в розчин, |
|||||||||||||
виноситься рухомою рідкою фазою. |
|
|
|
|
|
|
|
||||||
|
Аналогічно протікає і процес аніонного обміну |
|
|
||||||||||
|
R |
|
N(CH3)3+OH-+ A- |
|
|
|
R |
|
|
N(CH3)3+A- + OH- |
|||
|
|
|
|||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
Таблиця 23.11.7.1 |
||
|
|
|
|
Деякі типи іонообмінних смол |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
Тип сорбенту |
Іоногенна група |
|
Рухливі |
Інтервал |
Марка сорбен- |
|||||||
|
|
йони |
рН обміну |
ту* |
|
||||||||
|
|
|
|
|
|
|
|
||||||
|
Сильнокислий |
|
|
|
|
Н+ |
|
0 – 14 |
КУ-1, КУ-2, |
|
|||
|
катіоніт |
|
|
|
|
|
|
|
|
|
СДВ, Дауекс-50 |
|
|
|
Середнокислий |
|
|
|
|
Н+ |
|
4 – 14 |
КФ |
|
|||
|
катіоніт |
|
|
|
|
|
|
|
|
|
|
|
|
|
Слабокислий |
|
|
|
|
|
Н+ |
|
7 – 14 |
КБ-2, КБ-4 |
|
||
|
катіоніт |
|
|
|
|
|
|
|
|
|
|
|
|
|
Сильноосновний |
|
|
|
|
Cl- |
|
0 – 14 |
АВ-17, АВ-18 |
|
|||
|
аніоніт |
|
|
|
|
|
|
|
|
|
|
|
|
|
Слабоосновний |
|
|
|
OH- |
|
0 – 7 |
АН-23, АН-2Ф |
|
||||
|
аніоніт |
|
|
|
|
|
|
|
|
|
|
|
|
*КУ – катіоніт універсальний; СДВ – стиролдивінілбензен; КФ – катіоніт фосфоновокислий; КБ – катіоніт буферний; АВ – аніоніт високоосновний; АН – аніоніт низькоосновний
Спорідненість іонів до сорбенту залежить від ряду факторів: заряду іона, його радіусу, радіусу гідратної (сольватної) оболонки, температури і ін.
Для катіонітів в основному характерна наступна послідовність здатності сорбуватися:
284
