
- •НАВЧАЛЬНИЙ ПОСІБНИК
- •1. ТЕХНІКА БЕЗПЕКИ В ХІМІЧНІЙ ЛАБОРАТОРІЇ
- •1.1. ЗАГАЛЬНІ ПРАВИЛА РОБОТИ В ХІМІЧНІЙ ЛАБОТАТОРІЇ
- •1.2. НАДАННЯ ПЕРШОЇ ДОПОМОГИ
- •2. УСТАТКУВАННЯ І ТЕХНІКА ВИКОНАННЯ ЛАБОРАТОРНИХ РОБІТ
- •2.1. ХІМІЧНИЙ ЛАБОРАТОРНИЙ ПОСУД
- •2.2. НЕСКЛЯНИЙ ПОСУД
- •2.3. ХІМІЧНІ РЕАКТИВИ ТА ЇХ ЗБЕРІГАННЯ
- •2.3.1. Зберігання хімічних реактивів
- •2.3.2. Користування реактивами
- •2.3.3. Класифікація реактивів
- •2.4. МЕТОДИ ОЧИСТКИ ТА ВИДІЛЕННЯ ОРГАНІЧНИХ РЕЧОВИН
- •2.4.1. Очищення методом кристалізації
- •ДОСЛІД 1. ПЕРЕКРИСТАЛІЗАЦІЯ БЕНЗОЙНОЇ КИСЛОТИ
- •ДОСЛІД 2. ОЧИЩЕННЯ ЩАВЛЕВОЇ КИСЛОТИ
- •2.4.2. Очищення методом сублімації
- •ДОСЛІД 1. СУБЛІМАЦІЯ НАФТАЛІНУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.3. Перегонка або дистиляція
- •ДОСЛІД 1. ПРОСТА ПЕРЕГОНКА ЕТАНОЛУ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •2.4.4. ВИЗНАЧЕННЯ ОСНОВНИХ ФІЗИЧНИХ КОНСТАНТ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ ПЛАВЛЕННЯ
- •ДОСЛІД 1. ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ КИПІННЯ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ПОКАЗНИКА ЗАЛОМЛЕННЯ РІДИНИ
- •Контрольні запитання та завдання
- •2.4.5. ЗНЕВОДНЕННЯ ОРГАНІЧНИХ РЕАКТИВІВ
- •2.4.6. Фільтрування
- •Фільтрування через паперові фільтри
- •Правила фільтрування
- •Промивання осадів
- •Правила роботи з центрифугою.
- •ДОСЛІД 1. ЗРІВНОВАЖЕННЯ ЦЕНТРИФУЖНИХ ПРОБІРОК
- •ДОСЛІД 2. ЦЕНТРИФУГУВАННЯ РОЗЧИНІВ
- •3. РОЗЧИНИ ХІМІЧНИХ РЕАКТИВІВ ТА ЇХ ПРИГОТУВАННЯ
- •3.1. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ
- •3.2. РОЗРАХУНКИ ДЛЯ ПРИГОТУВАННЯ РОЗЧИНІВ ПЕВНОЇ КОНЦЕНТРАЦІЇ
- •3.3. ПРИГОТУВАННЯ РОЗЧИНІВ ІЗ ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ РЕЧОВИНИ
- •ДОСЛІД 1. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ)
- •ДОСЛІД 2. ПРИГОТУВАННЯ РОЗЧИНУ МЕНШОЇ КОНЦЕНТРАЦІЇ (МАСОВОЮ ЧАСТКОЮ РОЗЧИНЕНОЇ РЕЧОВИНИ) ІЗ РОЗЧИНУ З БІЛЬШОЮ КОНЦЕНТРАЦІЄЮ
- •ДОСЛІД 5. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •ДОСЛІД 6. ПРИГОТУВАННЯ РОЗЧИНУ З НАПЕРЕД ЗАДАНОЮ МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ ЕКВІВАЛЕНТУ РОЗЧИНЕНОЇ РЕЧОВИНИ
- •Приготувати 1 л 0,1 н розчину H2SO4.
- •Розчини з молярною концентрацією еквіваленту розчиненої речовини готують аналогічно молярним, тільки беруть наважку речовини, що відповідає не молярній масі речовини, а молярній масі еквіваленту речовини.
- •3.4. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
- •Контрольні запитання та завдання
- •4. ЯКІСНИЙ ЕЛЕМЕНТНИЙ АНАЛІЗ ОРГАНІЧНИХ РЕЧОВИН
- •ДОСЛІД 1. ВИДОЗМІНЕННЯ ОРГАНІЧНОЇ РЕЧОВИНИ ЗА ПРОЖАРЮВАННЯ
- •ДОСЛІД 2. ВІДКРИТТЯ КАРБОНУ ТА ГІДРОГЕНУ
- •ДОСЛІД 3. ВІДКРИТТЯ НІТРОГЕНУ
- •ДОСЛІД 4. ВІДКРИТТЯ СУЛЬФУРУ
- •ДОСЛІД 5. ВІДКРИТТЯ ГАЛОГЕНІВ
- •Контрольні запитання та завдання
- •5. ВУГЛЕВОДНІ
- •5.1. НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ МЕТАНУ З НАТРІЙ АЦЕТАТУ
- •ДОСЛІД 2. ОДЕРЖАННЯ МЕТАНУ СУХОЮ ПЕРЕГОНКОЮ ДЕРЕВИНИ
- •ДОСЛІД 3. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ МЕТАНУ
- •ДОСЛІД 4. БРОМУВАННЯ ОКТАНУ
- •Контрольні запитання та завдання
- •5.2. НЕНАСИЧЕНІ ЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКЕНИ)
- •ДОСЛІД 1. ОДЕРЖАННЯ ЕТЕНУ
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО ЕТЕНУ
- •ДОСЛІД 3. М’ЯКЕ ОКИСНЕННЯ ЕТИЛЕНУ (РЕАКЦІЯ ВАГНЕРА)
- •ДОСЛІД 4. ГОРІННЯ ЕТЕНУ
- •ДОСЛІД 5. ВЗАЄМОДІЯ КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТИ З ВУГЛЕВОДНЯМИ
- •5.3. НЕНАСИЧЕНІ АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКІНИ)
- •ДОСЛІД 2. ПРИЄДНАННЯ БРОМУ ДО АЦЕТИЛЕНУ
- •ДОСЛІД 3. ОКИСНЕННЯ АЦЕТИЛЕНУ
- •ДОСЛІД 4. УТВОРЕННЯ АЦЕТИЛЕНІДІВ
- •Утворення аргентум(І) ацетиленіду
- •Утворення купрум(І) ацетиленіду
- •6. АРОМАТИЧНІ ВУГЛЕВОДНІ (АРЕНИ)
- •ДОСЛІД 1. БРОМУВАННЯ БЕНЗЕНУ ТА ТОЛУЕНУ
- •ДОСЛІД 2. НІТРУВАННЯ БЕНЗЕНУ
- •ДОСЛІД 3. СУЛЬФУВАННЯ ТОЛУЕНУ
- •ДОСЛІД 4. ОКИСНЕННЯ АРОМАТИЧНИХ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. НІТРУВАННЯ НАФТАЛІНУ
- •Контрольні запитання та завдання
- •7. ГАЛОГЕНПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 1. ГІДРОЛІЗ ХЛОРОФОРМУ
- •ДОСЛІД 2. ОДЕРЖАННЯ ЙОДОФОРМУ З ЕТАНОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ХЛОРЕТАНУ
- •ДОСЛІД 4. КОЛЬОРОВА РЕАКЦІЯ НА ГАЛАГЕНОПОХІДНІ ВУГЛЕВОДНІВ
- •ДОСЛІД 5. ВИЗНАЧЕННЯ ЧИСТОТИ ХЛОРОФОРМУ
- •ДОСЛІД 6. ОДЕРЖАННЯ БРОМЕТАНУ
- •8. СПИРТИ
- •8. СПИРТИ
- •ДОСЛІД 1. РОЗЧИННІСТЬ СПИРТІВ У ВОДІ
- •ДОСЛІД 2. ВИЯВЛЕННЯ НАЯВНОСТІ ВОДИ У ЕТАНОЛІ ТА ЙОГО ЗНЕВОДНЕННЯ
- •ДОСЛІД 3. РЕАКЦІЯ СПИРТІВ НА ЛАКМУС
- •ДОСЛІД 4. РЕАКЦІЯ З СІРКОВУГЛЕЦЕМ ТА ЛУГОМ НА ПЕРВИННІ ТА ВТОРИННІ СПИРТИ (КСАНТОГЕНОВА ПРОБА)
- •ДОСЛІД 5. РЕАКЦІЇ НА ФУНКЦІОНАЛЬНУ (ГІДРОКСИЛЬНУ) ГРУПУ СПИРТІВ. ЯКІСНА РЕАКЦІЯ НА ПЕРВИННІ, ВТОРИННІ ТА ТРЕТИННІ СПИРТИ. РЕАКЦІЯ З РОЗЧИНОМ ЦИНК ХЛОРИДУ
- •ДОСЛІД 6. РЕАКЦІЯ З МЕТАЛІЧНИМ НАТРІЄМ. ГІДРОЛІЗ АЛКОГОЛЯТУ НАТРІЮ
- •ДОСЛІД 7. ОТРИМАННЯ ДІЕТИЛОВОГО ЕТЕРУ (ЕФІРУ)
- •ДОСЛІД 8. ОКИСНЕННЯ ЕТАНОЛУ
- •ДОСЛІД 9. ОКИСНЕННЯ СПИРТІВ КАЛІЙ ДИХРОМАТОМ
- •ДОСЛІД 10. ЯКІСНА РЕАКЦІЯ НА ГЛІКОЛІ ТА БАГАТОАТОМНІ СПИРТИ З КУПРУМ(II) ГІДРОКСИДОМ
- •КОНТРОЛЬНІ ЗАПИТАННЯ ТА ЗАВДАННЯ
- •9. ФЕНОЛИ
- •Практичне значення фенолів
- •ДОСЛІД 1. КОЛЬОРОВІ (ЯКІСНІ) РЕКЦІЇ ФЕНОЛІВ І НАФТОЛІВ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 2. РОЗЧИННІСТЬ ФЕНОЛУ У ВОДІ
- •ДОСЛІД 3. КИСЛОТНІ ВЛАСТИВОСТІ ФЕНОЛУ. ОДЕРЖАННЯ НАТРІЙ ФЕНОЛЯТУ
- •ДОСЛІД 4. ДІЯ БРОМНОЇ ВОДИ НА ФЕНОЛ
- •ДОСЛІД 5. НІТРУВАННЯ ФЕНОЛУ
- •ДОСЛІД 6. КОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ (УТВОРЕННЯ ФЕНОЛОФОРМАЛЬДЕГІДНОЇ СМОЛИ)
- •10. АЛЬДЕГІДИ ТА КЕТОНИ
- •Практичне значення альдегідів та кетонів
- •ДОСЛІД 1. РЕАКЦІЯ З ФУКСИНСУЛЬФІТНОЮ КИСЛОТОЮ (РЕАКЦІЯ ШИФФА, ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 2. РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА” (ЯКІСНА РЕАКЦІЯ)
- •ДОСЛІД 4. РЕАКЦІЯ З РЕАКТИВОМ ФЕЛІНГА (ЯКІСНА РЕАКЦІЯ НА АЛЬДЕГІДИ)
- •ДОСЛІД 5. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ АМОНІАЧНИМ РОЗЧИНОМ АРГЕНТУМ(І) ГІДРОКСИДУ
- •ДОСЛІД 6. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ РОЗЧИНОМ КАЛІЙ МАНГАНАТУ(VІІ)
- •ДОСЛІД 7. ОКИСНЕННЯ БЕНЗОЙНОГО АЛЬДЕГІДУ КИСНЕМ ПОВІТРЯ
- •ДОСЛІД 8. ПОЛІМЕРИЗАЦІЯ ФОРМАЛЬДЕГІДУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ТА ГІДРОЛІЗ ГЕКСАМЕТИЛЕНТЕТРАМІНУ (УРОТРОПІНУ)
- •ДОСЛІД 10. ОДЕРЖАННЯ МУРАШИНОГО ТА ОЦТОВОГО АЛЬДЕГІДІВ ОКИСНЕННЯМ СПИРТІВ
- •ДОСЛІД 11. РЕАКЦІЯ ДИСМУТАЦІЇ (РЕАКЦІЯ КАННІЦЦАРО)
- •ДОСЛІД 12. ОДЕРЖАННЯ АЦЕТОНУ ІЗ КАЛЬЦІЙ АЦЕТАТУ
- •ДОСЛІД 13. УТВОРЕННЯ ЙОДОФОРМУ ІЗ АЦЕТОНУ. ЯКІСНІ РЕАКЦІЇ НА АЦЕТОН
- •Контрольні запитання та завдання
- •11. КАРБОНОВІ КИСЛОТИ
- •11.1. ОДНООСНОВНІ (МОНОКАРБОНОВІ) КИСЛОТИ
- •ДОСЛІД 1. ДИСОЦІАЦІЯ ОЦТОВОЇ КИСЛОТИ
- •ДОСЛІД 2. ДОБУВАННЯ ФЕРУМ(ІІІ) АЦЕТАТУ ТА ЙОГО ГІДРОЛІЗ
- •ДОСЛІД 3. ВИТІСНЕННЯ СЛАБКИХ КИСЛОТ БІЛЬШ СИЛЬНИМИ З ЇХ СОЛЕЙ (РЕАКЦІЯ З НАТРІЙ КАРБОНАТОМ)
- •ДОСЛІД 4. ОДЕРЖАННЯ МУРАШИНОЇ (МЕТАНОВОЇ) КИСЛОТИ ІЗ ХЛОРОФОРМУ
- •ДОСЛІД 5. ОКИСНЕННЯ НАСИЧЕНИХ КАРБОНОВИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ НЕНАСИЧЕНОЇ (ОЛЕЇНОВОЇ) КИСЛОТИ
- •ДОСЛІД 7. БРОМУВАННЯ ОЛЕЇНОВОЇ КИСЛОТИ
- •ДОСЛІД 9. ІЗОМЕРИЗАЦІЯ ОЛЕЇНОВОЇ КИСЛОТИ В ЕЛАЇДИНОВУ
- •ДОСЛІД 9. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ ІЗ МИЛА
- •Контрольні запитання та завдання
- •11.2. ДВОХОСНОВНІ (ДИКАРБОНОВІ) КИСЛОТИ
- •Фізичні властивості дикарбонових кислот
- •Практичне значення дикарбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ НАТРІЙ ОКСАЛАТУ
- •ДОСЛІД 2. РОЗКЛАДАННЯ ОКСАЛАТНОЇ (ЕТАНДІОВОЇ) КИСЛОТИ ПРИ НАГРІВАННІ (РЕАКЦІЯ ДЕКАРБОКСИЛУВАННЯ)
- •ДОСЛІД 3. ОКИСНЕННЯ ОКСАЛАТНОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ ОКСАЛАТНОЇ КИСЛОТИ З ЛУГОМ
- •ДОСЛІД 5. ОДЕРЖАННЯ АНГІДРИДУ БУРШТИНОВОЇ КИСЛОТИ
- •Контрольні запитання та завдання
- •11.3. ГІДРОКСИКИСЛОТИ ТА ОКСОКИСЛОТИ
- •ДОСЛІД 1. ВЗАЄМОДІЯ ГІДРОКСИКИСЛОТ З ФЕРУМ(ІІІ) ХЛОРИДОМ (ЯКІСНА РЕАКЦІЯ НА ГІДРОКСИКИСЛОТИ)
- •ДОСЛІД 2. ОКИСНЕННЯ МОЛОЧНОЇ ТА ВИННОЇ КИСЛОТ
- •ДОСЛІД 3. ОДЕРЖАННЯ КИСЛОЇ ТА СЕРЕДНЬОЇ КАЛІЄВИХ СОЛЕЙ ВИННОЇ КИСЛОТИ
- •ДОСЛІД 4. ОДЕРЖАННЯ СЕГНЕТОВОЇ СОЛІ
- •ДОСЛІД 5. ВЗАЄМОДІЯ СЕГНЕТОВОЇ СОЛІ З КУПРУМ(ІІ) ГІДРОКСИДОМ (ОДЕРЖАННЯ РЕАКТИВУ ФЕЛІНГА)
- •ДОСЛІД 6. РОЗКЛАДАННЯ ЛИМОННОЇ (ЦИТРАТНОЇ КИСЛОТИ) СУЛЬФАТНОЮ КИСЛОТОЮ
- •Контрольні запитання та завдання
- •11.4. АРОМАТИЧНІ КИСЛОТИ. ФЕНОЛОКИСЛОТИ
- •Практичне значення ароматичних карбонових кислот
- •ДОСЛІД 1. ОДЕРЖАННЯ БЕНЗОЙНОЇ КИСЛОТИ З ТОЛУЕНУ
- •ДОСЛІД 2. ОЧИЩЕННЯ БЕНЗОЙНОЇ КИСЛОТИ СУБЛІМАЦІЄЮ
- •ДОСЛІД 3. РОЗКЛАДАННЯ САЛІЦИЛОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВЗАЄМОДІЯ БЕНЗОЙНОЇ ТА САЛІЦИЛОВОЇ КИСЛОТ ІЗ ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 5. КОЛЬОРОВА РЕАКЦІЯ ФЕНІЛСАЛІЦИЛАТУ (САЛОЛУ) З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 6. ДІЯ БРОМНОЇ ВОДИ НА САЛІЦИЛОВУ ТА БЕНЗОЙНУ КИСЛОТИ
- •ДОСЛІД 7. ОКИСНЕННЯ КОРИЧНОЇ КИСЛОТИ
- •ДОСЛІД 8. КОЛЬОРОВІ РЕАКЦІЇ ГАЛОВОЇ КИСЛОТИ І ТАНІНУ З ФЕРУМ(ІІІ) ХЛОРИДОМ
- •ДОСЛІД 9. ОДЕРЖАННЯ ФЕНОЛФТАЛЕЇНУ
- •Контрольні запитання та завдання
- •12. ЕСТЕРИ
- •Практичне значення естерів
- •ДОСЛІД 1. ДОБУВАННЯ ЕТИЛЕТАНОАТУ (ЕТИЛАЦЕТАТУ)
- •ДОСЛІД 3. ДОБУВАННЯ ІЗОАМІЛМЕТИЛБУТАНОАТУ («ЯБЛУЧНОЇ ЕСЕНЦІЇ»)
- •ДОСЛІД 4. ДОБУВАННЯ ЕТИЛБЕНЗОАТУ
- •ДОСЛІД 6. ГІДРОЛІЗ АЦЕТИЛСАЛІЦИЛОВОЇ КИСЛОТИ (АСПІРИНУ)
- •Контрольні запитання та завдання
- •13.1. Прості ліпіди
- •Практичне значення жирів
- •ДОСЛІД 1. ОМИЛЕННЯ ЖИРІВ ЛУГОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ ГЛІЦЕРОЛУ
- •ДОСЛІД 3. ОДЕРЖАННЯ ЖИРНИХ КИСЛОТ З МИЛА
- •ДОСЛІД 4. УТВОРЕННЯ НЕРОЗЧИННОГО У ВОДІ МИЛА
- •ДОСЛІД 5. ВИЯВЛЕННЯ В ЖИРАХ ЗАЛИШКІВ НЕНАСИЧЕНИХ ЖИРНИХ КИСЛОТ
- •ДОСЛІД 6. ОКИСНЕННЯ РОСЛИННИХ ОЛІЙ
- •ДОСЛІД 7. ЕМУЛЬГУВАННЯ ЖИРІВ
- •ДОСЛІД 8. ВИЗНАЧЕННЯ ЙОДНОГО ЧИСЛА
- •ДОСЛІД 9. ВИЗНАЧЕННЯ КИСЛОТНОГО ЧИСЛА
- •Контрольні запитання та завдання
- •13.2. Складні ліпіди
- •13.3. Ізопреноїди
- •ДОСЛІД 1. ПЕРЕГОНКА ЖИВИЦІ
- •ДОСЛІД 2. ФРАКЦІОНУВАННЯ СКИПИДАРУ
- •ДОСЛІД 3. ДІЯ БРОМНОЇ ВОДИ НА СКИПИДАР
- •ДОСЛІД 4. ОКИСНЕННЯ СКИПИДАРУ КАЛІЙ МАНГАНАТОМ(VII)
- •ДОСЛІД 5. ОДЕРЖАННЯ ТЕРПІНЕОЛУ З ТЕРПІНГІДРАТУ
- •14. ВУГЛЕВОДИ
- •14.1. Моносахариди
- •Практичне значення моносахаридів
- •ДОСЛІД 1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ГЛЮКОЗІ
- •ДОСЛІД 3. ОКИСНЕННЯ АЛЬДОЗ АМОНІАЧНИМ РОЗЧИНОМ АРҐЕНТУМ(І) ГІДРОКСИДУ (РЕАКЦІЯ “СРІБНОГО ДЗЕРКАЛА”)
- •ДОСЛІД 4. ВЗАЄМОДІЯ ГЛЮКОЗИ З РЕАКТИВОМ ФЕЛІНГА
- •ДОСЛІД 5. РЕАКЦІЯ СЕЛІВАНОВА НА ФРУКТОЗУ
- •ДОСЛІД 6. ВИЗНАЧЕННЯ АСКОРБІНОВОЇ КИСЛОТИ (ВІТАМІНУ С). ЯКІСНА РЕАКЦІЯ НА ВІТАМІН С
- •Контрольні запитання та завдання
- •14.2. Дисахариди
- •ДОСЛІД1. ДОКАЗ НАЯВНОСТІ ГІДРОКСИЛЬНИХ ГРУП В ДИСАХАРИДАХ
- •ДОСЛІД 2. ДІЯ РЕАКТИВУ ФЕЛІНГА НА ДИСАХАРИДИ
- •ДОСЛІД 3. ГІДРОЛІЗ (ІНВЕРСІЯ) САХАРОЗИ
- •ДОСЛІД 4. ЯКІСНА РЕАКЦІЯ НА САХАРОЗУ
- •Контрольні запитання та завдання
- •14.3. Полісахариди
- •Практичне значення полісахаридів
- •ДОСЛІД 1. КОЛЬОРОВА РЕАКЦІЯ НА КРОХМАЛЬ
- •ДОСЛІД 2. РЕАГУВАННЯ КРОХМАЛЮ НА РЕАКТИВ ФЕЛІНГА
- •ДОСЛІД 3. КИСЛОТНИЙ ГІДРОЛІЗ КРОХМАЛЮ
- •ДОСЛІД 4. КИСЛОТНИЙ ГІДРОЛІЗ КЛІТКОВИНИ (ЦЕЛЮЛОЗИ)
- •ДОСЛІД 5. ОДЕРЖАННЯ ШТУЧНОГО ПЕРГАМЕНТУ
- •ДОСЛІД 6. ХАРАКТЕРНІ РЕАКЦІЇ НА ЛІГНІН
- •Контрольні запитання та завдання
- •Практичне значення амінів
- •ДОСЛІД 1. ОТРИМАННЯ МЕТИЛАМІНУ З АЦЕТАМІДУ
- •ДОСЛІД 2. РЕАКЦІЯ ВОДНОГО РОЗЧИНУ МЕТИЛАМІНУ НА ІНДИКАТОРИ
- •ДОСЛІД 3. РЕАКЦІЯ ГАЗУВАТОГО МЕТИЛАМІНУ З КОНЦЕНТРОВАНОЮ СОЛЯНОЮ КИСЛОТОЮ
- •ДОСЛІД 4. РЕАКЦІЯ МЕТИЛАМІНУ З НІТРАТНОЮ(ІІІ) КИСЛОТОЮ
- •ДОСЛІД 6. УТВОРЕННЯ СОЛЕЙ АНІЛІНУ
- •ДОСЛІД 7. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ ХЛОРНОГО ВАПНА
- •ДОСЛІД 8. ОКИСНЕННЯ АНІЛІНУ РОЗЧИНОМ КАЛІЙ ДИХРОМАТУ
- •ДОСЛІД 9. ДІЯ БРОМНОЇ ВОДИ НА АНІЛІН
- •ДОСЛІД 10. КОНДЕНСАЦІЯ АНІЛІНУ З ФОРМАЛЬДЕГІДОМ
- •Контрольні запитання та завдання
- •16. ДІАЗОСПОЛУКИ ТА АЗОБАРВНИКИ
- •ДОСЛІД 1. ДІАЗОТУВАННЯ АНІЛІНУ
- •ДОСЛІД 2. ВПЛИВ ТЕМПЕРАТУРИ НА СОЛІ ФЕНІЛДІАЗОНІЮ
- •ДОСЛІД 3. УТВОРЕННЯ КИСЛИХ АЗОБАРВНИКІВ
- •ДОСЛІД 4. УТВОРЕННЯ ОСНОВНОГО АЗОБАРВНИКА
- •ДОСЛІД 5. ВПЛИВ РЕАКЦІЇ СЕРЕДОВИЩА НА ЗМІНИ КОЛЬОРУ ОСНОВНОГО АЗОБАРВНИКА
- •17. АМІДИ КИСЛОТ
- •ДОСЛІД 1. УТВОРЕННЯ СОЛЕЙ СЕЧОВИНИ З КИСЛОТАМИ
- •ДОСЛІД 2. ВЗАЄМОДІЯ СЕЧОВИНИ З НАТРІЙ ГІПОБРОМІТОМ (РЕАКЦІЯ А.П. БОРОДІНА)
- •ДОСЛІД 3. ГІДРОЛІЗ АМІДІВ КИСЛОТ
- •ДОСЛІД 4. УТВОРЕННЯ БІУРЕТУ
- •ДОСЛІД 5. РЕАКЦІЯ СЕЧОВИНИ З МЕРКУРІЙ(ІІ) НІТРАТОМ
- •ДОСЛІД 6. РЕАКЦІЯ СЕЧОВИНИ З НАТРІЙ НІТРАТОМ(ІІІ)
- •18. АМІНОКИСЛОТИ
- •18. АМІНОКИСЛОТИ
- •ДОСЛІД 2. РЕАКЦІЯ ГЛІЦИНУ З КУПРУМ(ІІ) ОКСИДОМ
- •ДОСЛІД 3. РЕАКЦІЯ ГЛІЦИНУ З FеCl3
- •ДОСЛІД 4. ДЕЗАМІНУВАННЯ АМІНОКИСЛОТ
- •ДОСЛІД 5. РЕАКЦІЯ АМІНОКИСЛОТ З НІНГІДРИНОМ
- •Контрольні запитання та завдання
- •19. БІЛКИ ТА ПЕПТИДИ
- •Функції білків
- •КОЛЬОРОВІ РЕАКЦІЇ БІЛКІВ
- •ДОСЛІД 1. БІУРЕТОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 2. КСАНТОПРОТЕЇНОВА РЕАКЦІЯ НА БІЛКИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ СУЛЬФУРУ У БІЛКАХ. РЕАКЦІЯ БІЛКУ З ПЛЮМБУМ(ІІ) АЦЕТАТОМ
- •ДОСЛІД 4. ВИЗНАЧЕННЯ ТИРОЗИНУ У БІЛКАХ
- •ДОСЛІД 5. ДЕНАТУРАЦІЯ (КОАГУЛЯЦІЯ) БІЛКІВ ЗА НАГРІВАННЯ
- •ДОСЛІД 6. ДЕНАТУРАЦІЯ ТА ВИСОЛЮВАННЯ БІЛКІВ ПРИ ДІЇ РІЗНИХ РЕЧОВИН
- •ДОСЛІД 7. ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ БІЛКІВ
- •ДОСЛІД 8. ГОРІННЯ ЯК СПОСІБ РОЗПІЗНАВАННЯ БІЛКОВИХ МАТЕРІАЛІВ
- •Контрольні запитання та завдання
- •20. ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •Практичне значення гетероциклічних сполук
- •ДОСЛІД 1. ВІДНОВЛЕННЯ ІНДИГОКАРМІНУ ГЛЮКОЗОЮ
- •ДОСЛІД 2.ОДЕРЖАННЯ СЕРЕДНЬОЇ ТА КИСЛОЇ СОЛЕЙ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 4. ВИЯВЛЕННЯ СЕЧОВОЇ КИСЛОТИ
- •ДОСЛІД 5. ОДЕРЖАННЯ ФУРФУРОЛУ
- •ДОСЛІД 6. ОДЕРЖАННЯ КОФЕЇНУ З ЧАЮ
- •Контрольні запитання та завдання
- •Практичне значення алкалоїдів
- •ДОСЛІД 1. УТВОРЕННЯ НЕРОЗЧИННИХ СОЛЕЙ АЛКАЛОЇДІВ
- •ДОСЛІД 2. КОЛЬОРОВА РЕАКЦІЯ НА АЛКАЛОЇДИ З СУЛЬФАТНОЮ КИСЛОТОЮ
- •ДОСЛІД 3. РЕАКЦІЯ ХІНІНУ З БРОМНОЮ ВОДОЮ ТА АМОНІАКОМ. ТАЛЕЙОХІННА ПРОБА
- •Талейохін
- •Контрольні запитання та завдання
- •22. ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ
- •22.1. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ФЕНОЛОПЛАСТІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У КИСЛОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 2. ПОЛІКОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ У ЛУЖНОМУ СЕРЕДОВИЩІ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •22.2. ОДЕРЖАННЯ ТА ВЛАСТИВОСТІ ПОЛІАМІДІВ
- •ДОСЛІД 1. ПОЛІКОНДЕНСАЦІЯ КАРБАМІДУ З ФОРМАЛЬДЕГІДОМ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ “ЖИТТЄЗДАТНОСТІ” СМОЛИ
- •ДОСЛІД 3. ВИЗНАЧЕННЯ ЧАСУ ТВЕРДНЕННЯ СМОЛИ
- •Контрольні запитання та завдання
- •22.3. ДЕСТРУКЦІЯ ПОЛІМЕРІВ
- •ДОСЛІД 2. ДЕПОЛІМЕРИЗАЦІЯ КАУЧУКУ (АБО ГУМИ)
- •ДОСЛІД 3. ДЕПОЛІМЕРИЗАЦІЯ ОРГАНІЧНОГО СКЛА
- •Контрольні запитання та завдання
- •22.4. ВИВЧЕННЯ ВЛАСТИВОСТЕЙ РОЗЧИНІВ ПОЛІМЕРІВ
- •Розчинення та набрякання полімерів
- •Висолювання високомолекулярних сполук
- •ДОСЛІД 1. ДОСЛІДЖЕННЯ ШВИДКОСТІ НАБРЯКАННЯ
- •ДОСЛІД 2. ВИСОЛЮВАННЯ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК
- •Контрольні запитання та завдання
- •23. ОСНОВНІ ФІЗИКО-ХІМІЧНІ МЕТОДИ ДОСЛІДЖЕННЯ ОРГАНІЧНИХ І БІОХІМІЧНИХ СПОЛУК
- •23.1. ЗАГАЛЬНІ ПОЛОЖЕННЯ ОПТИЧНОЇ СПЕКТРОСКОПІЇ
- •23.2. ІНФРАЧЕРВОНА СПЕКТРОСКОПІЯ
- •ДОСЛІД 1. ВИВЧЕННЯ СПЕКТРІВ ПОГЛИНАННЯ РОЗЧИНІВ ФЕНОЛУ, АНІЛІНУ, ТИРОЗИНУ, РИБОФЛАВІНУ
- •ДОСЛІД 2. ВИЗНАЧЕННЯ СПЕКТРУ ЗА ОКРЕМИМИ ДОВЖИНАМИ ХВИЛЬ.
- •ДОСЛІД 3. ВИЗНАЧЕННЯ НЕВІДОМОЇ КОНЦЕНТРАЦІЇ ВІДОМОЇ РЕЧОВИНИ ЗА ДОПОМОГОЮ КАЛІБРУВАЛЬНОГО ГРАФІКУ
- •23.4. Люмінесцентний аналіз
- •23.5. Флуоресцентний аналіз
- •23.6. Ядерний магнітний резонанс (ЯМР)
- •23.7. Протонний магнітний резонанс (ПМР)
- •23.8. Інші оптичні методи в кількісному аналізі
- •23.9. Емісійний спектральний аналіз
- •23.10. Атомно-абсорбційна спектроскопія
- •23.11. ЗАСТОСУВАННЯ ДЕЯКИХ МЕТОДІВ ХРОМАТОГРАФІЇ В АНАЛІЗІ ОРГАНІЧНИХ І БІОХІМІЧНИХ РЕЧОВИН
- •23.11.1. Адсорбційна хроматографія
- •23.11.2. Колонкова хроматографія
- •23.11.3. Сорбенти і розчинники
- •23.11.4.5. Тонкошарова і паперова хроматографія
- •ДОСЛІД 1. КІЛЬКІСНЕ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ ЗА ДОПОМОГОЮ ТОНКОШАРОВОЇ ХРОМАТОГРАФІЇ
- •23.11.5. Газова хроматографія
- •23.11.6. Газо-рідинна хроматографія (ГРХ)
- •23.2.8. Високоефективна рідинна хроматографія (ВЕРХ)
- •23.11.6. Афінна хроматографія
- •23.11.7. Іонообмінна хроматографія
- •23.11.8. Гель-хроматографія
- •23.11.9. Надкритична флюїдна хроматографія (НФХ)
- •23.12. Електрофорез
- •23.12. Комбіновані методи аналізу
- •ПРИГОТУВАННЯ НАЙВАЖЛИВІШИХ РЕАГЕНТІВ
- •СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
Способи фільтрування
Найпоширенішим матеріалом, застосовуваним у лабораторії для фільтрування, є фільтрувальний папір. На відміну від звичайного паперу він виготовляється з більш чистого матеріалу і не проклеюється. Фільтрувальний папір випускається звичайний і беззольний.
Беззольний папір уживається при точних аналітичних роботах, пов'я- заних із спалюванням осаду разом із фільтром. В усіх інших випадках застосовується звичайний фільтрувальний папір. Крім того, беззольні фільтри відрізняються один від одного ступенем щільності.
Фільтрування через паперові фільтри
З фільтрувального паперу роблятьпрості та складчасті фільтри. Простий фільтр уживають у тих випадках, коли відокремлений осад потрібний для подальшої роботи. Розмір фільтра визначають розміром осаду, а не об’ємом рідини, що фільтрується. Осад має займати біля 1/3 фільтра і ні в якому разі не більше його половини. Складчастий фільтр застосовується тільки в тих випадках, коли осад, що відокремлюється, не потрібний для подальшої роботи, наприклад, при перекристалізації реактивів і готуванні різноманітних розчинів. Фільтруюча поверхня складчастого фільтра більша, ніж простого, тому фільтрування через нього йде швидше. У даному випадку розмір фільтра визначається кількістю рідини, що фільтрується, а не розміром осаду.
Виготовлення простого фільтру
Простий фільтр виготовляють у такій послідовності (рис. 14): шматок фільтрувального паперу складають учетверо й округляють ножицями по краю (а—в). Беззольні фільтри округляти не треба, тому що вони випускаються у вигляді кругів визначеного діаметра. Фільтр розгинають так, щоб він був складений тільки вдвічі і знову перегинають у центрі таким чином, щоб дві половини лінії попереднього згину не цілком співпали один з одним(г). Кут, під котрим треба перегинати фільтр, знаходять дослідним шляхом, він залежить від кута лійки, що дорівнює 600. Склавши фільтр, відгинають від нього зовнішній кут (д) для того, щоб у вологому стані його можна було притиснути до стінок лійки. Потім відгинають від фільтра 1/4 (е) і вставляють у лійку. Якщо фільтр закладений правильно, то його краї прилягають до лійки так, що між лійкою і фільтром немає пухирів повітря.
32
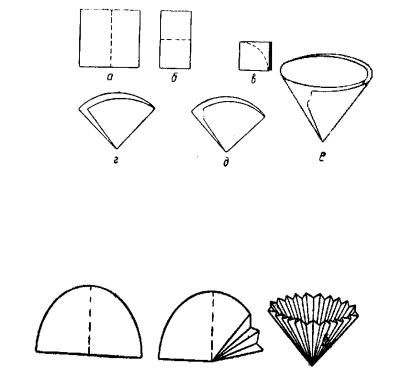
Рис. 14. Виготовлення простого фільтру
Виготовлення складчастого фільтру
Складчастий фільтр (рис. 15) виготовляють спочатку як простий, округлюють краї (а), а потім, зігнувши навпіл, фільтр складають гармошкою так, щоб кожна часточка приблизно дорівнювала1/2 або 1/3 чверті фільтра (б, в).
а |
б |
в |
Рис. 15. |
Виготовлення складчастого фільтру |
|
Правила фільтрування
Для фільтрування при кімнатній температурі і нормальному атмосферному тиску застосовують скляні лійки. Лійку вставляють у кільце штатива і під нього ставлять стакан для фільтрату. Носик лійки повинен трохи входити в стакан і торкатися до його стінки. Кінець трубки має бути на достатній висоті від дна стакана, щоб при наповненні стакана фільтратом трубка лійки не виявилася зануреною в рідину(рис. 16). У лійку вставляють фільтр такого діаметра, щоб його краї були нижче країв лійки на 0,5 – 1,0 см. Потім змочують фільтр водою з промивалки і притискають пальцем щільно до стінок лійки. Якщо налити тепер воду на фільтр, то вона повинна заповнити всю трубку лійки. Якщо цього не відбувається, то закривають кінець лійки пальцем і наповнюють лійку водою. Обережно відсунувши в одному місці фільтр від скла, дають повіт-
33
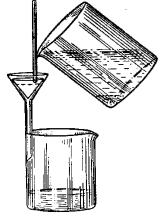
рю піднятися нагору і знову щільно притискають фільтр до скла. Трубка лійки заповнюється водою, і стовпчик рідини в трубці своєю масою робить деяке відсмоктування фільтрату і цим прискорює фільтрування.
Якщо фільтрат збирають у колби(конічні або плоскодонні), то лійку не варто вставляти безпосередньо в горло колби. На горло колби кладуть фарфоровий або дротовий трикутник і в нього вставляють лійку. Можна між лійкою і горлом колби вкласти шматочок паперу, складений у декілька разів.
Коли лійка з фільтром цілком підготовлена, вставляють лійку в кільце штатива і підставляють під нього чистий стакан або колбу так, як це було описано вище.
Рис. 16. Схема правильного фільтрування
Стакан, що містить фільтруючу рідину, беруть правою рукою і піднімають трохи над лійкою. Скляну паличку, що служить для перемішування рідини при її осадженні, обережно виймають із стакана, щоб жодна крапля рідини не впала на стіл. Паличку тримають лівою рукою вертикально над лійкою, намагаючись щоб нижній кінець палички знаходився близько від фільтра, але не доторкався до нього, щоб не порвати. Для попередження розриву при випадковому дотику палички до фільтра варто тримати паличку з тієї сторони фільтра, де він складений втроє. Стакан наближають до палички, щоб він доторкнувся до неї своїм носиком, і обережно нахиляють. Рідина повинна стікати по паличці не розбризкуючись. Рідину наливають на фільтр доти, поки рівень її не буде відстояти від країв паперу на 0,5 см.
34
