
- •Раздел I
- •Глава 1 Газообменная и негазообменные функции легких
- •Глава 2
- •Глава 3 Физиологические критерии транспорта кислорода
- •Раздел II
- •Глава 4 Клинические формы острой дыхательной недостаточности
- •Глава 5 Элементы респираторной терапии
- •5.1. Оксигенотерапия
- •5.2. Бронходилататоры
- •5.3. Антиоксиданты и антигипоксанты
- •5.4. Аэрозольная терапия
- •5.6. Стимуляторы дыхания
- •Глава 6 Респираторная поддержка
- •6.1. Физиологические аспекты ивл
- •6.2. Показания к ивл
- •6.3. Методы отмены ивл
- •6.4. Уход за больным во время ивл
- •6.5. Осложнения ивл
- •Глава 7 Механическая вентиляция легких
- •7.1. Режимы механической ив л
- •Глава 8 Респираторный мониторинг
- •8.1. Инвазивные методы оценки газообмена
- •8.2. Неинвазивный мониторинг газов крови
- •Глава 9 Острая обструкция дыхательных путей
- •9.1. Обструкция верхних дыхательных путей
- •9.2. Обструкция нижних дыхательных путей
- •9.3. Синдром Мендельсона
- •Глава 10 Астматический статус
- •Глава 11
- •Глава 12 Нозокомиальная пневмония
- •Глава 13 Респираторный дистресс-синдром взрослых
- •Глава 14
- •14.1. Неинвазивные методы восстановления проходимости дыхательных путей
- •14.2. Инвазивные методы восстановления проходимости дыхательных путей
- •14.3. Методы профилактики легочных осложнений
- •Раздел III
- •Глава 15 Острая сердечная недостаточность
- •15.1. Левожелудочковая недостаточность
- •15.2. Диастолическая дисфункция
- •15.3. Правожелудочковая недостаточность
- •15.4. Острый инфаркт миокарда
- •15.5. Кардиогенные причины внезапной смерти
- •Глава 16 Инвазивный мониторинг центральной гемодинамики
- •16.1. Катетеризация легочной артерии
- •16.2. Теория и практика заклинивания легочной артерии
- •16.3. Измерение сердечного выброса
- •16.4. Гемодинамический профиль
- •16.5. Клиническая интерпретация гемодинамического профиля
- •16.6. Осложнения катетеризации легочной артерии
- •Глава 17 Неинвазивный мониторинг центральной гемодинамики
- •17.1. Клинические аспекты неинвазивного гемодинамического мониторинга
- •Глава 18 Применение инотропных и вазоактивных препаратов
- •18.1. Фармакотерапия гемодинамических нарушений
- •18.2. Препараты с положительным инотропным действием
- •18.3. Вазодилататоры
- •18.4. Другие препараты, применяемые для лечения шока и сердечной недостаточности
- •Глава 19
- •19.1. Кардиоверсия
- •19.2. Электрическая стимуляция сердца
- •19.3. Некоторые препараты, применяемые при аритмиях
- •Глава 20 Отек легких
- •20.1. Кардиогенный отек легких
- •5. Применение препаратов положительного инотропного действия.
- •20.2. Отек легких при изменениях код
- •20.3. Отек легких при повышенной проницаемости сосудистой стенки
- •Глава 21 Тромбоэмболия легочной артерии
- •Глава 22 Гипертонический криз
- •22.1. Лекарственная терапия гипертонического криза
- •Глава 23
- •23.1. Анатомо-топографические основы сердечно-сосудистой системы
- •23.2. Методы инвазивных манипуляций
- •Раздел IV
- •Глава 24 Кардиогенный шок
- •Глава 25 Гиповолемический шок
- •Глава 26 Анафилактический шок
- •Раздел V
- •Глава 27
- •Глава 28 Интенсивная терапия септического синдрома
- •Глава 29 Септический шок
- •Раздел VI
- •Глава 30 Водно-электролитное равновесие
- •30.1. Водный баланс организма
- •30.2. Водные разделы организма
- •30.3. Осмолярность и код
- •30.4. Почечная регуляция водно-электролитного равновесия
- •30.5. Основная роль ионов
- •Глава 31 Дисбаланс жидкости и электролитов
- •31.1. Клинические и лабораторные признаки нарушений баланса воды и электролитов
- •31.2. Виды нарушений баланса воды и электролитов
- •31.3. Нарушение осмолярности (гипо- и гиперосмолярные состояния)
- •31.4. Нарушения код плазмы
- •31.5. Нарушения баланса электролитов
- •Глава 32 Кислотно-основное состояние
- •32.1. Буферные системы
- •Глава 33 Нарушения кислотно-основного состояния
- •33.1. Острый дыхательный ацидоз
- •33.2. Хронический дыхательный ацидоз
- •33.3. Острый дыхательный алкалоз
- •33.4. Хронический дыхательный ал! алоз
- •33.6. Лактат-ацидоз
- •33.8. Алкогольный кетоацидоз
- •33.9. Метаболический алкалоз
- •Глава 34 Острая почечная недостаточность
- •Глава 35
- •36.1. Базисная инфузионная терапия
- •36.2. Корригирующая инфузионная терапия
- •36.3. Пути введения инфузионных растворов
- •36.4. Интенсивная терапия осмолярных и объемных нарушений
- •36.5. Корригирующая терапия при метаболическом алкалозе
- •36.6. Корригирующая терапия при метаболическом ацидозе
- •36.7. Особенности инфузионной терапии у лиц пожилого возраста и больных с сопутствующими сердечно - сосудистыми заболеваниями
- •36.8. Осложнения инфузионной терапии
- •Глава 37 Инфузионные среды
- •37.1.1. Гетерогенные коллоидные растворы
- •37.1.2. Аутогенные коллоидные растворы
- •3 7.2.1. Замещающие растворы
- •37.6. Кровезаменители
- •Раздел VIII
- •Глава 38 Энтералыюе питание
- •38.1. Стандартизированные полимерные диеты
- •38.2. Энтеральное питание в предоперационном периоде
- •38.3. Энтеральное питание в послеоперационном периоде
- •38.4. Энтеральное питание у различных контингентов больных
- •Глава 39 Парентеральное питание
- •39.1. Энергетический баланс
- •39.2. Азотистый баланс
- •39.3. Потребность организма в белке
- •39.4. Источники энергии
- •39.5. Источники аминного азота. Аминокислотные смеси и белковые гидролизаты
- •39.6. Рациональные программы парентерального питания
- •39.7. Метаболические осложнения парентерального питания
- •Раздел IX
- •Глава 40
- •40.1. Предоперационный период
- •40.2. Операционный период (управление жидкостным балансом)
- •40.3. Послеоперационный период
- •40.4. Особенности инфузионной терапии при некоторых хирургических заболеваниях
- •40.4.1. Перитонит
- •40.4.2. Острый панкреатит
- •40.4.3. Кишечная непроходимость
- •Глава 41
- •41.1. Противомикробные средства для системного использования
- •41.2. Эмпирическая антибактериальная терапия
- •41.3. Этиотропная антибактериальная терапия
- •41.4. Селективная деконтаминация желудочно-кишечного тракта
- •41.5. Грибковая инфекция
- •Глава 42
- •42.1. Респираторные осложнения
- •42.2. Расстройства кровообращения
- •42.3. Взаимосвязь гемодинамических и респираторных нарушений
- •Глава 43 Послеоперационное обезболивание
- •43.1. Наркотические,
- •43.2. Неопиоидные анальгетики
- •43.3. Местные анестетики
- •43.4. Варианты
- •43.5. Принцип превентивной и непрерывной терапии боли в хирургии
- •Раздел X
- •Глава 44 Обморок. Делирий. Кома
- •44.1. Обморок
- •44.2. Эпилептические припадки
- •44.3. Спутанность сознания и делирий
- •44.4. Коматозные состояния
- •44.5. Алгоритм реанимационных мероприятий
- •44.6. Общая стратегия защиты головного мозга [по Фитч в., 1995]
- •Глава 45 Боль. Болевой синдром. Психологический стресс
- •45.1. Принципы обезболивающей терапии
- •II. Дифференцировка типа боли и выбор обезболивающей терапии
- •45.2. Психологический и эмоциональный стрессы
- •Глава 46
- •Раздел XI
- •Глава 47
- •47.1. Остановка кровообращения
- •47.2.1. Обеспечение проходимости дыхательных путей
- •47.2.4. Контроль за эффективностью сердечно-легочной реанимации
- •Глава 48 Остановка сердца в отделении интенсивной терапии
- •48.1. Фибрилляция желудочков
- •48.2. Желудочковая тахикардия
- •48.3. Асистолия
- •48.4. Электромеханическая диссоциация
- •48.5. Брадиаритмии
- •48.6. Медикаментозная терапия
- •48.7. Кислородотерапия во время сердечно-легочной реанимации
- •48.8. Электрическая дефибрилляция
- •48.9. Оживление с помощью прямого массажа сердца
- •48.10. Другие методы сердечно-легочной реанимации
- •48.11. Постреанимационный период
Глава 35
Диссеминированное внутрисосудистое свертывание
(ДВС-синдром)
ДВС-синдром с трудом поддается четкому и краткому определению. Его клинические проявления многочисленны, значительно варьируют по своей выраженности и локализации. Лабораторные данные в связи с низкой специфичностью тестов не могут служить достаточным основанием для диагноза. Расстройства других жизненно важных функций, возникшие при ДВС или независимо от этого, окончательно запутывают ситуацию.
ДВС — это не болезнь и не симптом, а приобретенный синдром, в истоках которого всегда лежит какая-то «катастрофа». К числу наиболее типичных его черт следует отнести следующую совокупность парадоксальных клинических и лабораторных проявлений: патологическую кровоточивость, распространенные тромбозы, полиорганную недостаточность, потребление прокоагулян-тов и антикоагулянтов, активизацию или, напротив, подавление вторичного фибринолиза.
Патофизиологические аспекты
ДВС. При умеренной тканевой травме происходит местное и контролируемое превращение тромбина из протромбина. Как следствие в просвете поврежденных сосудов из фибриногена выпадает фибрино-вый сгусток, кровотечение прекращается.
При обширном же повреждении тканей или прямом попадании в кровоток веществ с выраженной прокоагулянтной активностью (тромбопластин, бактериальные эндотоксины, амниотическая жидкость, змеиный яд) возникает системное и неконтролируемое превращение протромбина в тромбин. Под
влиянием последнего фибриновые сгустки выпадают на всем протяжении микроциркуляторного русла — развиваются тканевая ишемия и дисфункция органов.
Растворение этих диссеминиро-ванных сгустков и восстановление кровотока достигается усиленным фибринолизом (за счет повышенного синтеза плазмина). При этом в числе прочих растворяются и тромбы в поврежденных сосудах. Кровотечение в зоне травмы возобновляется или усиливается.
На следующем этапе активное потребление запасов тромбина и плаз-мина приводит к их истощению, несвертыванию крови и появлению патологической кровоточивости уже в местах, удаленных от первичного повреждения.
Причины ДВС-синдрома достаточно многообразны:
1) инфекционные: бактериальный или грибковый сепсис, тяжелая вирусная инфекция (ВИЧ, цитомега-ловирусная пневмония, герпес, вирусный гепатит), малярия.
Основным пусковым механизмом ДВС-синдрома при тяжелой бактериальной инфекции служат специфические компоненты клеточной мембраны микроорганизмов (липо-полисахариды) или продуцируемые ими экзотоксины (стафилококковый α-токсин). Появление даже малого количества этих веществ в кровотоке приводит к бурной системной воспалительной реакции, в частности к массивному выбросу в кровь цитокинов. Некоторые из них (ИЛ-1, ИЛ-6 и ОНО) оказывают прямое прокоагулянтное, антикоа-гулянтное и антифибринолитичес-кое действие. Суммарный эффект в большинстве случаев драматичен: возникает генерализованное внутрисосудистое отложение фибрина, а
Схема 35.1
ПРИНЦИПИАЛЬНАЯ ПАТОГЕНЕТИЧЕСКАЯ СХЕМА ДВС-СИНДРОМА
[LEVI M., 1999]
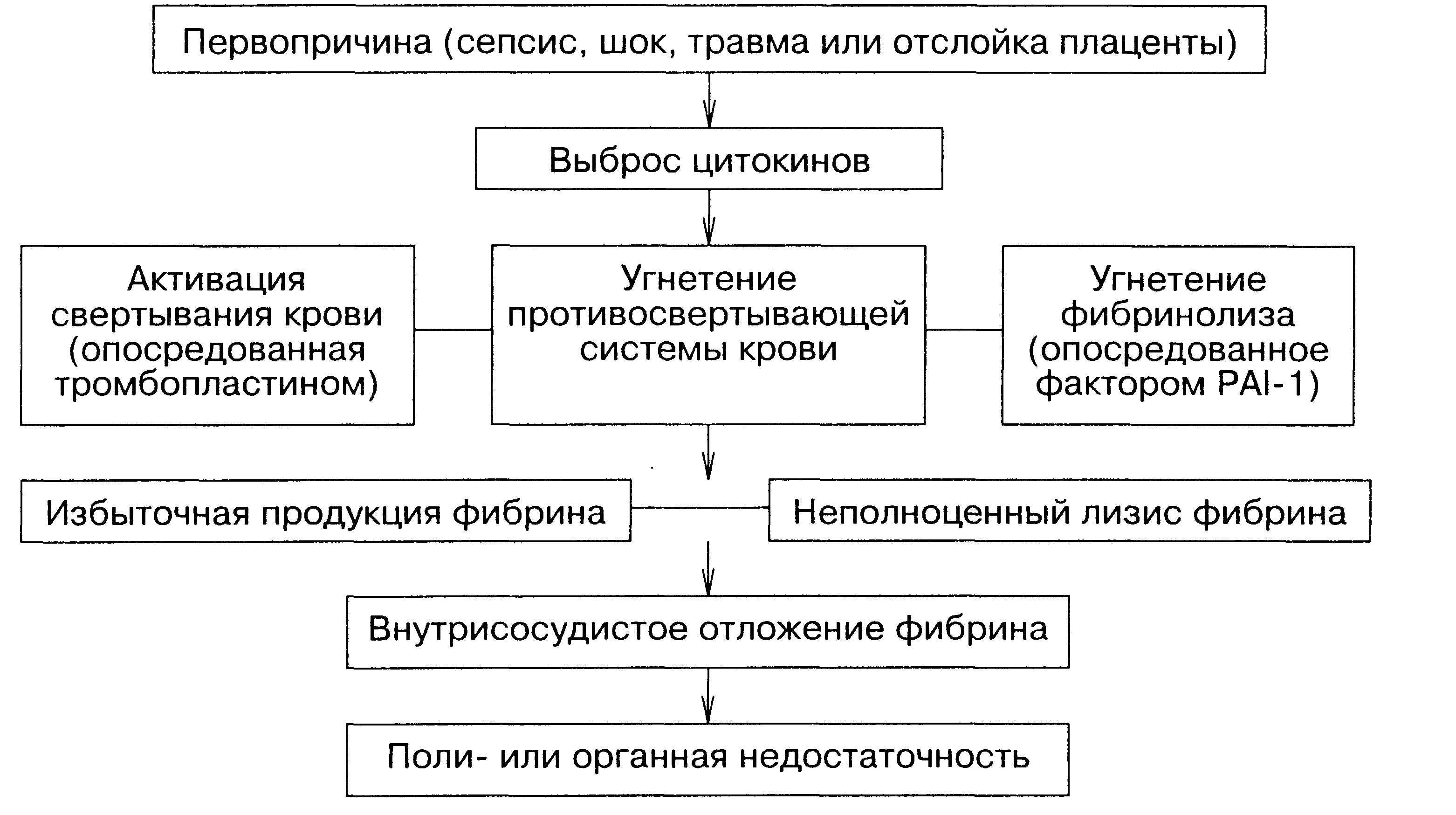
впоследствии полиорганная недостаточность (схема 35.1).
Клинически и лабораторно очевидный ДВС-синдром находят у 30—50 % больных с септическим шоком. При этом этиология шока (грамположительный или грамотри-цательный возбудитель) не отражается на частоте развития ДВС-син-дрома;
2) травматические: тяжелая черепно-мозговая травма, политравма, ожоги. Это вторая по распространенности причина ДВС-син-дрома, обязанная своим происхождением попаданию в системный кровоток разрушенного тканевого материала (тканевый и плазменный тромбопластин, жиры, фосфолипи-ды, продукты гемолиза и др.). Присущее этим веществам суммарное прокоагулянтное действие может превысить естественный антикоагу-лянтный потенциал крови. Неполноценности противосвертывающей и фибринолитической систем крови способствуют также цитокины, высвобождаемые в кровоток при тяже-
лой травме в рамках все той же системной воспалительной реакции.
Признаки ДВС-синдрома находят у 50—70 % больных с тяжелой травмой. Полагают, что присоединение коагулопатии увеличивает летальность при травмах по меньшей мере в 2 раза;
3) онкологические: гемобластозы (острый миелолейкоз), слизепроду-цирующая аденокарцинома поджелудочной или предстательной железы.
Механизм появления ДВС всего лишь у 15—20 % больных с подобной патологией не ясен. Большинство исследователей связывают развитие ДВС-синдрома в этих случаях с избыточной экспрессией тромбо-пластина на клеточной поверхности злокачественных клеток или избыточным внутриклеточным содержанием веществ с тромбопластинпо-добной активностью. Гибель опухолевых клеток (спонтанно или под влиянием химиотерапии) приводит к высвобождению этих веществ в системный кровоток;
4) акушерские: (пре- или эклампсия, отслойка плаценты, эмболия амниотической жидкостью.
ДВС-синдром при акушерской патологии обязан своим происхождением попаданию тромбопластин-подобного материала из плацентарной системы в кровеносное русло матери. Подобный вывод основан на многочисленных наблюдениях прямой корреляции степени отслойки плаценты с тяжестью сопутствующей коагулопатии. Показано in vitro наличие у амниотической жидкости выраженной прокоагу-лянтной активности;
5) трансфузионные: аппаратный гемолиз, массивные переливания донорской крови, реинфузия частично лизированной или инфицированной крови.
Клиническая картина. Сердечно-сосудистая система. Расстройства кровообращения аналогичны таковым при гиповолемии. Развиваются артериальная гипотен-зия, тахикардия, периферическая вазоконстрикция. Появляются признаки органной гипоперфузии (оли-гурия, нарушение сознания). В тяжелых случаях симптоматика соответствует типичному геморрагическому шоку. На клапанах сердца, в магистральных и мелких венозных стволах образуются тромбы. Возможны инсульты, инфаркты различной локализации.
Пищеварительная система. Возникают множественные язвы на слизистой оболочке на всем протяжении ЖКТ. Они чаще всего служат источником массивного кровотечения, угрожающего жизни. Накопление крови в просвете кишечника приводит к парезу, тяжелой интоксикации.
Урогениталъная система. Характерно повреждение почек — от легкой нефропатии до анурии. Именно этот орган проявляет наибольшую чувствительность к отложению фибрина в его микроциркуляторном русле. Если страдает только канал ь-
цевый аппарат почки (острый канал ьцевый некроз), то почечная недостаточность обычно носит обратимый характер. Если же повреждение распространяется и на клубочки (острый корковый некроз), ситуация становится инкурабельной.
Кожные покровы. Поражения кожи, как правило, обширны и представлены петехиями (элементы сыпи диаметром менее 3 мм). Иногда наблюдают «молниеносную пурпуру», когда в течение нескольких часов на обширных участках кожи появляются множественные экхи-мозы (элементы сыпи диаметром более 3 мм). Возможно развитие очагов кожного некроза и гангрены конечностей. Типичны также глубокие подкожные гематомы. Операционная рана, если таковая имеется, представляет собой дополнительный источник кровотечения.
Дыхательная система. Характерно поражение легких по типу РДСВ. Возможны рецидивирующая ТЭЛА, инфаркт-пневмония. Слизистая оболочка ТБД при контакте с брон-хоскопом или катетером для отсасывания мокроты обильно кровоточит. Типичны также спонтанные носовые кровотечения.
ЦНС. Наблюдают неспецифические нарушения сознания — от легкой оглушенности до комы. Очаговая неврологическая симптоматика, как правило, отсутствует.
Лабораторная диагностика. Данные лабораторных методов исследования служат лишь дополнением к клинической картине ДВС и ни в коем случае не заменяют ее. Следует помнить, что нет четко определенных, формализованных критериев диагноза ДВС и что оценка характера и тяжести нарушений свертывающей системы крови должна основываться на совокупности многочисленных лабораторных тестов (табл. 35.1):
1) определение D-димера — наиболее специфичный тест в отношении ДВС. D-димер представляет собой
Таблица 35.1. Лабораторная диагностика ДВС-синдрома [Merck, 1999]
|
Показатель |
Результат |
Причина |
|
Мазок периферической крови |
Фрагментированные эритроциты |
Рассечение эритроцитов фибриновы-ми нитями |
|
Содержание тромбоцитов |
Низкое (обычно менее 100,0-109/л) |
Потребление тромбоцитов |
|
Протромбиновое время (ПВ) F V / |
Удлинено |
Потребление II и IV факторов свертывания |
|
АЧТВ |
» |
Потребление II, V и VIII факторов свертывания |
|
ТромГиновое время (ТВ) |
» |
Низкое содержание II фактора свертывания и высокий уровень ПДФ |
|
Содержание фибриногена |
Низкое или высокое |
Потребление в процессе тромбообра-зования или выброс в острой фазе воспаления (травмы) |
|
Продукты деградации фибрина |
Нормальное или высокое |
Активный процесс вторичного фиб-ринолиза |
|
Креатинин крови Общий анализ мочи |
Повышен Изменен |
Внутрисосудистое отложение фибрина в органах-мишенях (почки) |
один из продуктов деградации фибрина, и его появление в кровотоке указывает на растворение уже состоявшегося тромба (вторичный фибринолиз). Тест проводят с помощью моноклональных антител и считают положительным при титре >1:40.
2) продукты деградации фибриногена (ПДФ) появляются в кровотоке вследствие естественной биотрансформации фибриногена — предшественника фибрина. Подобный процесс может протекать перманентно, независимо от распространенного тромбообразования/кровотечения.
Уровень ПДФ повышен у 85— 100 % больных с ДВС. Такое повышение, однако, неспецифично и не может служить убедительным основанием для постановки диагноза ДВС-синдрома.
3) уровень фибриногена в плазме крови обычно бывает ниже 150 мг/дл. Следует, однако, иметь в виду, что фибриноген относится к белкам «острой фазы», поэтому его содержание может оказаться повышенным на начальной стадии ДВС-
синдрома. У беременных и больных с печеночной недостаточностью из-за исходно высокого уровня фибриногена его последующее снижение также может оказаться не очевидным;
4) содержание тромбоцитов, как правило, уменьшается (ниже уровня 100,0-109/л). Уровень тромбоцитов менее 50,0-109/л при ДВС-синдроме считают критическим. В мазке периферической крови при микроскопии находят крупные тромбоциты и Фрагментированные эритроциты («шизоциты»). Функциональная активность тромбоцитов заведомо нарушена и не требует специального изучения. Подобная гематологическая картина получила еще название микроангиопатического гемолиза;
5) время свертывания (ТВ и ПВ), активированное частичное тромбо-пластиновое время (А ЧТВ) относят к категории недостоверных критериев ДВС-синдрома. Эти показатели отражают в основном активность потребления II фактора свертывания — протромбина. Подобная активность оказывается увеличенной
при широком круге критической патологии, она неспецифична для ДВС-синдрома.
ДВС — это динамический процесс. Фаза гиперкоагуляции сменяется фазой гипокоагуляции (вследствие истощения факторов свертывания и активации фибри-нолиза), а затем фазой органных повреждений. Гиперкоагуляция, как правило, кратковременна и в клинической практике малозаметна.
Дифференциальный диагноз ДВС-синдрома. Выделяют подострую и острую («массивную») формы ДВС-синдрома. Обе формы заболевания имеют злокачественное течение, с трудом поддаются лечению и потенциально опасны для жизни.
Для подострого ДВС-синдрома кровотечения не характерны. В его клинической картине преобладают тромботические и тромбоэмболичес-кие осложнения, вызванные системной гиперкоагуляцией: венозные тромбозы, тромботические вегетации на створках сердечных клапанов, артериальные эмболии. Типичные лабораторные находки — умеренная тромбоцитопения, нормальное ПВ и нормальное содержание фибриногена, несколько укороченное АЧТВ, повышение уровня ПДФ.
Напротив, при остром ДВС-син-дроме возникают многочисленные очаги кровотечения: в зоне оперативного вмешательства, местах венозной или артериальной пункции, на слизистой оболочке ЖКТ и мочеполовых путей. Диссеминирован-ное внутрисосудистое отложение фибрина приводит также к ишеми-ческому повреждению почек, кожных и слизистых покровов, ЦНС. Эти повреждения в конечном итоге формируют полиорганную недостаточность.
Среди лабораторных находок обращают на себя внимание выражен-
ная (порой критическая) тромбоцитопения, значительное удлинение ПВ и АЧТВ, крайне низкое содержание фибриногена, появление в кровотоке высокого титра D-димера и ПДФ. Дополнительные тесты выявляют дефицит свертывающих и противосвертывающих факторов (в особенности V и VIII факторов, антитромбина III). B стеклянной пробирке такая кровь формирует едва заметный сгусток или не сворачивается вовсе.
Следует помнить, что типичные для ДВС-синдрома признаки -- ги-покоагуляция и тромбоцитопгния могут наблюдаться при гемодилю-ции (как следствие восполнения массивной кровопотери). Дифференциальный диагноз в этой ситуации проводят по содержанию D-димера и реакции на свежезамороженную плазму. При дилюционной коа-гулопатии D-димер не образуется, а при введении 1—2 доз свежезамороженной плазмы кровотечение, как правило, останавливается.
При гемолитическом уремическом синдроме, тромботической тромбо-цитопенической пурпуре, злокачественной артериальной гипертензии, HELLP-синдроме, агрессивной химиотерапии опухолей картина периферической крови («микроангиопа-тический гемолиз») полностью повторяет таковую при ДВС-синдроме. И хотя патогенетический механизм этого гемолиза специфичен (речь идет о первичном повреждении сосудистого эндотелия с последующей массивной пристеночной адгезией и агрегацией тромбоцитов), отличить его от ДВС-синдрома по клиническим и лабораторным проявлениям крайне затруднительно.
При тяжелой печеночной патологии (например, молниеносном вирусном гепатите) также возникает коагулопатия, обусловленная дефицитом синтеза факторов свертывания. Наличие желтухи и спленоме-галии помогает отличить такую коа-гулопатию от ДВС-синдрома.
Лечение. Отсутствие убедительных данных об эффективности какого-либо лечебного алгоритма при ДВС-синдроме превращает его терапию в своего рода искусство балансирования на грани возможного и недопустимого. Рекомендации по лечению ДВС-синдрома большей частью неопределенны и противоречивы. Выбор тех или иных медикаментозных средств: компонентов крови, антикоагулянтов или анти-фибринолитиков — ограничен многочисленными условиями и противопоказаниями, поэтому оптимальная тактика лечения в каждом конкретном случае определяется по принципу ex juvantibus, под постоянным мониторингом клинических и лабораторных показателей.
Устранение первопричины — ключевое условие лечения ДВС-синдрома. Следует помнить, что критическая коагулопатия в принципе неразрешима до тех пор, пока действуют ее пусковые механизмы. В большинстве случаев специфическая терапия ДВС-синдрома направлена на поддержание жизненно важных функций организма на то время, которое необходимо для коррекции первичной патологии (с помощью антибиотиков, операции и др.)· При устранении первопричины ДВС-синдром должен разрешиться самостоятельно.
Переливание компонентов крови
при ДВС-синдроме показано в случае продолжающегося кровотечения и/или необходимости оперативного вмешательства. Лабораторные данные при этом служат основанием только для выбора объема заместительной терапии и контроля ее эффективности. Лабораторные признаки коагулопатии в отсутствие (или при прекращении) кровотечения являются нерациональным основанием для трансфузий, послед-
ствия которых в этом случае плохо прогнозируются.
При количестве тромбоцитов менее 50,0-109/л вводят тромбокон-центрат из расчета 1 доза/10 кг массы тела больного.
Тяжелая форма анемии (НЬ<8 г/ дл) служит показанием для переливания эритроцитной массы (предпочтительно отмытой). По опыту клинических наблюдений трансфузия одной дозы эритроцитной массы (при оставленном кровотечении) повышает содержание гемоглобина в среднем на 1 г/дл, а гема-токрита — на 3 %.
Необходимость в свежезамороженной плазме теоретически обоснована очевидным дефицитом плазменных факторов свертывания. Эффективной дозой плазмы считают 15 мл/кг массы тела. Необходимо поддерживать фибриноген на уровне 100—150 мг/дл, а содержание других плазменных факторов не ниже 50 % их нормы. Однако свежезамороженная плазма в отличие от донорских тромбоцитов и отмытых эритроцитов при ДВС-синдроме небезопасна. Ее введение, как показывает клинический опыт, может поддержать или усугубить существующую коагулопатию.
Антикоагулянты. Достоверных сведений о положительном или отрицательном влиянии антикоагулянтов на исход ДВС-синдрома нет. Соответственно регламент такой терапии точно не определен. Несмотря на то что антикоагулянты помогают некоторым больным, их назначение при ДВС-синдроме требует особой осторожности. При острой акушерской патологии и печеночной недостаточности следует отказаться от них вовсе. Гепарин также категорически противопоказан при ДВС-синдроме, развившемся на фоне черепно-мозговой травмы.
Введение гепарина целесообразно только при наличии в клинической картине ДВС-синдрома признаков
тромботического/ишемического поражения органов и тканей и не ранее 4—6 ч после начала этиотроп-ного лечения. Достаточным основанием для его назначения может послужить олигурия, сохраняющаяся, несмотря на стабилизацию АД и интенсивное восполнение внутрисосу-дистого объема. Гепарин показан также при молниеносной пурпуре, прогрессирующем цианозе и похолодании конечностей, заставляющем подозревать развитие гангрены. Кроме того, гепарин в комбинации с антифибринолитиком позволяет контролировать кровотечение и диссеминированное тромбообразо-вание при ДВС-синдроме онкологической природы — при раке предстательной железы, остром промие-лоцитарном лейкозе.
Предпочтительны «малые» дозы гепарина — по 500 ЕД/ч или 5— 10 ЕД/кг/ч в виде постоянной ин-фузии. В связи с тем что антикоагу-лянтный потенциал гепарина реализуется только в присутствии антитромбина III, каждые 2—3 ч необходимо вводить по 1—2 дозе свежезамороженной плазмы. На этом фоне доза препарата может быть увеличена до 750—1000 ЕД/ч. Адекватность и безопасность гепаринотерапии обычно контролируют по АЧТВ. Допустимо двукратное увеличение этого показателя.
Антифибринолитики, по общему мнению, противопоказаны при ДВС-синдроме, так как они повышают риск образования микротромбов и инфарктов. Тем не менее в ряде случаев, после того как все терапевтические возможности исчерпаны, а кровотечение продолжает-
ся, прибегают к антифибринолити-кам. Подобная мера отчаяния обязательно должна подкрепляться документальным свидетельством острого фибринолиза — повышенного уровня плазмина.
Нагрузочная доза аминокапроно-вой кислоты составляет 5—10 г, поддерживающая доза — 2—4 г/ч. Аминокапроновая кислота абсолютно противопоказана при желудочковой тахикардии, гипотензии и гипо-калиемии.
Ингибиторы протеаз (в частности, контрикал) рекомендуют вводить по 350 000—700 000 ЕД внутривенно однократно и по 150 000 ЕД каждые последующие 1—4 ч. Гемо-статический эффект таких мегадоз, однако, не подтвержден, и их применение ввиду чрезвычайно высокой стоимости препаратов представляется неоправданным.
Особенности ухода. Следует воздержаться от любых ин-вазивных манипуляций или заменить их альтернативными неинва-зивными. Так, оксигенацию и вентиляцию можно контролировать по пульсоксиметрии, а не по пробам артериальной крови. При неизбежности подобных процедур необходимо обеспечить их максимальную безопасность. Катетеризацию центральной вены лучше проводить под ультразвуковым контролем. Для продленной эндотрахеальной интубации предпочтительны трубки с манжеткой низкого давления. Местное применение сосудосуживающих средств (раствор адреналина 1:100 000) снизит риск геморрагических осложнений эндоскопической санации TБД.
Список литературы
Александров В.H., Бобринская И.Г., Зверев BA. и др. Значение градиента коллоидно-осмотического давления в диагностике и лечении отека легких у больных с инфарктом миокар-
да//Анест. и реаниматол. — 1982. — № 3. - С. 45-49.
Гутген X., Сиггард-Андерсен У. Кислотно-основное равновесие — современное состояние вопроса//Акту-
альные проблемы анестезиологии и реаниматологии. — Архангельск— Тромсё, 1995. — С. 113-116.
Копылов П.M. Гипофосфатемия у хирургических больных пожилого и старческого возраста и ее коррекция: ав-тореф. дис. канд. мед. наук. — M., 1998.
Лосев H.И., Воинов В.А. Физико-химический гомеостаз организма//В кн.: Госмеостаз/Под ред. П.Д. Горизон-това. — M.: Медицина, 1981. — С. 186.
Малышев В.Д. Интенсивная терапия острых водно-электролитных нарушений. — M.: Медицина, 1985. — С. 157.
Малышев В.Д., Андрюхин И.M., Копылов П.M., Сиротинская А.Ю. Гипофосфатемия: этиология, патогенез, клинические проявления и лечение (обзор)//Анест. и реаниматол. — 1995. - № 5. - С. 44-51.
Малышев В.Д., Андрюхин И.M., Бочаров BA. и др. Динамика показателей неорганического фосфора крови при операциях на органах желудочно-кишечного тракта//АН ест. и реаниматол. - 1998. - № 3. - С. 53-57.
Маневич А.З., Маркин CA., Залетов С.Ю., Маневич А.А. Значение коллоидно-осмотического давления для клинической анестезиологии и реаниматол огии//Анест. и реаниматол. — 1981. -№ 3. -С. 63.
MapUHO IJ. Интенсивная терапия: Пер. с англ. - M.: ГЭОТАР, 1998. -С. 415-424; 639.
Рут Г. Кислотно-щелочное состояние и электролитный баланс: Пер. с англ. — M.: Медицина, 1978.
Рябов Г.А. Критические состояния в хирургии. — M.: Медицина, 1979. — С. 260.
Рябов Г.А. Острый нефротический синдром (острая почечная недостаточ-ность)//В кн.: Синдромы критических состояний. — M.: Медицина, 1994. - С. 305-324.
Сиротинская А.Ю. Нарушения баланса фосфора на этапах хирургического лечения больных с абдоминальной патологией: автореф. дис. канд. мед. наук. — M., 1998.
Тарроу А.Б., Эриксон Дж.К. Теоретические и клинические основы анестезиологии: Пер. с англ. — M.: Медицина, 1977. - С. 436.
Хартиг В. Современная инфузионная
терапия и парентеральное питание: Пер. с англ. — M.: Медицина, 1982. -С. 231.
Энциклопедия клинических лабораторных тестов: Пер.с англ./Под ред. проф. Норберта У. Тица. — M.: JTa-бинформ, 1997. — С. 960.
Brandt K. R., Miles J. M. Relationship between severity of hyperglycemia and metabolic acidosis in diabetic ketoaci-dosis//Mayo Clin. Prog. — 1988. — Vol. 63. - P. 1071-1074.
Campbell C. H. The sever lactic acidosis of thiamine dediciency: Acute pernicious or fulminating beriberi//Lancet. — 1984. - Vol. 3. - P. 446-449.
Desai Т.К., Carlson R. W., Geheb M.A. Hy-pocalcemia and hypophosphatemia in acutely ill patients//Crit. Care Clin. —
1987. - Vol. 5. - P. 927-941. EHn RJ. Magnesium metabolism in health and disease//Disease-A-Month. —
1988. -Vol. 34. - P. 173.
Espinel C.H., Gregory A. W. Differential diagnosis of acute renal failure//Clin. Nephrol. - 1980. - Vol. 13. - P. 73.
Flaked G., Villarread D., Chapman D. Is hypokaliemia a cause of ventricular ar-rythmias?//J. Grit, illness. — 1986. — Vol. 1. - P. 66-74.
Janson C., Birnbaum G., Baker FJ. Hypo-phosphatemia//Ann. Ernerg. Vtd. — 1983. -Vol. 12. - P. 107-116.
Iseri L. T. Magnesium in coronary artery di-sease//Drugs. — 1984; 2S (Suppl. 1).— P. 151-160.
Javeheri S., Kazemi H. Metacolic alkalosis and hypoventilation in humans//Amer. Rev. Respir. Dis.— 1987.—Vol. 136.— P. 1011-1016.
Knochel J. P. Etiologies and management of potassium deficiency//Hosp. Pract. — 1987. - Vol. 22. - P. 153-162.
Kriesberg R.A. Acid-base and electrolyte disturbances in the alcogolic//In: Dellinger R. P. ed. The sucstence abuser. — Philadelphia: J.D. Lippin-cott, 1987. - P. 66-77.
Kriesberg R.A. Diabetic ketoacidosis: An update//Crit. Care Clin. — 1987. — Vol. 3. - P. 817-834.
Reinhart R.A. Magnesium metabo-lism//Arch. Intern. Med. — 1988. — Vol. 248. - P. 2415-2420.
Roberts W. Principles of fluid and electrolyt balance and imbalance//Fluid and blood component therapy in critically ill and injured. Contemporary issues
in Critical care Nursing. — 1981. — P. 79.
Roswell R. H. Severe hypercalcemia: Causes and specific therapy//J. Crit. Illness. — 1987. -Vol. 2. - P. 14-21.
Smith S. M., eng RHK, Buccini F. Use of D-lactic acid measurements in the diagnosis of bacterial infections//.!. Infect. Dis. - 1986. - Vol. 354. -P. 658-664.
Solomon R. The relationship between disorders of potassium and magnesium ho-meostasis//Semm. Nephrol.— 1987.— Vol. 7. - P. 253-262.
Steiner R. W. Interpreting the fractional excretion of sodium//Amer. J. Med. — 1984. - Vol. 77. - P. 699-702.
Yu G.C., Lee D. B. Clinical disorders of phosphorus metabolism//West J. Med. - 1987. - Vol. 147. - P. 564-576.
Williams M.E., Rosa R.M. Hyperkaliemia: Disorders of internal and external potassium balance//! Int. Care Med. — 1988. - Vol. 3. - P. 52-64.
Whang R. Magnesium deficiency: Patho-genesis, prevalense, and clinical impli-cations//Amer. J. Med. — 1987. — Vol. 82 (ЗА). - P. 24-29.
Zaioga G.P., Chernov B. Calcium metabolism. In: Endocrine aspects of acute ill-ness//Clinics in critical care medicine. — Vol. 5. — New York: Churchill Livingstone, 1985.
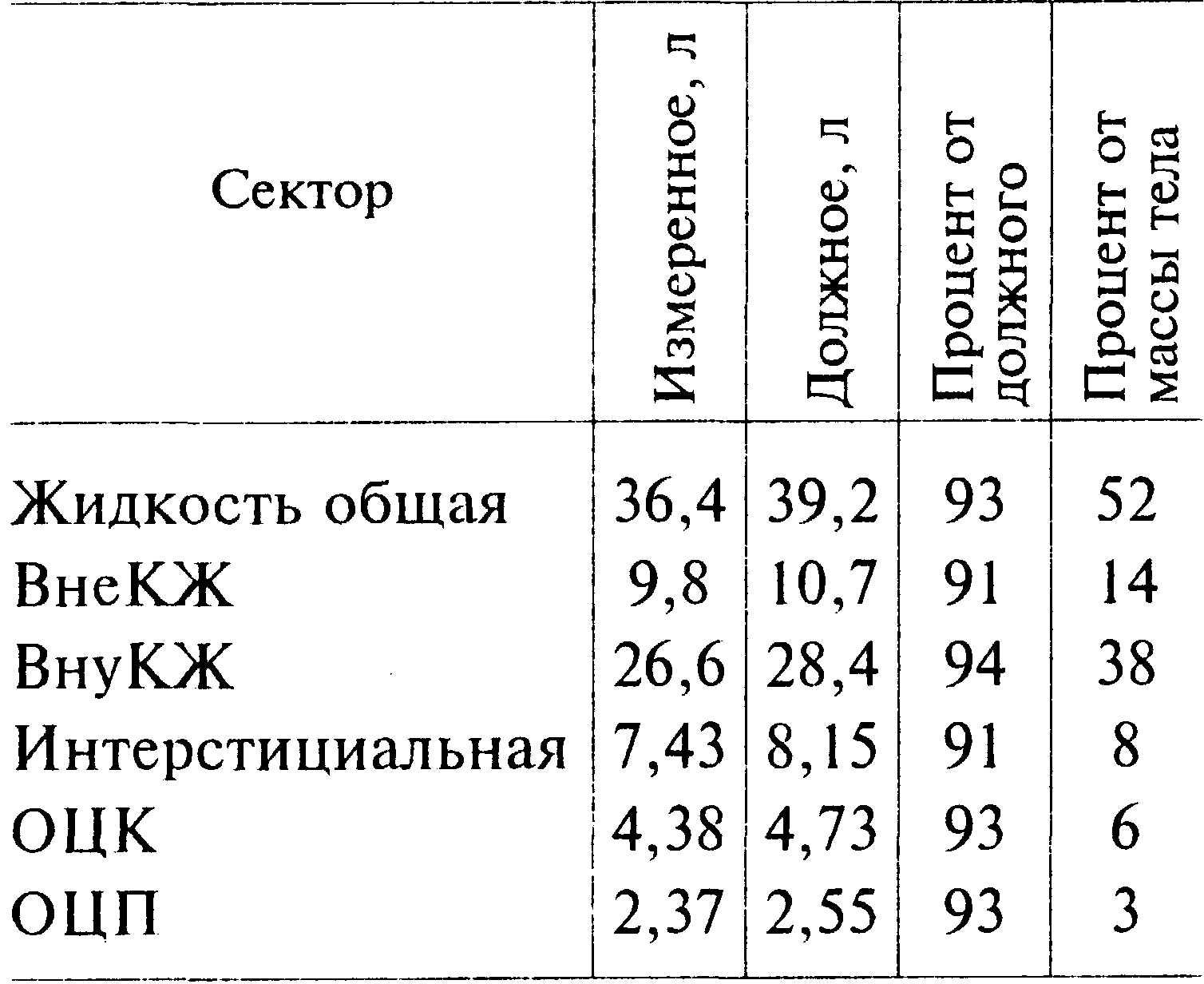
Таблица 36.1. Секторальное распределение жидкости
при необходимости осуществлять инотропную поддержку. Примером может служить следующее наблюдение.
Пациент M., 52 лет, рост 175 см, масса тела 70 кг. Параметры гемодина-мики: АД 123/83 мм рт.ст., ЧСС 63,8 уд/мин; MOC 5,8 л/мин; ОПСС 1338 5 дин-с/см5; УПСС 2618,1 дин-с/см -м2; ДНЛЖ 15,2 мм рт.ст.; СИ 2,9 л/мин-м2; УО 90,1 мл; ИУРЛЖ 63,7 г/м2; ИМРЛЖ 4,1 ктм/ мин/м ; А 800 кгм/мин.
Тип кровообращения нормокинети-ческий.
Из табл. 36.1 видно, что дефицит общей жидкости у больного равен 2,8 л; дефицит внутри- и внеклеточной жидкости незначительный. Объем восполнения жидкости равен 2,8л.
На основе приведенного выше примера можно сделать заключение, что имеющиеся дефициты жидкости могут быть устранены назначением в основном изотонических кристаллоидных растворов типа раствора Рингера и 5 % раствора глюкозы; при этом инотропной поддержки не требуется [Федоров С.В., 2001].
Во всех случаях шока, кровопоте-ри, травмы, тяжелых гемодинами-ческих нарушений основным критерием ИТТ является транспорт
кислорода, который определяется не только фактическим нормальным его уровнем, но иногда должен превосходить его (см. главы 3, 29). Инфузии растворов проводят с учетом имеющихся нарушений ге-модинамики, системы регуляции водного и электролитного обмена, в которой участвуют в первую очередь сердце и сосуды, почки, надпочечники, гипофиз и легкие. Эта регуляция нарушается при различных состояниях и заболеваниях, например при шоке, сердечной или почечной недостаточности, в послеоперационном периоде, при гастроинтести-нальных потерях, несбалансированном поступлении и выделении жидкости.
Важнейшие условия правильности инфузионной терапии — дозировка, скорость инфузии, состав растворов. Следует учитывать, что передозировка вводимой жидкости часто более опасна, чем некоторый ее дефицит. Инфузии растворов, как правило, проводят на фоне нарушенной системы регуляции водного баланса, поэтому быстрая коррекция водно-электролитного баланса часто невозможна и опасна. Выраженные нарушения водно-электролитного баланса и распределения инфузионных сред обычно требуют длительной (многочасовой, иногда многодневной) терапии. Особенное внимание при проведении ИТТ необходимо уделять больным с сердечной, легочной и почечной недостаточностью, пациентам пожилого и старческого возраста. Обязателен контроль клинического состояния, гемодинамики, дыхания, диуреза больного. Лучшие условия достигаются при мониторинге функции сердца, легких, мозга, почек. Чем тяжелее состояние пациента, тем чаще проводят лабораторные исследования и определение различных клинических показателей. Большое значение имеет ежедневное определение массы тела больного (весы-кровать).
Таблица 36.2. Потеря воды и электролитов в биологических жидкостях [по Randall]
|
Жидкость |
Средний объем потерь, мл/24 ч |
Концентрация электролитов, ммоль/л | |||
|
Na+ |
К-ь |
сг |
НС05 | ||
|
Плазма крови |
|
136-145 |
3,5-5,5 |
98-106 |
23-28 |
|
Желудочный сок |
2500 |
|
|
|
|
|
— содержащий HCl |
|
10-110 |
1-32 |
8-55 |
О |
|
— не содержащий HCl |
|
8-120 |
1-30 |
1000 |
20 |
|
Желчь |
700-1000 |
133-156 |
3,9-6,3 |
83-110 |
38 |
|
Панкреатический сок |
1000 |
113-153 |
2,6-7,4 |
54-95 |
110 |
|
Секрет тонкого кишечника |
3000 |
72-120 |
3,5-6,8 |
69-127 |
30 |
|
» илеостомы свежей |
100-4000 |
112-142 |
4,5-14 |
93-122 |
30 |
|
» » старой |
100-500 |
50 |
3 |
20 |
15-30 |
|
» цекостомы |
100-3000 |
48-116 |
11,1-28,3 |
35-70 |
15 |
|
Жидкая фракция фекалий |
100 |
10 |
10 |
15 |
15 |
|
Пот |
500-4000 |
30-70 |
0-5 |
30-70 |
° |
Показания к ИТТ могут быть экстренными:
• шок, обусловленный потерей значительного объема жидкости, острая гиповолемия;
• предоперационная подготовка при экстренных оперативных вмешательствах;
• интраоперационные возмещения потерь крови, плазмы и других жидкостей;
• послеоперационный период (окончательная коррекция всех предыдущих и продолжающихся потерь жидкости);
• тяжелая травма;
• сниженный венозный возврат (независимо от причин);
плановыми:
• предоперационная подготовка к плановой операции;
• обеспечение суточной потребности организма в воде и электролитах в тех случаях, когда невозможен или ограничен энтеральный путь усвоения жидкости и электролитов (в комбинации с ЭП или ПП).
Для составления общей программы ИТТ выявляют наличие секто-
ральных дефицитов жидкости методом импедансной волюметрии, оценивают параметры ЦГД, учитывают клинические признаки гиповоле-мии, определяют содержание важнейших электролитов в сыворотке крови, КОС, гематокрит, осмоляр-ность и КОД плазмы, уточняют противопоказания к назначению того или иного компонента лечения. Путем подбора растворов и добавления к ним электролитных концентратов создается основа для сбалансированной инфузионной терапии. Инфузионную терапию в процессе осуществления программы, как правило, корректируют. Продолжающиеся патологические потери должны быть адекватно возмещены. При этом объем и состав теряемых жидкостей (выделения из желудка и кишечника, по дренажам, диурез и т.д.) необходимо точно измерять и по возможности определять их состав. Если это не удается, нужно исходить из данных ионо-грамм и подбирать соответствующие растворы.
В табл. 36.2 представлен электролитный состав биологических жидкостей организма. Пользуясь этой
таблицей, выбирают необходимые инфузионные среды, соответствующие патологическим потерям. При очень тяжелых нарушениях необходимо проводить обширную коррекцию. Доля базисных растворов при этом оказывается небольшой. В этих случаях базисные растворы используют как дополнение к корригирующим.
ИТТ включает в себя базисную инфузионную терапию [Хартиг В., 1982], т.е. обеспечение физиологической потребности организма в воде и электролитах, и корригирующую инфузионную терапию, целью которой является коррекция имеющихся нарушений водно-электролитного баланса, в том числе концентрации белков и гемоглобина крови. Общий объем указанной терапии состоит из двух частей: 1) объема и состава инфузионных сред для базисного обеспечения; 2) объема и состава инфузионных сред для коррекции нарушений. Таким образом, суточный объем в зависимости от выявленных нарушений может быть большим или приравниваться только к физиологическим условиям поддержания баланса воды и электролитов.
