
- •Раздел I
- •Глава 1 Газообменная и негазообменные функции легких
- •Глава 2
- •Глава 3 Физиологические критерии транспорта кислорода
- •Раздел II
- •Глава 4 Клинические формы острой дыхательной недостаточности
- •Глава 5 Элементы респираторной терапии
- •5.1. Оксигенотерапия
- •5.2. Бронходилататоры
- •5.3. Антиоксиданты и антигипоксанты
- •5.4. Аэрозольная терапия
- •5.6. Стимуляторы дыхания
- •Глава 6 Респираторная поддержка
- •6.1. Физиологические аспекты ивл
- •6.2. Показания к ивл
- •6.3. Методы отмены ивл
- •6.4. Уход за больным во время ивл
- •6.5. Осложнения ивл
- •Глава 7 Механическая вентиляция легких
- •7.1. Режимы механической ив л
- •Глава 8 Респираторный мониторинг
- •8.1. Инвазивные методы оценки газообмена
- •8.2. Неинвазивный мониторинг газов крови
- •Глава 9 Острая обструкция дыхательных путей
- •9.1. Обструкция верхних дыхательных путей
- •9.2. Обструкция нижних дыхательных путей
- •9.3. Синдром Мендельсона
- •Глава 10 Астматический статус
- •Глава 11
- •Глава 12 Нозокомиальная пневмония
- •Глава 13 Респираторный дистресс-синдром взрослых
- •Глава 14
- •14.1. Неинвазивные методы восстановления проходимости дыхательных путей
- •14.2. Инвазивные методы восстановления проходимости дыхательных путей
- •14.3. Методы профилактики легочных осложнений
- •Раздел III
- •Глава 15 Острая сердечная недостаточность
- •15.1. Левожелудочковая недостаточность
- •15.2. Диастолическая дисфункция
- •15.3. Правожелудочковая недостаточность
- •15.4. Острый инфаркт миокарда
- •15.5. Кардиогенные причины внезапной смерти
- •Глава 16 Инвазивный мониторинг центральной гемодинамики
- •16.1. Катетеризация легочной артерии
- •16.2. Теория и практика заклинивания легочной артерии
- •16.3. Измерение сердечного выброса
- •16.4. Гемодинамический профиль
- •16.5. Клиническая интерпретация гемодинамического профиля
- •16.6. Осложнения катетеризации легочной артерии
- •Глава 17 Неинвазивный мониторинг центральной гемодинамики
- •17.1. Клинические аспекты неинвазивного гемодинамического мониторинга
- •Глава 18 Применение инотропных и вазоактивных препаратов
- •18.1. Фармакотерапия гемодинамических нарушений
- •18.2. Препараты с положительным инотропным действием
- •18.3. Вазодилататоры
- •18.4. Другие препараты, применяемые для лечения шока и сердечной недостаточности
- •Глава 19
- •19.1. Кардиоверсия
- •19.2. Электрическая стимуляция сердца
- •19.3. Некоторые препараты, применяемые при аритмиях
- •Глава 20 Отек легких
- •20.1. Кардиогенный отек легких
- •5. Применение препаратов положительного инотропного действия.
- •20.2. Отек легких при изменениях код
- •20.3. Отек легких при повышенной проницаемости сосудистой стенки
- •Глава 21 Тромбоэмболия легочной артерии
- •Глава 22 Гипертонический криз
- •22.1. Лекарственная терапия гипертонического криза
- •Глава 23
- •23.1. Анатомо-топографические основы сердечно-сосудистой системы
- •23.2. Методы инвазивных манипуляций
- •Раздел IV
- •Глава 24 Кардиогенный шок
- •Глава 25 Гиповолемический шок
- •Глава 26 Анафилактический шок
- •Раздел V
- •Глава 27
- •Глава 28 Интенсивная терапия септического синдрома
- •Глава 29 Септический шок
- •Раздел VI
- •Глава 30 Водно-электролитное равновесие
- •30.1. Водный баланс организма
- •30.2. Водные разделы организма
- •30.3. Осмолярность и код
- •30.4. Почечная регуляция водно-электролитного равновесия
- •30.5. Основная роль ионов
- •Глава 31 Дисбаланс жидкости и электролитов
- •31.1. Клинические и лабораторные признаки нарушений баланса воды и электролитов
- •31.2. Виды нарушений баланса воды и электролитов
- •31.3. Нарушение осмолярности (гипо- и гиперосмолярные состояния)
- •31.4. Нарушения код плазмы
- •31.5. Нарушения баланса электролитов
- •Глава 32 Кислотно-основное состояние
- •32.1. Буферные системы
- •Глава 33 Нарушения кислотно-основного состояния
- •33.1. Острый дыхательный ацидоз
- •33.2. Хронический дыхательный ацидоз
- •33.3. Острый дыхательный алкалоз
- •33.4. Хронический дыхательный ал! алоз
- •33.6. Лактат-ацидоз
- •33.8. Алкогольный кетоацидоз
- •33.9. Метаболический алкалоз
- •Глава 34 Острая почечная недостаточность
- •Глава 35
- •36.1. Базисная инфузионная терапия
- •36.2. Корригирующая инфузионная терапия
- •36.3. Пути введения инфузионных растворов
- •36.4. Интенсивная терапия осмолярных и объемных нарушений
- •36.5. Корригирующая терапия при метаболическом алкалозе
- •36.6. Корригирующая терапия при метаболическом ацидозе
- •36.7. Особенности инфузионной терапии у лиц пожилого возраста и больных с сопутствующими сердечно - сосудистыми заболеваниями
- •36.8. Осложнения инфузионной терапии
- •Глава 37 Инфузионные среды
- •37.1.1. Гетерогенные коллоидные растворы
- •37.1.2. Аутогенные коллоидные растворы
- •3 7.2.1. Замещающие растворы
- •37.6. Кровезаменители
- •Раздел VIII
- •Глава 38 Энтералыюе питание
- •38.1. Стандартизированные полимерные диеты
- •38.2. Энтеральное питание в предоперационном периоде
- •38.3. Энтеральное питание в послеоперационном периоде
- •38.4. Энтеральное питание у различных контингентов больных
- •Глава 39 Парентеральное питание
- •39.1. Энергетический баланс
- •39.2. Азотистый баланс
- •39.3. Потребность организма в белке
- •39.4. Источники энергии
- •39.5. Источники аминного азота. Аминокислотные смеси и белковые гидролизаты
- •39.6. Рациональные программы парентерального питания
- •39.7. Метаболические осложнения парентерального питания
- •Раздел IX
- •Глава 40
- •40.1. Предоперационный период
- •40.2. Операционный период (управление жидкостным балансом)
- •40.3. Послеоперационный период
- •40.4. Особенности инфузионной терапии при некоторых хирургических заболеваниях
- •40.4.1. Перитонит
- •40.4.2. Острый панкреатит
- •40.4.3. Кишечная непроходимость
- •Глава 41
- •41.1. Противомикробные средства для системного использования
- •41.2. Эмпирическая антибактериальная терапия
- •41.3. Этиотропная антибактериальная терапия
- •41.4. Селективная деконтаминация желудочно-кишечного тракта
- •41.5. Грибковая инфекция
- •Глава 42
- •42.1. Респираторные осложнения
- •42.2. Расстройства кровообращения
- •42.3. Взаимосвязь гемодинамических и респираторных нарушений
- •Глава 43 Послеоперационное обезболивание
- •43.1. Наркотические,
- •43.2. Неопиоидные анальгетики
- •43.3. Местные анестетики
- •43.4. Варианты
- •43.5. Принцип превентивной и непрерывной терапии боли в хирургии
- •Раздел X
- •Глава 44 Обморок. Делирий. Кома
- •44.1. Обморок
- •44.2. Эпилептические припадки
- •44.3. Спутанность сознания и делирий
- •44.4. Коматозные состояния
- •44.5. Алгоритм реанимационных мероприятий
- •44.6. Общая стратегия защиты головного мозга [по Фитч в., 1995]
- •Глава 45 Боль. Болевой синдром. Психологический стресс
- •45.1. Принципы обезболивающей терапии
- •II. Дифференцировка типа боли и выбор обезболивающей терапии
- •45.2. Психологический и эмоциональный стрессы
- •Глава 46
- •Раздел XI
- •Глава 47
- •47.1. Остановка кровообращения
- •47.2.1. Обеспечение проходимости дыхательных путей
- •47.2.4. Контроль за эффективностью сердечно-легочной реанимации
- •Глава 48 Остановка сердца в отделении интенсивной терапии
- •48.1. Фибрилляция желудочков
- •48.2. Желудочковая тахикардия
- •48.3. Асистолия
- •48.4. Электромеханическая диссоциация
- •48.5. Брадиаритмии
- •48.6. Медикаментозная терапия
- •48.7. Кислородотерапия во время сердечно-легочной реанимации
- •48.8. Электрическая дефибрилляция
- •48.9. Оживление с помощью прямого массажа сердца
- •48.10. Другие методы сердечно-легочной реанимации
- •48.11. Постреанимационный период
Глава 3 Физиологические критерии транспорта кислорода
Транспорт кислорода, т.е. доставка кислорода и потребление его тканями, — важнейший показатель систем жизнеобеспечения. Особенно актуальна эта проблема у больных, находящихся в критическом состоянии, когда механизмы транспорта кислорода значительно нару-
шены. Эти нарушения являются определяющими факторами летальности в ОРИТ.
У некоторых больных, особенно у септических, наблюдается повышенная потребность тканей в кислороде, что не всегда обеспечивается физиологическими возможностя-
ми кислородтранспортной системы. Нарушение соотношения доставки и потребления кислорода (DO2/VO2) сопровождается тканевой гипоксией и ведет к полиорганной недостаточности.
В норме в 100 мл артериальной крови содержится приблизительно 20 мл кислорода. Если MOC в норме в покое 5 л/мин, а потребление кислорода 250 мл/мин, то это значит, что ткани извлекают 50 мл кислорода из 1 л циркулирующей крови. При тяжелой физической нагрузке потребление кислорода тканями достигает 2500 мл/мин, a MOC возрастает до 20 л/мин, но и в этом случае остается неиспользованным кислородный резерв крови. Ткани забирают примерно 125 мл кислорода из 1 л циркулирующей крови. Содержание кислорода в артериальной крови 200 мл/л достаточно для обеспечения потребностей тканей в кислороде.
У больных в отделениях ОРИТ компенсаторные механизмы транспорта кислорода нарушены. Это относится как к сниженным резервам дыхания (гиповентиляция, снижение PaO2, SaO2), так и к циркуляторному компоненту транспорта кислорода — сниженному MOC в результате основного или сопутствующего заболевания, особенностям потребления кислорода тканями.
Факторы, нарушающие транспорт кислорода:
• низкое содержание кислорода в артериальной крови;
• низкий CB;
• анемия;
• расстройства сосудистой регуляции регионального и общего кровотока (вазоспазм, вазодилатация, системное поражение эндотелия с интерстициальным отеком);
• ДВС-синдром;
• периферические артериовенозные шунты;
• сдвиг кривой диссоциации оксигемоглобина (HbO2);
• патология внутриклеточных процессов (поражение митохондрий).
Гипоксическая гипоксия характеризуется снижением всех показателей кислородного уровня артериальной крови: парциального давления, насыщения и содержания кислорода. Ее основными причинами являются снижение и полное прекращение поступления кислорода (гиповентиляция, обструкция дыхательных путей, дыхание аноксической смесью, апноэ). При этом кислородный резерв истощается очень быстро: через 1—2 мин нарушается сознание, а через 4—6 мин наступает гипоксическая остановка сердца. К этому же виду гипоксии приводит изменение химических свойств гемоглобина (карбоксигемоглобин, метгемоглобин).
Тотальная гипоксемия обычно обусловлена удушьем или другими формами дыхательной недостаточности.
Циркуляторная гипоксия. Первичная циркуляторная гипоксия возникает вследствие снижения CB или сосудистой недостаточности, что ведет к уменьшению доставки кислорода к тканям. При этом кислородные параметры артериальной крови не изменены, однако PvO2 значительно снижено. Следует учитывать возможность региональной гипоксии при отсутствии или резком снижении циркуляции крови в отдельных частях тела.
Термином «ишемия» обозначается любое сокращение кровотока, достаточное для появления ее клинических симптомов. У больных, пребывающих в критическом состоянии, клинические симптомы ишемии могут указывать на нарушение функции различных органов, прежде всего головного мозга [Cottrell J.E., 1993].
Региональная ишемия, вызванная ишемией отдельных частей тела (например, конечностей, почечной и чревной области), чаще всего возникает при гиповолемическом шоке.
Тотальная ишемия, связанная с полным прекращением транспорта кислорода, чаще всего обусловлена остановкой кровообращения.
Анемическая гипоксия, обычно наблюдаемая при массивной кровопотере, нередко сочетается с циркуляторной недостаточностью. Концентрация гемоглобина — не абсолютно точный показатель этого вида гипоксии. Полагают, что при концентрации гемоглобина ниже 100 г/л возможны нарушения кислородтранспортной системы крови. Однако при изучении механизмов транспорта кислорода были отмечены его разные уровни у различных пациентов. Удовлетворительный уровень транспорта кислорода отмечался и у больных с уровнем гемоглобина в крови ниже 100 г/л. Все зависит от индивидуальных компенсаторных возможностей организма. Более точные данные можно получить при определении основных показателей транспорта кислорода. Для практического решения можно руководствоваться правилом, что уровень гематокрита, равный 0,25, является предельно допустимым. Уровни гемоглобина ниже 50 г/л, гематокрита ниже 0,20 представляют угрозу для жизни больного даже в случае, если MOC не снижен.
Главной отличительной чертой анемической гипоксии является снижение содержания кислорода в артериальной крови при нормальном PaO2 и SaO2.
Сочетание всех трех форм гипоксии — гипоксической, циркуляторной и анемической возможно в тех случаях, когда нарушение дыхания происходит на фоне сердечно-сосудистой недостаточности и анемии.
Гистотоксическая гипоксия характеризуется неспособностью тканей утилизировать кислород (например, при отравлении цианидами). У больных ОРИТ этот вид гипоксии изучен недостаточно. Его связывают с нарушениями внутриклеточных процессов и поражением митохондрий.
Все формы гипоксии (за исключением гистотоксической) одинаково вызывают венозную гипоксию, являющуюся достоверным показателем снижения PO2 в тканях. Парциальное давление кислорода в смешанной венозной крови — важный показатель гипоксии. Уровень PvO2, ниже 30 мм рт.ст., определен как критический [Рябов Г.А., 1988].
Значение кривой диссоциации OK-сигемоглобина. Кислород в крови присутствует в двух формах — физически растворенный и химически связанный с гемоглобином. Зависимость между PO2 и SO2 графически выражают в виде кривой диссоциации оксигемоглобина (КДО), имеющей S-образную форму. Такая форма КДО соответствует оптимальным условиям насыщения крови кислородом в легких и освобождения кислорода из крови в тканях. При PO2 100 мм рт.ст. в 100 мл воды растворено всего 0,3 мл кислорода. В альвеолах PO2 составляет около 100 мм рт.ст. В 1 л крови физически растворено 2,9 мл кислорода. Основная часть кислорода переносится в связанном с гемоглобином состоянии: 1 г гемоглобина, полностью насыщенного кислородом, связывает 1,34 мл последнего. Если концентрация гемоглобина в крови 150 г/л, то содержание химически связанного кислорода составляет 150 г/л-1,34 мл/г = =201 мл/л. Эта величина называется кислородной емкостью крови (KEK). Поскольку содержание кислорода в смешанной венозной крови (CvO2) 150 мл/л, то 1 л крови, проходящей через легкие, должен присоединить примерно 50 мл кислорода для превращения ее в артериальную. Соответственно 1 л крови, проходящей через ткани организма, оставляет в них 50 мл кислорода. Только около 3 мл кисло-
рода на 1 л крови переносится в растворенном состоянии (рис. 3.1).
Смещение КДО является важнейшим физиологическим механизмом, обеспечивающим транспорт кислорода в организме. Циркуляция крови из легких к тканям и из тканей к легким связана с изменениями, которые воздействуют на сродство кислорода к гемоглобину. На уровне тканей из-за снижения рН это сродство уменьшается (эффект Бора), а вследствие этого улучшается отдача кислорода. В крови легочных капилляров сродство гемоглобина к кислороду увеличивается из-за снижения PCO2 и возрастания рН по сравнению с аналогичными показателями венозной крови, что приводит к повышению насыщения артериальной крови кислородом.
В нормальных условиях 50 % SO2 достигается при PO2 около 27 мм рт.ст. Эта величина обозначается Р5о и характеризует в целом КДО. Возрастание P5O (например, до 30— 32 мм рт.ст.) соответствует смещению КДО вправо и свидетельствует о снижении взаимодействия гемоглобина и кислорода. При снижении P5O (до 25—20 мм рт.ст.) отмечается смещение КДО влево, что указывает на усиление сродства между гемоглобином и кислородом. Благодаря S-образной форме КДО при довольно значительном снижении фракционной концентрации кислорода во вдыхаемом воздухе (ВФК) до 0,15 вместо 0,21 перенос кислорода существенно не нарушается. При снижении PaO2 до 60 мм рт.ст. SaO2 снижается примерно до 90 % и цианоз при этом не возникает. Однако дальнейшее падение PaO2 сопровождается более быстрым падением SaO2 и содержания кислорода в артериальной крови. При падении PaO2 до 40 мм рт.ст. SaO2 снижается до 70 %, что соответствует содержанию PO2 и SO2 в смешанной венозной крови.
Вышеприведенные механизмы насыщения крови кислородом не
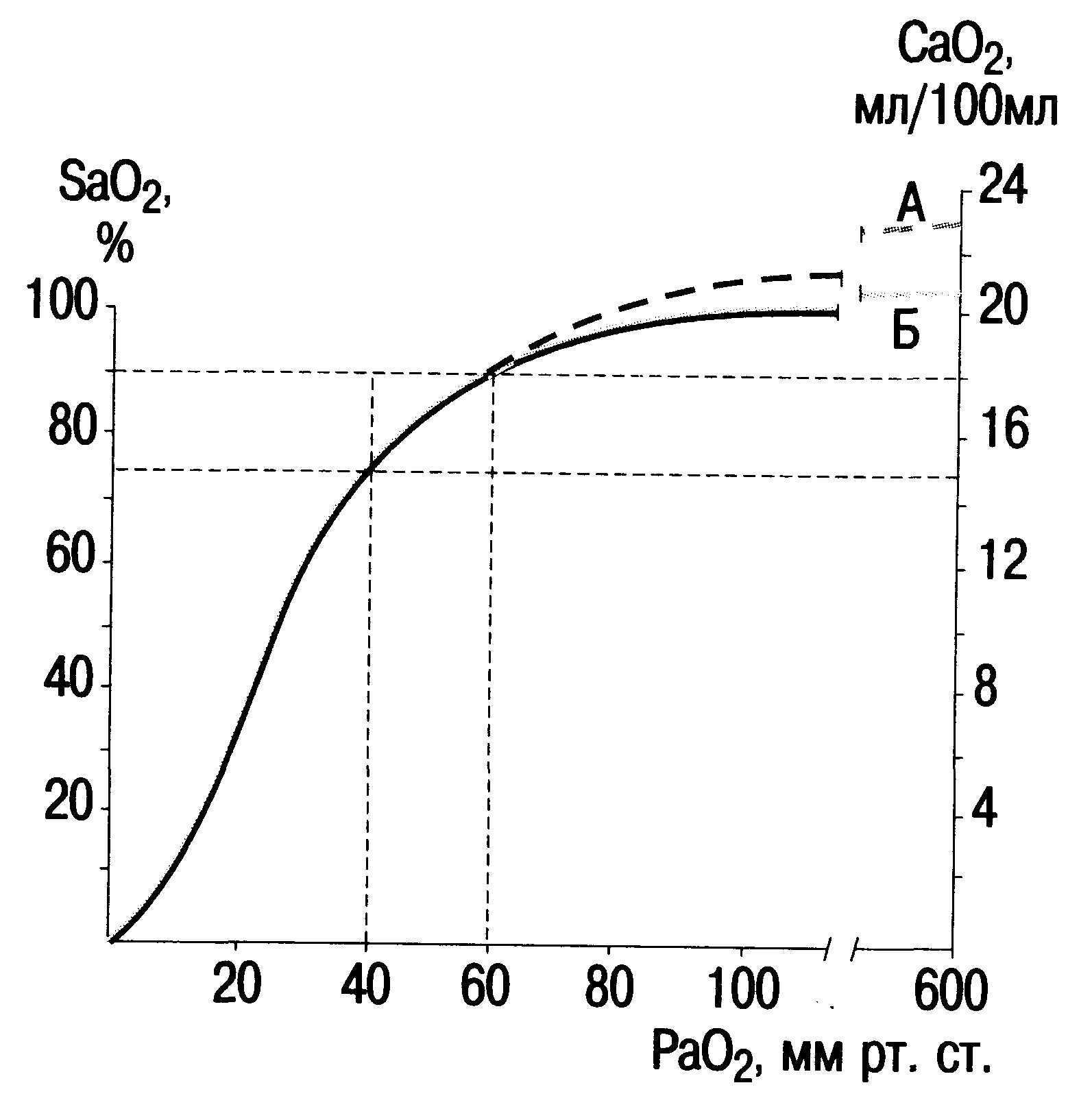
Рис. 3.1. Кривая диссоциации оксигемоглобина.
Верхняя пунктирная линия (А) соответствует общему содержанию кислорода в артериальной крови при рН 7,4, рСО2 = 40 мм рт.ст. и температуре 37 0C. Непрерывная кривая (Б) соответствует количеству кислорода, связанного с гемоглобином.
являются единственными. Внутриклеточный органический фосфат 2,3-дифосфоглицерат (2,3-ДФГ) входит в гемоглобиновую молекулу, изменяя ее сродство к кислороду. Повышение уровня 2,3-ДФГ в эритроцитах уменьшает сродство гемоглобина к кислороду, а понижение концентрации 2,3-ДФГ приводит к увеличению сродства к кислороду. Некоторые синдромы сопровождаются выраженными изменениями уровня 2,3-ДФГ. Например, при хронической гипоксии содержание 2,3-ДФГ в эритроцитах возрастает, и соответственно уменьшается сродство гемоглобина к кислороду, что дает преимущество в снабжении тканей кислородом. Массивные трансфузии консервированной крови могут ухудшить освобождение кислорода в тканях.
Таким образом, к факторам, обусловливающим возрастание сродства гемоглобина к кислороду и смещению КДО влево, относятся
увеличение рН (нередко вызываемое применением бикарбоната), уменьшение PCO2, концентрации 2,3-ДФГ и неорганического фосфата, снижение температуры тела. И наоборот, уменьшение рН, увеличение PCO2, концентраций 2,3-ДФГ и неорганического фосфата, повышение температуры тела приводят к уменьшению сродства гемоглобина к кислороду и смещению КДО вправо.
Следует помнить, что в условиях алкалоза доставка кислорода к тканям снижается. В связи с этим в последние годы отмечается пересмотр показаний для введения бикарбоната. Его применяют лишь при выраженном метаболическом ацидозе. Режим гипервентиляции при прочих равных условиях, очевидно, не способствует улучшению транспорта кислорода. Поддержание нормального уровня неорганического фосфата, обычно снижающегося в послеоперационном периоде и при парентеральном питании, — одно из важных условий кислородтранспортной функции крови.
Показатели кислородтранспортной функции крови. Кислород, связанный с гемоглобином в артериальной крови, определяется с учетом его реального уровня, насыщения артериальной крови кислородом (SaO2) и константы Гюфнера 1,34, указывающей на то, что 1 г гемоглобина при полном насыщении (SaO2=IOO %) связывает 1,39 мл кислорода:
1,34-Hb-SaO2.
Содержание кислорода в плазме крови в свободном (растворенном) состоянии:
0,003-PaO2.
Содержание кислорода в артериальной крови CaO2 — это объем кис-
лорода, связанного с гемоглобином и находящегося в растворенном состоянии:
CaO2 = 1,34-Hb (г/л)-8аО2 H- 0,003-PaO2.
Нетрудно заметить, что влияние величины PaO2 на содержание кислорода в артериальной крови несущественно. Гораздо более информативным в оценке транспорта кислорода является показатель SaO2.
Доставка кислорода к тканям (DO2) определяется двумя показателями — величиной CB (л/мин) и содержанием кислорода в артериальной крови CaO2:
DO2 = CB-CaO2.
Если пользоваться величиной СИ, а не MOC, то расчет транспорта кислорода следует производить по следующей формуле:
DO2 - СИ-(1,39-НЬ-8а02)-10,
где коэффициент 10 — фактор преобразования объемных процессов (мл/с).
В норме DO2 равен 520—720 мл/(мин-м2). Данная величина фактически является индексом DO2, поскольку рассчитана на 1 м2 поверхности тела.
Потребление кислорода тканями. Потребление кислорода тканями (VO2) является заключительным этапом его транспорта. Определение VO2 производится путем умножения величин CB на артериовенозную разницу по кислороду. При этом следует пользоваться абсолютными величинами не MOC, а СИ как более точного показателя. Показатель артериовенозной разницы определяется путем вычитания содержания кислорода в смешанной венозной крови (т.е. в легочной артерии) из содержания кислорода в артериальной крови:
VO2 = CM-(CaO2 - CvO2).
При нормальных значениях по СИ величина VO2 колеблется от 110 до 160 мл/(мин-м2).
Утилизация кислорода. Коэффициент утилизации кислорода (KYO2) является показателем поглощаемого кислорода из капиллярного русла. KYO2 определяют как отношение потребления кислорода к показателю его доставки:
KYO2 = Y (VDO2-IOO.
KYO2 может колебаться в широких пределах, в покое он равен 22— 32%.
Для суммарной оценки транспорта кислорода следует пользоваться и другими показателями.
Большое диагностическое значение придают величинам PvO2 и SvO2. В норме PvO2 в смешанной венозной крови составляет 33—53 мм рт.ст. Уровень PvO2 ниже 30 мм рт.ст. свидетельствует о критическом состоянии транспорта кислорода [Рябов Г.А., 1988]. Насыщение кислородом гемоглобина смешанной венозной крови у здорового человека равно 68—77 %. Заметим, что показатели SaO2 и SvO2 в оценке транспорта кислорода более значимы, чем PaO2 и PvO2. Само по себе PaO2 даже ниже 60 мм рт.ст., не свидетельствует о развитии анаэробного гликолиза. Все зависит от величины CB, концентрации гемоглобина и капиллярного кровотока. Важным показателем в оценке транспорта кислорода является уровень лактата сыворотки крови (норма О— 2 ммоль/л), особенно в сочетании с показателями рН, PCO2 и BE (избыток или дефицит оснований).
Зависимость потребления кислорода от его доставки. Эта проблема обсуждается много лет, но особое внимание специалистов по интенсивной терапии к этой проблеме проявляется в течение последних 20 лет. В некоторых работах было показано, что потребление кислорода при сепсисе и РДСВ повышалось
прямо пропорционально степени его доставки [Danek S. et al., 1980].
Это состояние S.M. Cain (1984) назвал «патологической зависимостью потребления от доставки кислорода» в отличие от тех случаев, когда потребление кислорода остается постоянным, несмотря на изменения его доставки («физиологическая зависимость потребления от доставки кислорода»).
В клинических наблюдениях 1980-х годов было подтверждено существование такой патологической зависимости [Haupt M.T. et al., 1985]. Отмечалось, что увеличение потребления кислорода от его доставки являлось неблагоприятным признаком. Больные с патологической зависимостью DO2/VO2 все умерли, в то время как пациенты с физиологическими нормами DO2/VO2 выжили [Biliary D. et al., 1987].
Очевидно, что патологическая зависимость потребления кислорода и тканевая гипоксия играют чрезвычайно важную роль в патогенезе полиорганной недостаточности и летальности при сепсисе и РДСВ.
Впоследствии было показано, что результаты лечения больных с высокой степенью хирургического риска при повышенных значениях DO2 и VO2 были значительно лучше, чем у пациентов с нормальными значениями CB и транспорта кислорода. Эти данные свидетельствовали о том, что повышенный уровень доставки кислорода должен предотвратить развитие тканевой гипоксии и полиорганной недостаточности [Shoemaker W.C., et al., 1988]. Однако доказательства этой гипотезы в отношении больных, находящихся в критическом состоянии, неубедительны. В более поздних исследованиях было показано, что результаты лечения больных с применяемой инотропной поддержкой при невозможности увеличения CB путем инфузий были хуже, чем в группе больных, которым проводилась традиционная терапия [Hayes M.A. et al., 1994].
Как утверждают некоторые авторы, «патологической зависимости потребления кислорода от его доставки» на самом деле нет. Полагают, что применяемые в клинике методы расчетов и термодилюцион-ный метод определения CB не могут считаться достаточными маркерами оценки соотношения доставки и потребления кислорода [Archiv J.Р., 1981].
Можно предположить, что в условиях гиповолемического и других видов шока не все ткани и органы одинаково снабжаются кислородом. При этом формальные данные о транспорте кислорода могут быть нормальными или мало отличаться от нормы. В экспериментах на животных были получены очевидные доказательства нарушения микроциркуляции и ухудшения экстракции кислорода при сепсисе. Было показано, что отдельные органы по сравнению с другими, в которых сохранен кровоток, могут в большей степени «страдать» от гипоксии. В отличие от достаточно резистентных скелетных мышц кишечник наиболее чувствителен к действию эндотоксина. На основании представленных данных в качестве маркеров транспорта кислорода стали использовать величину тканевого ρ Η и показатель уровня молочной кислоты в тканях. Было установлено, что у больных, находящихся в критическом состоянии, рН слизистой оболочки желудка был сниженным и тесно коррелировал с эффективностью лечения больных [Rademacer P. et al., 1993; Наппеmann L. et al., 1993].
В настоящее время имеются данные, подтверждающие то, что не во всех случаях стремление к очень высоким уровням доставки кислорода (например, путем длительной и даже чрезмерной стимуляции сердечно-сосудистой системы) является оправданным. Проведение такой
стимуляция нередко превышает физиологические резервы сердечнососудистой системы. У многих больных достижение необходимого уровня доставки кислорода можно обеспечить в первую очередь путем инфузий [Shoemaker W.C. et al., 1990]. Иногда в ответ на адекватно проведенную инфузионную терапию при сепсисе развивается гипердинамический ответ, что можно оценить как попытку организма компенсировать предшествующую недостаточную экстракцию кислорода тканями для удовлетворения высоких метаболических потребностей.
Известно, что без адекватной инфузионной коррекции животные с экспериментальным сепсисом быстро умирают от гиподинамического шока. Не отрицая значения инотропной поддержки, которая, по данным авторов, улучшала результаты лечения септических больных, отметим следующее. Больные, у которых удавалось установить CB более 5 л/мин-м2 как с помощью одной инфузионной терапии, так и за счет дополнительной инотропной поддержки добутамином, отличались более высокой выживаемостью по сравнению с больными, у которых, несмотря на все усилия достичь таких значений CB не удавалось [Martin C. et al., 1993]. По мнению К. Reinhart (1997), это не является доказательством повышения показателей доставки кислорода и потребления его тканями. У некоторых больных в связи с наличием заболеваний, несмотря на все усилия врачей, повышенные значения CB не были достигнуты и были хуже результаты. Автор полагает, что основной проблемой снабжения тканей кислородом у больного с сепсисом в критическом состоянии является нарушение трофической функции кровотока, особенно в кишечнике.
Зависимость потребления кислорода от его доставки на уровне целостного организма может наблюдаться у больных с исходной патологией сердечно-сосудистой системы и/или в результате недостаточно адекватной инфузионной терапии. В этих случаях, естественно, инотропная поддержка будет улучшать показатели доставки и потребления кислорода. Если же все механизмы исчерпаны и инфузионная терапия проведена в достаточном объеме, дополнительная стимуляция сердечно-сосудистой системы может оказать отрицательное воздействие. Местная тканевая гипоксия может сохраняться, несмотря на достижение оптимальных цифровых значений CB, доставки и потребления кислорода. Индивидуальные потребности больного в оптимальной доставке и потреблении кислорода могут находиться в очень широких пределах, часто не соответствующих выше приведенным «нормальным» величинам.
На основании сказанного можно сделать следующие выводы:
1) существуют большие методологические трудности в определении адекватной доставки и потребления кислорода тканями организма у больных ОРИТ. Общеизвестные показатели транспорта кислорода: CaO2, CB и расчетные величины доставки и потребления кислорода на уровне целостного организма у больных в критическом состоянии (септический синдром, респираторный дистресс-синдром взрослых, шок) не имеют большой клинической ценности, но тем не менее должны приниматься в расчет;
2) формализованные показатели транспорта кислорода, соответствующие нормальным физиологическим критериям здорового человека в покое, сами по себе могут не соответствовать состояниям повышенной или пониженной потребности тканей в кислороде. Потребность в кислороде больного, находящегося в критическом состоянии, может быть изменена вследствие колеба-
ний температуры тела, нарушений метаболизма и действия различных препаратов;
3) с учетом возможных регионарных, органных нарушений циркуляции (микроциркуляции, повреждения эндотелия сосудов, ишемии) полученные общие показатели транспорта кислорода, указывающие на норму, могут, тем не менее, не соответствовать истинным уровням доставки и потребления кислорода;
4) зависимость между доставкой кислорода и его потреблением тканями действительно существует, но у тех больных, которым инфузионная терапия была проведена в недостаточном объеме или из-за наличия у них ограниченных резервов сердечно-сосудистой системы. В этом случае целесообразно: а) провести инфузионную терапию для улучшения функции сердечно-сосудистой системы; б) если это окажется недостаточным, то провести соответствующую медикаментозную стимуляцию сердечно-сосудистой системы;
5) использование высоких доз адренергических препаратов для достижения высоких показателей доставки кислорода и тканевой оксигенации могут привести к ухудшению ситуации и увеличению летальности;
6) ухудшение экстракции кислорода тканями может происходить в различных органах. Установлено, что рН слизистой оболочки желудка при сепсисе является адекватным маркером транспорта кислорода, поскольку желудок и кишечник наиболее чувствительны к действию эндотоксина. При этом рН слизистой оболочки желудка снижается параллельно степени аноксии этого органа, в то время как содержание кислорода в мышечной ткани остается нормальным [Reinhart K. et al., 1994]. Повышение уровня молочной кислоты в тканях также свидетельствует о развитии тканевой гипоксии.
Список литературы
Белучиф С, Кермарре H., Пайе Д. Венозный возврат — терапевтическое значение: Пер. с англ.//Актуальные проблемы анестезиологии и реаниматологии. — Архангельск: Тромсе, 1997. - С. 48-50.
Гайтон А. Физиология кровообращения. Минутный объем сердца и его регуляция: Пер. с англ. — M.: Медицина, 1969. —472с.
Зильбер А.П. Дыхательная недостаточность. — M.: Медицина, 1989. — 512с.
Комро Дж. Г., Форстер Р.Э., Дюбуа А.Б. и др. Легкие. Клиническая физиология и функциональные пробы: Пер. с англ. — M.: Медгиз, 1961. — 196с.
Коттрелл Д. Новые достижения в ней-роанестезиологии//Актуальные проблемы анестезиологии и реаниматологии. — Архангельск, 1993. — С. 211-215.
Малышев В.Д. Острая дыхательная недостаточность.— M.: Медицина, 1989.— 236с.
Малышев В.Д. Внешнее дыхание и функции легких//Интенсивная терапия. Реанимация. Первая помощь. — M.: Медицина, 2000. — С. 11-20.
Марано П. Интенсивная терапия: Пер. с англ. - M.: ГЭОТАР, 1998. - 639 с.
Мартин К., Перрин Ж., Папазиан Д., Жоуи Ф. Коррекция гемодинамики при септическом шоке: Пер. с англ.//Актутальные проблемы анестезиологии и реаниматологии. — Архангельск, 1993. — С. 238—242.
Милик-Эмили Дж. Механика дыхания// Актуальные проблемы анестезиологии и реаниматологии: Пер. с англ. — Архангельск: Тромсе, 1997.- С. 203-206.
Рейнхард К. Зависимость потребления от доставки кислорода — миф или реальность? Пер. с нем /Актуальные проблемы анестезиологии и реаниматологии. — Архангельск: Тромсе, 1997. - С. 44-47.
Рябов Г.А. Синдромы критических состояний — M.: Медицина, 1994. — 288с.
Симбирцев С.А., Беляков Н.А. Микроэмболия легких. — Л., Медицина, 1986. - 216 с.
Скобельский В. Б. Негазообменные функции легких и роль их нарушений в развитии бронхолегочных осложнений//Анест. и реаниматол. — 1996.-№3.-С. 63-68.
Тарроу А.Б.у Эриксон Дж.К. Теоретические и клинические основы анестезиологии: Пер. с англ. — M.: Медицина, 1977. —439с.
Уэст Дж. Физиология дыхания. Основы. — M.: Мир, 1988. — 200 с.
Фекс П. (Foex P.). Анестезия и правый желудочек: Пер. с англ.//Актуальные проблемы анестезиологии и реаниматологии. — Архангельск, 1993. — С. 176-180.
Чучалин А. Г. Белая книга пульмонология. - M.: ГЭОТАР, 1999. - 47 с.
Чучалин А.Г., Апульцина И.Д. Простаг-ландины ha и E у больных бронхиальной астмой//Сов. мед. — 1983. — № 5. - С. 6-10.
Шик Л.Л. у Канаев H. H. Руководство по клинической физиологии дыхания. — Л.: Медицина, 1980. — 375 с.
Astiz M.E., Rackow E. С., FaIk J.L. et al. Oxygen delivery and consumption in patients with hyperdynamic septik shock//Critical Care Medicine. — 1987.-N 15.-P. 26-28.
Bihari D., Smithies M., GimsonA., Tinker J. The effects of vasodilation with pro-stacyclin on oxygen delivery and uptake in critically ill patients//New England Journal of Medicine. — 1987. — Vol. 317.-P. 397-403.
Cain S. M. Supply dependency of oxyden uptake in ARDS: myth or reality// Ainer. J. of Medical Science.— 1984.— Vol. 288. -P. 119-124.
Hannemann L, Meier-Hellmann A., Specht M. et al. O2-Angebot, O2-Verbrauch und Mukosa pH-Wert des Magens. In-dikatoren der Gewebeoxy-genierung//Anaesthesist. — 1993. — N 42. - P. 11-14.
Hayes M.A., Timmins A. C., Yau E.H.S. et al. Elevation of systemic delivery in the treatment of critically ill patients//New England J. of Medicine. — 1994. — Vol. 330. - P. 1717-1722.
Marini J.J., Wheeler A. P. Critical Care Medicine. — 1997. — 640 p.
Rademacher P., Buhl R., Santak B. Pro-stacyclin improves gastric intramucosal
pH in patients with septic shock// Clinical Intensive Care.— 1993.— N 4 (Suppl 2). - P. 7.
Reinhart K., Hannemann L., Meier-Hell-mann A., Specht M. Monitoring of O2 transport and tissue oxygenation in septic shock//Reinhart K., Eyrich K., Sprung Ch. (eds.)/Sepsis — current perspectives in pathophysiology and therapy. Update in Intensive Care and Emergency Medicine. — Vol. 18. — Berlin: Springer, 1994.
Shoemaker W. C., Appel P. L, Kram H. B. Prospective trial of supranormal values as therapeutic goals in high risk surgical patients//Chest. — 1988. — N 94. — P. 1176-1186.
Shoemaker W.C., Kram H.B., Appel P.L., Fleming A.W. The efficacy of central venous and pulmonary artery catheters and therapy based upon them in reducing mortality and morbidity//Arch. of Surg. - 1990. - Vol. 125. - P. 1332-1338.
