
- •Конспект лекцій з дисципліни «Біологія» для студентів і курсу денного відділення
- •Конспект лекцій з дисципліни «Біологія» для студентів і курсу денного відділення
- •5.03050901 «Бухгалтерський облік»
- •1. Вступ
- •Пояснювальна записка
- •Тематичний план тематичний план
- •Тематичний план
- •Тематичний план
- •Тематичний план
- •Тематичний план
- •Тема: Вступ. Основні властивості організмів
- •Розділ і. Молекулярний рівень організації життя
- •Тема 1. Неорганічні речовини
- •3. Молекулярний склад живих організмів.
- •4. Вода, її властивості та функції у клітині.
- •Властивості і функцієїї води
- •5. Солі неорганічних речовин.
- •Тема 2. Органічні речовини Тема: Органічні речовини живих організмів. Ліпіди. Вуглеводи
- •1. Загальна характеристика органічних речовин.
- •2. Структура, властивості та функції ліпідів.
- •3. Вуглеводи, їхня будова, властивості та функції.
- •Тема: Білки: будова, властивості, роль в життєдіяльності організмів
- •1. Білки, особливості будови.
- •2. Властивості білків.
- •4. Основні властивості ферментів.
- •Тема: Будова, властивості, функції нуклеїнових кислот та атф
- •1. Загальні уявлення про нуклеїнові кислоти.
- •3. Самоподвоєння днк.
- •Розділ іі. Клітинний рівень організації життя
- •Тема 1. Структура клітини і її компонентів Тема: Історія вивчення клітини. Загальний план будови клітин
- •1. Загальні уявлення про клітину.
- •2. Історія вивчення клітини.
- •IV. Сучасна клітинна теорія.
- •3. Методи цитологічних досліджень.
- •4. Прокаріотичні та еукаріотичні клітини. Загальний план будови клітин
- •5. Особливості будови, процесів життєдіяльності прокаріот.
- •Особливості будови клітин прокаріот
- •Особливості процесів життєдіяльності прокаріот
- •Тема: Клітинні мембрани. Поверхневий апарат клітини
- •Тема: Цитоплазма та її компоненти. Органели клітини
- •1. Цитоплазма та її компоненти.
- •2. Органели клітини: будова і функції.
- •Тема: Ядро. Будова і функції ядра клітин еукаріотів
- •1. Будова ядра.
- •2. Поняття про каріотип.
- •3. Функції ядра.
- •Тема 2. Клітина як цілісна система. Тканини Тема: Клітинний цикл еукаріотичних клітин. Мітоз
- •1. Поняття про клітинний цикл.
- •2. Основні способи поділу клітин.
- •Фази мітозу
- •4. Біологічне значення мітозу.
- •Тема: Мейоз
- •1. Поняття про мейоз.
- •2. Перший поділ мейозу.
- •3. Другий поділ мейозу.
- •4. Біологічне значення мейозу.
- •Тема: Обмін речовин та енергії. Енергетичний обмін
- •1. Групи організмів за типами живлення.
- •2. Загальна характеристика обміну речовин та енергії.
- •3. Аденозинтрифосфорна кислота та її роль у біоенергетичних процесах.
- •4. Енергетичний обмін та його етапи.
- •Тема: Пластичний обмін. Біосинтез білків
- •1. Біосинтез білків як один з основних процесів пластичного обміну.
- •2. Роль днк у синтезі білків. Код днк, його властивості.
- •3. Етапи біосинтезу білка.
- •Етапи біосинтезу білка:
- •IV. Утворення вторинної, третинної та четвертинної структур молекули білка.
- •Тема: Хемосинтез. Фотосинтез
- •1. Особливості обміну речовин та енергії у різних груп організмів. Автотрофна асиміляція
- •Гетеротрофна асиміляція
- •2. Хемосинтез.
- •Нітрифікуючи бактерії:
- •2. Фотосинтез.
- •Підсумкове рівняння процесу фотосинтезу:
- •3. Значення фотосинтезу для біосфери (самостійна робота з текстом).
- •Розділ ііі. Організмовий рівень організації життя
- •Тема 1. Неклітинні форми життя і одноклітинні організми Тема: Неклітинні форми життя
- •1. Відкриття вірусів.
- •2. Місце вірусів у системі органічного світу.
- •3. Особливості будови та процесів життєдіяльності вірусів.
- •4. Механізми проникнення вірусу до клітини-хазяїна.
- •5. Розмноження вірусів.
- •6. Роль вірусів у природі та житті людини.
- •Роль вірусів у природі та житті людини
- •1. Особливості будови клітин бактерій.
- •2. Особливості процесів життєдіяльності бактерій.
- •3. Особливості будови і процесів життєдіяльності ціанобактерій.
- •4. Роль бактерій і ціанобактерій у природі і житті людини.
- •Тема 2. Багатоклітинні організми Тема: Особливості організації і життєдіяльності багатоклітинних організмів
- •1. Будова і функції багатоклітинних організмів.
- •2. Органи багатоклітинних рослин і грибів, регуляція їхніх функцій.
- •4. Регуляція життєвих функцій організмів тварин.
- •Тема: Розмноження організмів.
- •1. Розмноження організмів, його форми.
- •2. Будова статевих клітин (гамет).
- •3. Гаметогенез.
- •Тема 3. Індивідуальний розвиток організмів і їх поведінка Тема: Запліднення. Онтогенез
- •1. Поняття про запліднення. Особливості запліднення у тварин і рослин
- •2. Онтогенез, його періоди.
- •3. Штучне запліднення.
- •Тема: Ембріогенез. Постембріональний розвиток
- •1. Ембріогенез.
- •2. Постембріональний розвиток тварин.
- •Тема: Механізм регенерації. Ріст організмів. Життєвий цикл у рослин і тварин
- •1. Регенерація організмів.
- •2. Ріст організмів.
- •4. Прості та складні життєві цикли рослин і тварин.
- •Тема 4. Закономірності спадковості і мінливості організмів Тема: Основні поняття генетики
- •1. Короткий екскурс в історію розвитку генетики.
- •2. Основні поняття генетики.
- •Тема: Закономірності спадковості. Закони г.Менделя. Моногібридне схрещування
- •1. Горох як модельний об'єкт. Гібридологічний метод вивчення спадковості.
- •2. Поняття про моногібридне схрещування. Явище домінування. Перший закон г. Менделя.
- •3. Неповне домінування.
- •4. Явище розщеплення. Другий закон г.Менделя.
- •5. Гіпотеза „чистоти гамет”. Цитологічні основи успадковування альтернативних ознак.
- •1. Експерименти г.Менделя з дигібридного схрещування. Закон незалежного успадковування.
- •2. Аналізуюче схрещування.
- •Тема: Зчеплене успадкування. Взаємодія генів
- •1. Зчеплене успадкування. Закон т.Моргана.
- •1) Повне зчеплення.
- •2) Неповне зчеплення.
- •Тема: Генетика статі
- •1. Хромосомне визначення статі.
- •2. Зчеплення зі статтю.
- •3. Особливості розв'язання задач на зчеплене зі статтю успадкування.
- •Тема: Закономірності мінливості. Комбінативна і мутаційна мінливість
- •1. Мінливість, її форми.
- •2. Спадкова мінливість, її види. Комбінативна мінливість.
- •3. Поняття про мутації. Вчення про мутації.
- •5) За рівнем зміни генетичного матеріалу.
- •5. Причини мутацій. Загальні властивості мутацій.
- •6. Значення мутацій у природі та житті людини.
- •7. Закон гомогологічних рядів спадкової мінливості.
- •Тема: Модифікаційна мінливість
- •3. Статистичні закономірності модифікаційної мінливості.
- •Тема 5. Генотип як цілісна система. Генетика в житті і діяльності людини Тема: Генетика людини і її значення для медицини й охорони здоров’я
- •1. Генетика людини.
- •2. Методи генетики людини.
- •3. Медико-генетичне консультування, його завдання.
- •Тема: Генетичні основи селекції організмів.
- •1. Поняття про селекцію та її завдання.
- •2. Поняття про сорт, породу, штам.
- •4. Гібридизація та її форми.
- •Розділ іv. Надорганізмові рівні організації життя
- •Тема 1. Організми і середовище. Популяції та екосистеми Тема: Предмет екології. Екологічні чинники
- •1. Предмет і завдання екології.
- •2. Екологічні фактори та їх класифікація.
- •3. Закономірності впливу екологічних факторів на живі організми.
- •Тема: Характеристика популяції
- •1. Екологічна характеристика виду.
- •2. Популяційна структура виду.
- •3. Популяційні хвилі. Регуляція чисельності популяцій. Поняття про гомеостаз популяцій
- •Тема: Екосистеми
- •1. Поняття про біоценоз.
- •2. Поняття про біогеоценоз та екосистему.
- •Структура біогеоценозу:
- •3. Перетворення енергії в біогеоценозах. Ланцюги живлення.
- •4. Правило екологічної піраміди. Види екологічних пірамід.
- •Тема 2 . Біосфера Тема: Загальна характеристика біосфери
- •1. Оболонки планети Земля.
- •2. Біосфера та її межі.
- •3. Вчення в.І. Вернадського про біосферу та ноосферу.
- •4. Жива речовина біосфери та її властивості.
- •5. Роль живих організмів у перетворенні оболонок Землі.
- •1) Роль живих організмів у створенні осадових порід.
- •2) Роль живих організмів у процесах ґрунтоутворення.
- •3) Вплив живих організмів на газовий склад атмосфери.
- •6. Колообіг речовин у біосфері.
- •Колообіг речовин у біосфері
- •1. Колообіг води.
- •2. Колообіг кисню.
- •3. Колообіг вуглецю.
- •4. Колообіг азоту.
- •Тема 1. Основи еволюційного вчення Тема: Розвиток еволюційних поглядів
- •1. Поняття про еволюцію.
- •2. Розвиток біології до хіх століття. Внесок к. Ліннея в розвиток біології.
- •3. Еволюційна гіпотеза ж.-б.Ламарка.
- •3.1. Філософські основи еволюційної концепції ж.-б.Ламарка.
- •3.2. Уявлення Ламарка про причини еволюції.
- •Тема: Синтетична гіпотеза еволюції
- •1. Внесок е. Геккеля у розвиток дарвінізму.
- •2. Дослідження різноманіття адаптацій.
- •3. Успіхи порівняльної анатомії.
- •4. Криза дарвінізму на початку XX сторіччя.
- •Криза дарвінізму на початку XX сторіччя
- •5. Синтетична гіпотеза еволюції.
- •Тема: Мікроеволюція. Видоутворення, його типи
- •1. Популяція як елементарна одиниця еволюції.
- •2. Мутації – єдине джерело спадкової мінливості.
- •3. Елементарні фактори еволюції: дрейф генів, популяційні волни, ізоляція.
- •Дослід с.Райта:
- •4. Природний добір – рушійна сила еволюції.
- •5. Поняття про мікроеволюцію.
- •6. Вид, його критерії.
- •7. Видоутворення, його типи.
- •Тема: Макроеволюція
- •1. Поняття про макроеволюцію.
- •2. Біологічний прогрес і регрес.
- •3. Морфологічні шляхи досягнення біологічного прогресу.
- •3. Додатки
- •Короткий нарис історії розвитку біології
- •IV. Період епохи Відродження
- •V. Період Нового часу
3. Вуглеводи, їхня будова, властивості та функції.
Вуглеводи - сполуки карбону та води і відповідають формулі (СН2О)n, де n дорівнює 3 або більше.
Вуглеводи поділяють на три основні класи.
Моносахариди, або прості цукри, мають загальну формулу СnН2nОn. За кількістю атомів вуглецю їх поділяють на тріози (3 атоми), тетрози (4), пентози (5), гексози (6) і так далі до декоз (10).
Олігосахариди - полімерні вуглеводи, в яких моносахаридні ланки з'єднані ковалентним зв'язком. Серед олігосахаридів найпоширеніші дисахариди, які утворюються завдяки сполученню двох молекул моносахаридів.
Моносахариди, олігосахариди розчиняються у воді і мають солодкий смак.
Полісахариди - біомолекули з високим ступенем полімеризації. Молекулярна маса деяких із них може досягати кількох мільйонів. Полісахариди відрізняються один від одного не тільки складом мономерів, а й довжиною та ступенем розгалуженості ланцюгів.
Полісахариди майже не розчиняються у воді і не мають солодкого смаку.
Функції вуглеводів:
1) Енергетична (при розщепленні 1 г вивільняється 17,2 кДж енергії).
2) Будівельна, або структурна (компонент клітинних мембран).
3) Опорна (хітин є компонентом зовнішнього скелета членистоногих та клітинних стінок деяких грибів і водоростей, а також целюлоза є компонентом клітинних стінок у рослин).
4) Запасаюча (крохмаль у рослин, глікоген у тварин).
Тема: Білки: будова, властивості, роль в життєдіяльності організмів
1. Білки, особливості будови.
Білки - це високомолекулярні полімери, мономерами яких є амінокислоти.
Кожний конкретний білок характеризується постійним складом амінокислот та їхньою певною послідовністю. До складу білків живих організмів входять 20 амінокислот, які називають основними.
Амінокислоти поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватись в організмі людини і тварини з продуктів обміну речовин. Незамінні амінокислоти не можуть синтезуватись в організмі людини і тварини і повинні надходити з їжею.
Усі амінокислоти мають спільну групу атомів: з атому гідрогену, аміногрупи (—NH2), для якої характерні лужні властивості, карбоксильної групи (—СООН) з кислотними властивостями, які зв'язані з одним і тим самим атомом карбону. Амінокислоти відрізняються одна від одної радикалами (R).
 R
R
 H
C
NH2
H
C
NH2

COOH
Амінокислоти сполучаються між собою ковалентним (пептидним) зв'язком. Завдяки таким міцним зв'язкам утворюються пептиди. Механізм з'єднання амінокислоти (гліцин) з такою ж амінокислотою (гліцин):
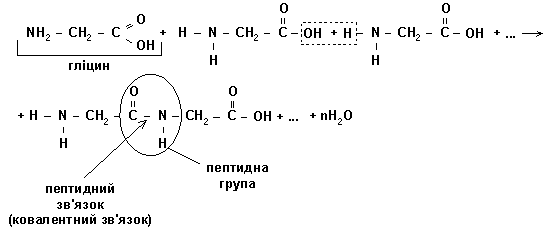
Існують чотири рівні структурної організації білків: первинна, вторинна, третинна,четвертинна структури (дивись дотаток 3).
Структура білка |
Просторова конфігурація |
Первинна структура |
Поліпептидний ланцюг, в якому залишки амінокислот сполучаються за допомогою пептидних зв'язків.
|
Вторинна структура |
Поліпептидний ланцюг, який закручується у спіраль. Підтримується здебільшого водневими зв'язками.
|
Третинна структура |
Поліпептидна спіраль закручується певним чином, утворюючи специфічну для кожного білка конфігурацію. Підтримується гідрофобними, іонними, водневими, дисульфідними зв'язками.
|
Четвертинна структура |
Об'єднання декількох молекул, які мають третинну структуру, в єдине функціональне утворення. Визначається гідрофобними, електростатичними взаємодіями, водневими зв'язками. |
