
- •Раздел II. Молекулярная физика
- •Глава1. Некоторые понятия молекулярной физики
- •§1 Массы атомов и молекул. Молярная масса
- •§2. Молекулярные силы
- •§3. Агрегатные состояния вещества. Особенности теплового движения в различных агрегатных состояниях вещества
- •§4. Равновесные процессы
- •Глава 2. Оcновы статической теории идеального газа
- •§1. Модель идеального газа
- •§2. Основное уравнение кинетической теории газов для давления
- •§3. Температура и её измерение. Опытные температурные шкалы.
- •2. Измерение давления газа при постоянном объёме производится с большей точностью, чем измерение объёма при постоянном давлении.
- •§4. Температура ― мера средней кинетической энергии поступательного движения молекул.
- •§5 Уравнение Менделеева-Клапейрона. Следствие из этого уравнения.
- •§6. Распределение Максвелла.
- •§7. Свойства распределения Максвелла.
- •§8. Распределение Больцмана. Барометрическая формула.
- •§ 9. Число степеней свободы молекул. Теорема о равномерном распределении энергии теплового движения по степеням свободы.
- •Глава 3. Основы термодинамики
- •§1. Внутренняя энергия, работа, теплота
- •§2. Первое начало термодинамики
- •§3. Теплоёмкость. Вычисление теплоёмкости идеального газа
- •§4. Изотермический процесс. Работа идеального газа при изотермическом изменении его объема
- •§5. Адиабатический процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •§6. Круговые обратимые процессы (циклы). Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу. Тепловые и холодильные машины
- •§7. Недостаточность первого начала термодинамики для однозначного описания процессов, происходящих в природе.
- •§8. Второе начало термодинамики. Формулировка основного постулата, выражающего второе начало термодинамики. Постулаты Кельвина и Клаузиуса и их эквивалентность
- •§9 . Цикл Карно и его кпд
- •§10. Математическое выражение второго начала термодинамики для обратимых процессов. Равенство Клаузиуса. Энтропия. Постоянство энтропии при обратимых процессах в замкнутой системе
- •§11. Основное уравнение термодинамики для обратимых процессов. Вычисление энтропии идеального газа.
- •§12. Второе начало термодинамики для необратимых процессов. Неравенство Клаузиуса. Возрастание энтропии при необратимых процессах в замкнутой системе. Общая формулировка второго начала термодинамики
- •§13. Примеры. Вычисление изменения энтропии при необратимых процессах
- •§14. Закон возрастания энтропии и превращение теплоты в работу
- •Глава 4. Реальные газы
- •§1. Экспериментальные изотермы. Область двухфазных состояний. Критическое состояние вещества
- •§2. Фазовая диаграмма жидкость-газ или кривая равновесия фаз
- •§З. Уравнение Ван-дер-Ваальса
- •§4. Изотермы Ван-дер-Ваальса и их сравнение с экспериментальными изотермами. Пересыщенный пар и перегретая жидкость
- •§5. Внутренняя энергия газа Ван-дер-Ваальса. Изотермическое расширение газа Ван-дер-Ваальса. Адиабатическое расширение газа Ван-дер-Ваальса в пустоту.
- •Глава 5. Столкновения молекул и явления переноса в газах
- •§1. Среднее число столкновений и средняя длина свободного пробега молекул
- •§2 Виды явлений переноса. Общее уравнение явлений переноса в газах
- •§3. Теплопроводность
- •§4. Вязкость
- •§5. Диффузия в газах
- •С точки зрения молекулярно кинетической теории за переносимую величину нужно взять концентрацию компоненты , рассчитанную на одну молекулу, т.Е.
- •Глава6. Твердые тела
- •§1. Аморфное и кристаллическое состояние вещества
- •§2. Классификация кристаллов по типу молекул, составляющих кристалл
- •§3. Анизотропия кристаллов
- •§4. Теплоемкость атомных кристаллов
- •Приложение а. Основные понятия теории вероятностей
- •§1. Понятие вероятности события
- •§2. Простейшие теоремы теории вероятностей
- •§3. Интегральная функция распределения случайной величины
- •§4. Плотность вероятности
- •§5. Среднее значение
§6. Распределение Максвелла.
В газе, находящимся в равновесии при температуре Т, скорость каждой отдельно взятой молекулы из-за столкновений непрерывно изменяется как по своему значению, так и по направлению. Поскольку в состоянии равновесия все направления движения молекул газа равновероятны, то распределения молекул по направлениям движения равномерно.
Иначе обстоит дело с абсолютными значениями скоростей молекул: они не будут равновероятны. Однако установившееся распределение молекул по значениям скорости не нарушается вследствие молекулярного движения и столкновений, т.е. оно не зависит от времени. Это значит, что непрерывное перераспределение скоростей между молекулами происходит так, что число молекул, обладающих значениями скорости, заключёнными в любом интервале [υ1, υ2], все время остается постоянным. И это подтверждает опыт.
Пусть газ находится в равновесии при температуре Т и имеет N молекул массы m0 каждая. Тогда число молекул dN, скорости которых имеют значения от υ до υ+dυ (т.е. заключены внутри интервала dυ, лежащего возле точки υ), очевидно, пропорционально общему числу молекул N в газе, величине интервала d, а также будет зависеть от самого значения скорости υ (последнее следует из неравномерного распределения абсолютных значений скорости), т. е.
(64) |
где F(υ) ― функция, характеризующая распределение молекул по скоростям.
Равенство (64) можно переписать в виде:
(65) |
В левой части равенства (65) стоит величина равная вероятности того, что «взятая наугад» молекула будет иметь скорость заключенную в интервале [υ, υ+dυ] (см. приложение А)
(66) |
Если проинтегрировать (66) по всем возможным скоростям (значения скоростей будем предполагать изменяющиеся от 0 до ∞), то получим, согласно условию нормировки вероятности (см. приложение А),
(67) |
которое физически означает, что «взятая наугад» молекула имеет какую-то скорость с вероятностью равной единице, т.е. достоверно.
Из (67) и (66) следует, что
(68) |
Можно показать, что функция распределения по скоростям F(V) имеет вид:
(69) |
Функцию F(υ) называют распределением Максвелла по абсолютным значениям скоростей молекул.
§7. Свойства распределения Максвелла.
На рис.4 представлен график функции F(υ). Как видно из рисунка, функция F(υ) имеет асимметричный вид относительно её максимальной ординаты.
Вероятность того, что величина скорости молекулы заключена в приделах от υ1, до υ2 (см. приложение А)
(70) |

и изображается горизонтально заштрихованной площадью. Вероятность того, что скорость молекула превышает некоторое значение υ0,
(71) |
и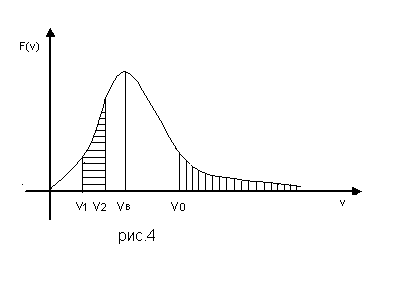 на графике изображается вертикально
заштрихованной площадью. Вся площадь
под кривой и осью υ
равна единице. Это следует из соотношения
(68). Из графика F(υ)
также видно, что доля молекул в газе,
обладающих малыми скоростями, так же
как и доля молекул, обладающая очень
большими скоростями мала. Наибольшая
часть молекул обладает скоростями,
близкими к скорости, соответствующей
максимуму функции F(υ).
Эта скорость υВ
называется
наиболее вероятной. Дифференцируя (69)
по υ
и приравнивая
полученное выражение к нулю, находим
выражение для вероятной скорости.
на графике изображается вертикально
заштрихованной площадью. Вся площадь
под кривой и осью υ
равна единице. Это следует из соотношения
(68). Из графика F(υ)
также видно, что доля молекул в газе,
обладающих малыми скоростями, так же
как и доля молекул, обладающая очень
большими скоростями мала. Наибольшая
часть молекул обладает скоростями,
близкими к скорости, соответствующей
максимуму функции F(υ).
Эта скорость υВ
называется
наиболее вероятной. Дифференцируя (69)
по υ
и приравнивая
полученное выражение к нулю, находим
выражение для вероятной скорости.
(72) |
Подставляя это значение скорости в (69), находим значение максимальной ординаты функции F(υ)
(73) |
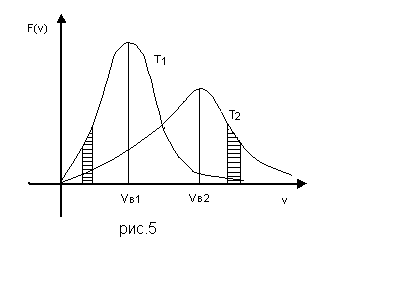
Из (72) и (73) следует, что при увеличении температуры максимум кривой F(υ) смещается в сторону больших скоростей и становится ниже, причём площадь под кривой остаётся неизменной и равной единице. Кривые распределения молекул одного и того же газа по скоростям при различных температурах имеют, поэтому вид, представленный на рис.5 (Т1<Т2).
Из рис.5 видно, чем больше температура газа, тем выше идёт правая ветвь кривой и тем ниже опускается её левая ветвь. Это означает, что с повышением температуры увеличивается доля молекул с большими скоростями и уменьшается доля молекул с малыми скоростями.
И з
формулы (69) для функции F(υ),
а также (72) и (73) видно, что F(υ)
зависит также от природы газа, т.е. от
массы его молекул m0.
Для разных газов при одной и той же
температуре кривая распределения
оказывается различной, причем, чем
больше масса молекул, тем υв
меньше, а Fmax
больше и, следовательно, тем более крутой
имеет вид кривая F(υ).
Кривая F(υ),
соответствующая одной и той же температуре
Т,
но разным массам молекул m01
и m02
(m01
> m02)
приведены на рис.6. Как видно, при одной
и той же температуре у тяжёлого газа
малые скорости встречаются чаще, а
большие ― реже, чем у газа, состоящего
из лёгких молекул.
з
формулы (69) для функции F(υ),
а также (72) и (73) видно, что F(υ)
зависит также от природы газа, т.е. от
массы его молекул m0.
Для разных газов при одной и той же
температуре кривая распределения
оказывается различной, причем, чем
больше масса молекул, тем υв
меньше, а Fmax
больше и, следовательно, тем более крутой
имеет вид кривая F(υ).
Кривая F(υ),
соответствующая одной и той же температуре
Т,
но разным массам молекул m01
и m02
(m01
> m02)
приведены на рис.6. Как видно, при одной
и той же температуре у тяжёлого газа
малые скорости встречаются чаще, а
большие ― реже, чем у газа, состоящего
из лёгких молекул.
Зная функцию F(υ), можно вычислить важные для молекулярной физики величины: среднюю скорость и среднюю квадратичную скорость молекул газа. Согласно формулам вычисления средних (см. приложение А)
(74) |
(75 ) |
Подставляя в формулы (74) и (75) функцию распределения F(υ), получим после интегрирования
(76) |
(77) |
Из выражений (76) и (77) видно, что средняя квадратичная и средняя скорости молекул возрастают с ростом температуры. Это возрастание пропорционально квадратному корню из абсолютной температуры. Кроме того, эти скорости обратно пропорциональны корню квадратному из массы молекул.
Из сравнения формул (72), (76) и (77) заключаем, что наименьшей из трёх характерных скоростей максвелловского распределения является наиболее вероятная, а наибольшей ― средняя квадратичная, т. е.
(78) |
