
- •Раздел II. Молекулярная физика
- •Глава1. Некоторые понятия молекулярной физики
- •§1 Массы атомов и молекул. Молярная масса
- •§2. Молекулярные силы
- •§3. Агрегатные состояния вещества. Особенности теплового движения в различных агрегатных состояниях вещества
- •§4. Равновесные процессы
- •Глава 2. Оcновы статической теории идеального газа
- •§1. Модель идеального газа
- •§2. Основное уравнение кинетической теории газов для давления
- •§3. Температура и её измерение. Опытные температурные шкалы.
- •2. Измерение давления газа при постоянном объёме производится с большей точностью, чем измерение объёма при постоянном давлении.
- •§4. Температура ― мера средней кинетической энергии поступательного движения молекул.
- •§5 Уравнение Менделеева-Клапейрона. Следствие из этого уравнения.
- •§6. Распределение Максвелла.
- •§7. Свойства распределения Максвелла.
- •§8. Распределение Больцмана. Барометрическая формула.
- •§ 9. Число степеней свободы молекул. Теорема о равномерном распределении энергии теплового движения по степеням свободы.
- •Глава 3. Основы термодинамики
- •§1. Внутренняя энергия, работа, теплота
- •§2. Первое начало термодинамики
- •§3. Теплоёмкость. Вычисление теплоёмкости идеального газа
- •§4. Изотермический процесс. Работа идеального газа при изотермическом изменении его объема
- •§5. Адиабатический процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •§6. Круговые обратимые процессы (циклы). Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу. Тепловые и холодильные машины
- •§7. Недостаточность первого начала термодинамики для однозначного описания процессов, происходящих в природе.
- •§8. Второе начало термодинамики. Формулировка основного постулата, выражающего второе начало термодинамики. Постулаты Кельвина и Клаузиуса и их эквивалентность
- •§9 . Цикл Карно и его кпд
- •§10. Математическое выражение второго начала термодинамики для обратимых процессов. Равенство Клаузиуса. Энтропия. Постоянство энтропии при обратимых процессах в замкнутой системе
- •§11. Основное уравнение термодинамики для обратимых процессов. Вычисление энтропии идеального газа.
- •§12. Второе начало термодинамики для необратимых процессов. Неравенство Клаузиуса. Возрастание энтропии при необратимых процессах в замкнутой системе. Общая формулировка второго начала термодинамики
- •§13. Примеры. Вычисление изменения энтропии при необратимых процессах
- •§14. Закон возрастания энтропии и превращение теплоты в работу
- •Глава 4. Реальные газы
- •§1. Экспериментальные изотермы. Область двухфазных состояний. Критическое состояние вещества
- •§2. Фазовая диаграмма жидкость-газ или кривая равновесия фаз
- •§З. Уравнение Ван-дер-Ваальса
- •§4. Изотермы Ван-дер-Ваальса и их сравнение с экспериментальными изотермами. Пересыщенный пар и перегретая жидкость
- •§5. Внутренняя энергия газа Ван-дер-Ваальса. Изотермическое расширение газа Ван-дер-Ваальса. Адиабатическое расширение газа Ван-дер-Ваальса в пустоту.
- •Глава 5. Столкновения молекул и явления переноса в газах
- •§1. Среднее число столкновений и средняя длина свободного пробега молекул
- •§2 Виды явлений переноса. Общее уравнение явлений переноса в газах
- •§3. Теплопроводность
- •§4. Вязкость
- •§5. Диффузия в газах
- •С точки зрения молекулярно кинетической теории за переносимую величину нужно взять концентрацию компоненты , рассчитанную на одну молекулу, т.Е.
- •Глава6. Твердые тела
- •§1. Аморфное и кристаллическое состояние вещества
- •§2. Классификация кристаллов по типу молекул, составляющих кристалл
- •§3. Анизотропия кристаллов
- •§4. Теплоемкость атомных кристаллов
- •Приложение а. Основные понятия теории вероятностей
- •§1. Понятие вероятности события
- •§2. Простейшие теоремы теории вероятностей
- •§3. Интегральная функция распределения случайной величины
- •§4. Плотность вероятности
- •§5. Среднее значение
§2. Первое начало термодинамики
Поскольку внутренняя энергия системы может изменятся двумя способами ― путём совершения работы и путём передачи ей некоторого количества тепла, то в соответствии с законом сохранения энергии можно утверждать, что количество теплоты δQ, сообщаемое системе идёт на увеличение внутренней энергии dU и на работу δА, совершаемую системой над телами:
(92) |
В отличие от закона сохранения и превращения механической энергии в первом начале термодинамики рассматривается изменение энергии системы не только за счёт совершения работы, но и за счёт передачи тепла.
Отметим, что δQ считается положительным, если тепло получается системой, и отрицательным, если система отдаёт тепло окружающей среде. Наоборот, δА считается положительным, если система совершает работу против внешних сил, и отрицательным в противоположном случае.
Уравнение (92) записано для бесконечно малого изменения состояния системы, т.е. в дифференциальной форме. Проинтегрируем (92) от состояния 1 до состояния 2, испытанного системой частиц.
![]()
Если
обозначить через
![]() ― количество теплоты, полученное
системой при переходе из состояния 1 в
состояние 2, через
― количество теплоты, полученное
системой при переходе из состояния 1 в
состояние 2, через
![]() ― работу, произведенную системой при
этом переходе и, наконец, через
― работу, произведенную системой при
этом переходе и, наконец, через
![]() ― изменение внутренней энергии системы
при том же переходе, то выражение первого
начала термодинамики в интегральной
форме примет вид:
― изменение внутренней энергии системы
при том же переходе, то выражение первого
начала термодинамики в интегральной
форме примет вид:
(93) |
Следует также отметить, что под работой, совершаемой системой, подразумевается не только работа сил, обычно рассматриваемых в механике, но и работа сил любой природы. Например, это может быть работа электрических, магнитных сил, работа сил поверхностного натяжения и т.д.
В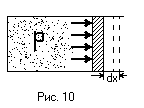 дальнейшем под работой будет подразумеваться
работа, совершаемая системой частиц,
при изменении объёма этой системы. Пусть
системой является газ, находящий в
цилиндре, который закрыт подвижным
поршнем площадью S
(Рис. 10). При бесконечно малом расширении
газа, т.е. при увеличении его объёма на
dV,
газ совершает работу над поршнем, равную
произведению силы, действующей со
стороны газа на поршень F=PS,
на бесконечно малое перемещение поршня
dx:
дальнейшем под работой будет подразумеваться
работа, совершаемая системой частиц,
при изменении объёма этой системы. Пусть
системой является газ, находящий в
цилиндре, который закрыт подвижным
поршнем площадью S
(Рис. 10). При бесконечно малом расширении
газа, т.е. при увеличении его объёма на
dV,
газ совершает работу над поршнем, равную
произведению силы, действующей со
стороны газа на поршень F=PS,
на бесконечно малое перемещение поршня
dx:
(94) |
Таким образом, элементарная работа, совершаемая газом, равна произведению давления, под которым находится газ, на бесконечно малое изменение его объёма.
Работа, совершаемая газом, при конечном изменении объёма:
(95) |
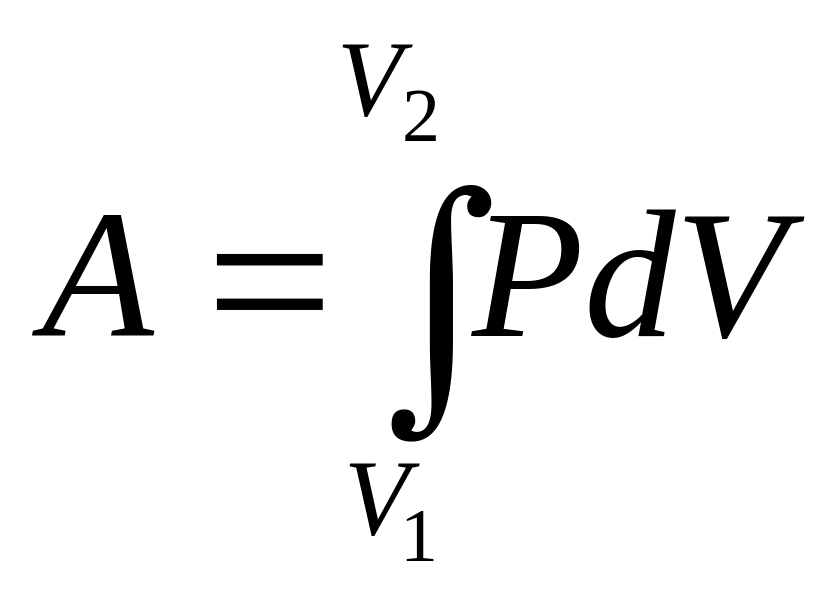
Если при изменении объёма давление газа было постоянным (P=Const), то A=P(V1 – V2), т.е. при изобарическом расширении работа, производимая газом, равна произведению давления на изменение объёма.
В случае произвольной зависимости P=P(V)
работа расширения (сжатия) газа от объёма
V1
до V2
объёма существенно зависит не только
от V1
и V2,
но и от пути перехода. Если переводить
систему из состояния 1 в состояние 2 по
пути 1А2, то работа, в соответствии с
(95), будет равна величине площади под
кривой 1А2 (Рис.11), если же ― по пути 1В2,
то будет равна меньшей площади, равной
площади под кривой 1В2. Физически это
объясняется тем, что давление газа Р
зависит не только от объёма V,
но и от температуры Т.
Поэтому, меняя по-разному температуру
при переходе из 1 в 2, получаем различные
по форме линии, изображающие процессы
перехода из состояния 1 в состояние 2
(при переходе 1В2 температура газа всё
время остаётся меньше, чем при переходе
1А2).
случае произвольной зависимости P=P(V)
работа расширения (сжатия) газа от объёма
V1
до V2
объёма существенно зависит не только
от V1
и V2,
но и от пути перехода. Если переводить
систему из состояния 1 в состояние 2 по
пути 1А2, то работа, в соответствии с
(95), будет равна величине площади под
кривой 1А2 (Рис.11), если же ― по пути 1В2,
то будет равна меньшей площади, равной
площади под кривой 1В2. Физически это
объясняется тем, что давление газа Р
зависит не только от объёма V,
но и от температуры Т.
Поэтому, меняя по-разному температуру
при переходе из 1 в 2, получаем различные
по форме линии, изображающие процессы
перехода из состояния 1 в состояние 2
(при переходе 1В2 температура газа всё
время остаётся меньше, чем при переходе
1А2).
В математическом анализе доказывается, если величина криволинейного интеграла не зависит от формы пути интегрирования, то подынтегральная функция является полным дифференциалом некоторой функции. В нашем случае подынтегральная функция в выражении работы (95) δА=PdV не является полным дифференциалом и обозначается δА, а не dA, так как величина интеграла (95) зависит от пути. Изменение же внутренней энергии, как отмечалось ранее, не зависит от пути и определяется разностью её значений в состояниях 2 и 1, т. е.
(96) |
и, таким образом, подынтегральная функция dU ― полный дифференциал.
Из первого начала термодинамики
(97) |
следует, если величина (dU+δA), стоящая в правой части (97) не является полным дифференциалом, то и его левая часть δQ не есть полный дифференциал.
Таким образом, зависимость величин A и Q от пути перехода системы из одного состояния в другое означает, что работа и количество теплоты не являются функциями состояния системы. Они характеризуют не состояние системы, а процесс изменения этого состояния, и если нет процесса, то ни работы, ни теплоты у системы тоже нет, в то время как внутренняя энергия всегда существует. Поэтому величина δA есть просто элементарная работа, совершаемая системой при бесконечно малом изменении состояния (но не изменения работы); аналогично δQ означает бесконечно малое количество теплоты, переданное системе (но не изменения количества теплоты). Величина же dU есть бесконечно малое изменение внутренней энергии, являющейся функцией состояния системы.
