
- •8.4. Мозжечок
- •8.6. Базальные ганглии
- •8.8. Методы исследования цнс
- •8.9. Особенности физиологии цнс развивающегося организма
- •Глава 9 вегетативная нервная система
- •9.1. Функциональные особенности внс и ее отделы
- •9.2. Симпатическая нервная система
- •9.4. Парасимпатическая нервная система
- •9.6. Интраорганная нервная система и тканевые рецепторы
- •9.8. Взаимодействие между отделами внс
- •9.9. Центры вегетативной нервной системы
- •9.10. Афферентные пути вегетативной нервной системы
- •9.11. Дуга вегетативного рефлекса
- •9.12. Тонус вегетативных центров
- •9.14. Особенности вегетативной нервной системы детей
- •Глава 10
- •10.1. Общая характеристика эндокринных желез и гормонов
- •10.2. Регуляция образования гормонов
- •10.3. Методы изучения функций желез внутренней секреции
- •10.4. Гипофиз
- •10.5. Эпифиз (шишковидная железа)
- •2. Установлена определенная зависимость между содержанием йода и гормонообразова-
- •Глюкагон
- •10.10. Надпочечники
- •10.11. Половые железы
- •10.12. Гормоны плаценты. Понятие о тканевых гормонах и антигормонах
- •10.13. Особенности эндокринной системы детей
- •10.14. Эндокринная система стареющего организма
- •Глава 11
- •11.1. Кровь как внутренняя среда организма
- •11.3. Регуляция эритропоэза
- •11.4. Физиология лейкоцитов
- •11.5. Регуляция лейкопоэза
- •11.6. Система регуляции агрегатного состояния крови (pack)
- •Глава 12
- •12.1. История. Понятия. Роль системы дыхания
- •12.2. Внешнее дыхание
- •12.8. Система дыхания старкющего организма
- •Глава 13
- •13.2. Цикл сердечной деятельности
- •13.3. Особенности свойств сердечной мышцы
- •1. Параметры потенциала покоя и пд.
- •13.4. Особенности энергетического обеспечения сердечной мышцы
- •13.6. Методы исследования деятельности сердца
11.6. Система регуляции агрегатного состояния крови (pack)
Система PACK обеспечивает: 1) сохранение жидкого состояния крови в норме; 2) свертывание крови в экстремальных состояниях; 3) восстановление стенок капилляров и других сосудов после их повреждения под действием тех или иных факторов.
В настоящее время существует много противоречивых определений процессов свертывания крови и систем, обеспечивающих остановку кровотечения, антисвертывание и фибринолиз. Понятие «система PACK» позволяет выделить не системы, а основные механизмы ее деятельности: 1) механизмы гемостаза (их несколько) обеспечивают остановку кровотечения; 2) механизмы антисвертывания поддерживают жидкое состояние крови; 3) механизмы фибринолиза обеспечивают растворение тромба (кровяного сгустка) и восстановление просвета сосуда (реканализация).
Различают два механизма гемостаза: 1) со-судисто-тромбоцитарный (микроциркулятор-ный) и 2) коагуляционный (свертывание крови).
Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах (в сосудах микро-циркуляторного русла), где имеются низкое кровяное давление и малый просвет сосудов. В них остановка кровотечения может произойти за счет: 1) сокращения стенок сосудов; 2) образования тромбоцитарной пробки; 3) сочетания того и другого.
Коагуляционный механизм гемостаза обеспечивает остановку кровотечения в более крупных сосудах (сосудах мышечного типа). В них остановка кровотечения осуществляется за счет свертывания крови (гемокоагуля-ции).
Полноценная гем о статическая функция организма возможна при условиях тесного взаимодействия сосудисто-тромбоцитарного и гемокоагуляционного механизмов гемостаза. При ранениях как мелких, так и крупных сосудов происходит образование тромбоии-тарной пробки с последующим свертыванием крови и организацией фибринового сгустка.
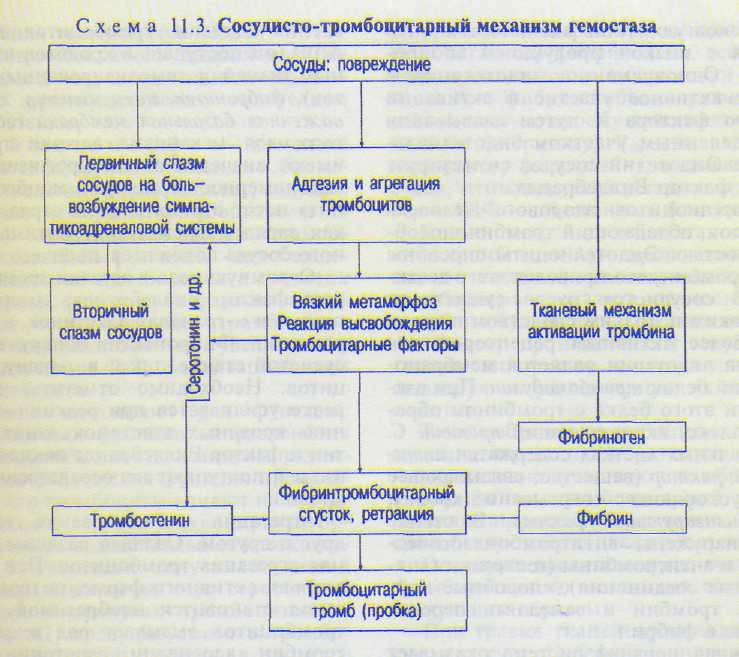
11.6.1. СОСУДИСТО-ТРОМБОЦИТАРНЫИ МЕХАНИЗМ ГЕМОСТАЗА
А. Роль эндотелия сосудов. Сосудистая стенка и тромбоциты являются равноценными участниками этого механизма гемостаза (схема 11.3). Эндотелий, выстилающий внутреннюю поверхность сосудов, обладает тромбо-резистентностью (препятствует образованию тромбов) и играет важную роль в поддержании и сохранении жидкого состояния циркулирующей крови. Это свойство эндотелиаль-ных клеток обусловлено их способностью, во-первых, синтезировать и выделять в кровоток ингибитор агрегации тромбоцитов -простациклин, во-вторых, синтезировать тканевый активатор плазминогена, в-третьих, препятствовать контактной активации факторов свертывания крови эндотелием сосудов, в-четвертых, создавать антикоагуляционный потенциал на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин—антитромбин III и, в-пятых, удалять из кровотока активированные факторы свертывания крови.
Большую роль в сосудисто-тромбоцитар-ном гемостазе играют производные арахидоно-вой кислоты, которая выделяется из сосудистой стенки вследствие активации фосфоли-
224
Значительное место в сосудисто-тромбо-цитарном гемостазе занимает калликреин-ки-ниновая система. Она представлена значительным количеством компонентов, функционирование и взаимодействие которых приводят к образованию, превращению и разрушению кининов: 1) неактивным предшественником кинина — кининогеном;
2) ферментами, активирующими кинино- ген, — кининогеназами, которые также на ходятся в неактивном состоянии. Одна из кининогеназ, прекалликреин, активируется активным ХПа фактором плазмы, плаз- мином, при сдвиге рН в сторону ацидоза;
3) ферментами, расщепляющими кинины, — кининазами.
Кинины — простые пептиды, они образуются в тканях, в том числе в стенках сосудов (в артериях и венах), поэтому они называются местными, или тканевыми, гормонами.
Физиологическая роль кининов многогранна. Они понижают тонус гладких мышц артериол и тем самым снижают величину артериального давления, расширяют коронарные сосуды, поэтому их называют вазоактив-ными пептидами. Кроме того, кинины повышают проницаемость капилляров, стимулируют диапедез лейкоцитов, повышают тонус гладкой мускулатуры бронхов.
Эндотелий сосудов вырабатывает, кроме кининов, другие биологически активные вещества, способные воздействовать на его гладкую мышцу. Так, действующим началом эндотелиального расширяющего фактора является оксид азота — NO, образующийся в эндотелии под действием многих медиаторов (кининов, ацетил-холина), который локально расслабляет мышцу сосуда через систему гуанилатцикла-зы. Важно отметить, что оксид азота инак-тивируется, соединяясь с гемоглобином, подобно окиси углерода или цианидам. Ин-тактный эндотелий обладает сравнительно
225
низкой прокоагулянтной активностью, что связывается с низкой продукцией апопро-теина III. Одновременно эндотелиоциты принимают активное участие в активации плазменного фактора X путем связывания его с определенным участком эндотелиаль-ной клетки. Эндотелий сосудов синтезирует фактор V и фактор Виллебранда.
Из эндотелиоцитов здорового человека выделен белок, обладающий тромбиноподоб-ной активностью. Эндотелиоциты способны связывать тромбин, что приводит к его дезактивации. В сосудистом русле существуют зоны с высоким и низким сродством к тромбину. Наиболее активным рецептором для тромбина на эндотелии является мембрано-связывающий белок тромбомодулин. При взаимодействии этого белка с тромбином образуется комплекс, активирующий протеин С. В эндотелиальных клетках содержатся антигепариновый фактор (вещество, связывающее гепарин и ускоряющее свертывание крови); фибринстабилизирующий фактор. В стенке сосудов обнаружены антитромбопластичес-кий фактор и антитромбины (гепарин и гепа-риноподобные соединения), способные нейтрализовать тромбин и замедлять переход фибриногена в фибрин.
Вегетативная нервная система оказывает влияние на способность стенки сосудов выделять в кровоток вещества, влияющие на процесс свертывания крови и фибринолиз. Так, показано, что повышение тонуса симпатического отдела вегетативной нервной системы, как и введение вазоконстрикторов, сопровождается секрецией из артерий и вен тромбопластина и активаторов плазмино-гена.
Б. Роль тромбоцитов. Тромбоциты — необходимый компонент сосудисто-тромбо-цитарного механизма гемостаза. Тромбоциты — кровяные пластинки, очень маленькие клетки крови (диаметр 2—5 мкм) разнообразной формы (чаще формы диска), не имеют ядра. Тромбоцит состоит из двух частей: а) гиаломера — наружная часть; б) грануло-мера — внутренняя, содержащая гранулы. При соприкосновении с чужеродной поверхностью тромбоциты распластываются и выпускают псевдоподии. В 1 л крови содержится 180х109—320хЮ9 тромбоцитов. Тромбоциты обладают следующими свойствами: 1) фагоцитоз; 2) амебовидная подвижность; 3) легкая разрушаемость; 4) адгезия; 5) агрегация; 6) вязкий метаморфоз.
Адгезия — прилипание тромбоцитов к чужеродной поверхности, в частности к измененной сосудистой стенке. Для осущест-
вления адгезии тромбоцитов необходимы АДФ (он поступает в кровоток из разрушенных тканей и гемолизированных эритроцитов), фибриноген, ионы кальция, коллаген, обнаженная базальная мембрана сосуда. Кроме того, для механизма адгезии тромбоцитов имеют значение и электрофизиологические зккономерности: снаружи мембрана тромбоцита несет отрицательный заряд, в то врем как заряд поврежденной интимы кровеносного сосуда положительный.
Огромную роль в адгезии тромбоцитов играет фактор Виллебранда, содержащийся в плазме и а-гранулах пластинок, а также фиб-ронектин. Фибронектин обнаружен как в сосудистой стенке, так и в а-гранулах тромбоцитов. Необходимо отметить, что адгезия резко усиливается при реакции «освобождения» кровяных пластинок, когда фибронектин и фактор Виллебранда покидают тромбоциты и поступают непосредственно в плазму крови.
Агрегация — склеивание тромбоцитов друг с другом. Сначала развивается обратимая агрегация тромбоцитов. При появлении в крови активного фермента тромбина агрегация становится необратимой. Агрегацию тромбоцитов вызывает ряд веществ: АДФ, тромбин, адреналин, серотонин, коллаген, простагландины Е2 и F2a, тромбоксан А2, ионы кальция. Важная роль в агрегации кровяных пластинок принадлежит фактору, активирующему тромбоциты (ФАТ), который синтезируется лейкоцитами, макрофагами, тромбоцитами, сосудистой стенкой. Адгезия и агрегация кровяных пластинок начинаются со взаимодействия фактора, их вызывающего (индуктора), со специфическими рецепторами тромбоцитов, к которым относятся гликопротеиды с различной молекулярной массой. Гликопротеиды располагаются не только на поверхности мембраны тромбоцита, но и в его открытой канальце-вой системе.
В адгезии и агрегации тромбоцитов особое место отводят специальному белку -тромбоспондину, гликопротеиду с молекулярной массой 420 000—450 000 Д. Обнаружено, что тромбоспондин может связываться с фибронектином в присутствии ионов Са2+ или Mg2+, а также служить рецептором для фибриногена. Кроме того, тромбоспондин на поверхности тромбоцитов способен взаимодействовать с гликопротеидами, содержащими большое количество гистидина. Эта реакция играет важную роль в адгезии тромбоцитов к субэндотелию, а также в образовании тромбоцитарных агрегатов. Адге-
226
зия и агрегация тромбоцитов зависят от соотношения тромбоксанов, выделяемых из кровяных пластинок, и простациклина, синтезируемого преимущественно эндотелием сосудистой стенки.
Вязкий метаморфоз — комплекс морфологических, функциональных и биохимических изменений в тромбоцитах, ведущих к истончению мембраны тромбоцитов и их разрушению. Заканчивается вязкий метаморфоз так называемой реакцией «освобождения» — выходом из тромбоцитов в кровоток тромбоцитарных факторов свертывания крови. Реакция «освобождения» тромбоцитов связана с внутриклеточным увеличением концентрации ионов Са2+, с активацией кон-трактильных белков.
Тромбоциты выполняют ряд функций. 1. Гемостатическая функция направлена на образование тромба в сосудах микроциркуляции. 2. Ангиотрофическая функция проявляется в том, что тромбоциты влияют на структуру и функцию сосудов микроциркулятор-ного русла, питая эндотелиальные клетки капилляров. 3. Регуляция тонуса сосудистой стенки осуществляется за счет серотонина, находящегося в гранулах тромбоцитов, и тромбоксана А2, продуцируемого в тромбоцитах из арахидоновой кислоты в процессе агрегации тромбоцитов. 4. Участие в процессе свертывания крови осуществляется за счет тромбоцитарных факторов свертывания крови. Различают собственные тромбоцитар-ные факторы, находящиеся в гранулах тромбоцитов, и адсорбированные на поверхности мембраны тромбоцита плазменные факторы свертывания крови. По международной номенклатуре они обозначаются арабскими цифрами и латинскими буквами (от слова platelet — пластинка). Важнейшими из них являются Р1 — тромбоцитарный акиелера-тор — глобулин; идентичен фактору V плазмы, относится к адсорбированным из плазмы факторам. Р2 — акцелератор тромбина; ускоряет переход фибриногена в фибрин. Р3 — тромбопластический фактор, или фосфоли-пид; сосредоточен в мембранной фракции, необходим для образования протромбиназы по внутреннему пути. Р4 — антигепариновый фактор. Р5 — фибриноген тромбоцитов; находится он как на поверхности тромбоцитов, так и внутриклеточно, играет важную роль в агрегации тромбоцитов. Р6 — тромбостенин — контрактильный белок, подобный мышечному актомиозину; обеспечивает движение тромбоцитов и образование псевдоподий, принимает участие в осуществлении ретракции, адгезии и агрегации. Р7 — антифиб-
ринолитический фактор, связывает плазмин. Р8 — активатор фибринолиза, действие которого проявляется в присутствии стрептоки-назы. Рц — фибринстабилизирующий фактор, напоминает по своему действию фактор XIII плазмы (фибриназу). Р|0 — вазоконстриктор-ный фактор (серотонин); вызывает спазм сосудов, стимулирует агрегацию тромбоцитов. Рц — АДФ — эндогенный фактор агрегации.
Кроме того, в тромбоцитах обнаруживаются тромбоксан А2 — производный арахидоновой кислоты, вызывающий агрегацию тромбоцитов и спазм кровеносных сосудов; тромбоглобулин, роль которого не установлена. Фактор проницаемости сосудов и хемо-таксический фактор, который усиливает двигательную и фагоцитарную активность лейкоцитов.
Таким образом, тромбоциты, осуществляя адгезию, агрегацию и реакцию «освобождения», активно участвуют в образовании и консолидации тромбоцитарной пробки, запускают процесс свертывания крови, чем способствуют остановке кровотечения.
Остановка кровотечения за счет сосудисто-тромбоиитарного механизма осуществляется следующим образом.
При травме тканей происходит спазм сосудов за счет: 1) рефлекторного их сокращения — кратковременный (первичный) спазм; 2) действия биологически активных веществ на стенку сосудов (серотонин, адреналин, норадреналин, тромбоксан АД которые освобождаются из тромбоцитов и поврежденных тканей. Этот спазм (вторичный) более продолжителен. Одновременно при травме происходит формирование тромбоцитарной пробки, закрывающей просвет поврежденного сосуда. В основе её образования лежит способность тромбоцитов прилипать к чужеродной поверхности (адгезия), склеиваться друг с другом (агрегация) и легко разрушаться, выделяя различные биологически активные вещества («вязкий метаморфоз тромбоцитов»). В результате этих процессов из тромбоцитов выделяются тромбоцитарные факторы. Они запускают процесс свертывания крови, в результате которого образуется фибрин. Нити фибрина оплетают тромбоциты, в результате чего образуется фибрин-тромбоцитарная структура — тромбоцитар-ная пробка. Из тромбоцитов выделяется особый белок — тромбостенин, под влиянием которого происходит сокращение тромбоцитарной пробки, образуется тромбоцитарный тромб. Он прочно закрывает просвет микрососуда, и кровотечение останавливается (см. схему 11.3).
227
11.6.2. КОАГУЛЯЦИОННЫЙ МЕХАНИЗМ ГЕМОСТАЗА
Процесс свертывания крови (гемокоагуляция) заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимое состояние — фибрин. В результате процесса свертывания кровь из жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет поврежденного сосуда.
А. Факторы свертывания крови. В свертывании крови принимает участие много факторов. Они получили название факторы свертывания крови и содержатся в плазме крови, форменных элементах (эритроцитах, лейкоцитах, тромбоцитах) и в тканях. Наибольшее значение имеют плазменные факторы. Они обозначаются римскими цифрами. Все факторы свертывания крови — в основном белки, большинство из них является ферментами, но находится в крови в неактивном состоянии, активируется в процессе свертывания крови. Как правило, плазменные факторы свертывания крови образуются в печени, и для образования большинства из них необходим витамин К.
Фактор I (фибриноген) образуется в печени. Под влиянием тромбина переходит в фибрин. Принимает участие в агрегации тромбоцитов.
Фактор II (протромбин) образуется в печени в присутствии витамина К. Под влиянием протромбиназы переходит в тромбин (фактор На).
Фактор III (тромбопластин) входит в состав мембран клеток всех тканей и форменных элементов крови. Активирует фактор VII и, вступая с ним в комплекс, переводит фактор X в Ха. В плазме в физиологических условиях практически не содержится.
Фактор IV (Со2*} участвует в образовании комплексов факторов свертывания крови, входит в состав протромбиназы. Способствует агрегации тромбоцитов, связывает гепарин. Принимает участие в ретракции сгустка и тромбоцитарной пробки, тормозит фибри-нолиз.
Фактор V (проакцелерин) — глобулин, образуемый в печени. Активируется тромбином. Усиливает действие фактора Ха на протромбин (входит в состав протромбиназы).
Фактор VII (проконвертин) образуется в печени под влиянием витамина К. Принимает участие в формировании протромбиназы по внешнему механизму. Активируется факторами III, ХПа, 1Ха, Ха.
Фактор VIII (антигемофильный глобулин А)
синтезируется в печени, селезенке, лейкоцитах. Образует комплексную молекулу с фактором Виллебранда и специфическим антигеном. Активируется тромбином. Совместно с фактором 1Ха способствует переводу фактора ХвХа.
Фактор IX (антигемофильный глобулин В) образуется в печени под влиянием витамина К. Переводит фактор X в Ха и VII в Vila.
Фактор X (фактор Стюарта—Прауэра) образуется в печени под влиянием витамина К. Является составной частью протромбина.
Фактор XI (предшественник тромбоплас-тина); место синтеза неизвестно. Предполагается, что образуется в печени. Активируется фактором ХПа. Необходим для активации фактора IX.
Фактор XII (фактор Хагемана, или контакта); место синтеза не установлено. Предполагается, что образуется эндотелиаль-ными клетками, лейкоцитами, макрофагами. Активируется отрицательно заряженными поверхностями, адреналином, калликреином. Запускает внутренний механизм образования протромбиназы и фибринолиза, активирует факторы XI, VII и переводит прекалликреин в калликреин.
Фактор XIII (фибринстабилизирующцй фактор, фибриназа) содержится практически во всех тканях и форменных элементах. Стабилизирует фибрин.
Фактор XIV (фактор Флетчера — прекалликреин) участвует в активации факторов XII, IX и плазминогена. Переводит кининоген в кинин. Активируется фактором ХПа.
Фактор XV (фактор Фитцжеральда, Фло-жек, Вильямса); высокомолекулярный кининоген, образуется в тканях. Активируется калликреином. Принимает участие в активации фактора XII и переводе плазминогена в плазмин.
Основными плазменными факторами свертывания крови являются:
I — фибриноген; II — протромбин; III -тканевый тромбопластин; IV — ионы Сан.
Факторы с V по XIII — это дополнительные факторы, ускоряющие процесс свертывания крови, — акцелераторы.
Б. Процесс свертывания крови — ферментативный цепной (каскадный) процесс перехода растворимого белка фибриногена в нерастворимый фибрин. Каскадным он называется потому, что в процессе гемокоагуляции происходит последовательная цепная активация факторов свертывания крови. Свертывание крови является матричным процессом, так как активация факторов гемокоагуляции
228
осуществляется на матрице. Матрицей могут быть фосфолипиды мембран разрушенных форменных элементов (главным образом тромбоцитов) и обломки клеток тканей. Процесс свертывания крови осуществляется в три фазы.
Первая фаза начинается с активации XII фактора, затем происходит каскадная активация многих других факторов. Фаза заканчивается активацией X плазменного фактора с образованием сложного комплекса — протромбиназы. Образование протром-биназы осуществляется по двум механизмам: 1) внешнему; 2) внутреннему.
Внешний механизм формирования протромбиназы осуществляется при поступлении тканевого тромбопластина (фосфоли-пидные осколки мембран поврежденных клеток) в кровоток из поврежденных тканей и сосудистой стенки, взаимодействии его с плазменным фактором VII и ионами кальция. Образуется кальциевый комплекс, который превращает неактивный плазменный фактор X в его активную форму (Ха).
Внутренний механизм образования протромбиназы начинается с повреждения стенки сосуда и активации плазменного фактора XII за счет контакта его с отрицательно заряженной поверхностью базальной мембраны, коллагеном, высокомолекулярным кинино-геном (ВМК), калликреином, фактором 3 тромбоцитов (Р3) — фосфолипидными осколками мембран тромбоцитов. Активный фактор ХНа превращает плазменный фактор XI в активную форму (Х1а) также в присутствии фактора Р3 и ВМК. Фактор Х1а активирует плазменный фактор IX. В дальнейшем образуется комплекс факторов 1Ха, VIII, ионов кальция и Р3-фактора, который превращает фактор X в Ха (см. схему 11.4). Образовавшийся по внешнему и внутреннему механизмам активный фактор X (Ха) взаимодействует с плазменным фактором V, ионами кальция и Ргфактором, в результате чего образуется комплекс, который называется протром-биназой.
Вторая фаза — образование активного фермента тромбина. Он образуется из протромбина при действии на него протромбиназы. Под влиянием протромбиназы происходит протеолиз протромбина и образуется а-, р- и у-тромбин. Наиболее активным является а-тромбин с молекулярной массой 38 000 Д. Он оказывает выраженное коагуля-ционное действие. Однако а-тромбин быстро ингибируется естественными антикоагулянтами, особенно комплексом гепарин — AT-III. Р-Тромбин также обладает свертыва-
ющим действием, но оказывается резистентным к гепарину и АТ-Ш; у-тромбин не проявляет свертывающей активности и обладает фибринолитическим эффектом.
Третья фаза заключается в переходе растворимого белка плазмы фибриногена в нерастворимый фибрин. Эта фаза протекает последовательно, в три этапа.
Первый этап — протеолитический. Тромбин, обладая эстеразной активностью, отщепляет от а- и р-цепей молекулы фибриногена два пептида А, затем два пептида В. В результате образуются фибрин-мономеры.
Второй этап — полимеризационный. В основе этого неферментативного этапа лежит спонтанный самосборочный процесс, приводящий к агрегации фибрин-мономеров. Процесс полимеризации происходит по принципу «бок в бок» или «конец в конец». Самосборка фибрина осуществляется путем формирования продольных и поперечных связей между фибрин-мономерами с образованием фибрин-полимера (фибрин S). Волокна фиб- г рина S легко лизируются под влиянием не только плазмина, но и комплексных соединений, обладающих неферментативной фиб-риполитической активностью.
Третий этап — ферментативный. На этом этапе формирования фибрина фибриназа (XIII фактор плазмы, тромбоцитов и эритроцитов) дополнительно «прошивает» полимеры фибрина за счет новых связей между у-це-пями молекулы фибрина S, а также между у-цепями молекулы фибрина и коллагеном, в результате чего растворимый фибрин S переходит в нерастворимый фибрин I. Благодаря этому сгусток становится резистентным к действию мочевины и фибринолитических агентов и лучше фиксируется в поврежденном сосуде. Большую роль играют эритроциты в процессе превращения фибриногена в фибрин. В присутствии эритроцитов этот процесс значительно ускоряется, так как эритроцитарная мембрана катализирует реакции между тромбином и фибриногеном.
В результате свертывания крови образуется сгусток. Он состоит из нитей фибрина и осевших в них форменных элементов крови, главным образом эритроцитов. Кровяной сгусток закрывает просвет поврежденного сосуда. Сгусток, прикрепленный к стенке сосуда, называется тромбом. Тромб, или сгусток, в дальнейшем подвергается двум процессам: 1) ретракции (сокращению) и 2) фибри-нолизу (растворению). Ускорение процесса свертывания крови называется гиперкоагуляцией, замедление этого процесса — гипокоа-гуляцией.
229

Гуморальная регуляция осуществляется с помощью факторов свертывания крови, образуемых в различных клетках организма, особенно в клетках печени, легких, в сосудистой стенке. Синтез и выход в кровоток факторов гемокоагуляции регулируются по принципу обратной связи: чем меньше факторов свертывания содержится в крови, тем больше их образуется в клетках.
На процесс гемокоагуляции оказывают влияние также железы внутренней секреции. Все гормоны по их влиянию на процесс гемокоагуляции можно разделить на 3 группы: 1) стимулируют процесс свертывания крови: вазопрессин, окситоцин, глюкокортикоиды, минералокортикоиды, адреналин, половые
гормоны; 2) тормозят процесс свертывания крови: инсулин, липокаин; 3) оказывают двухфазное действие — вначале стимулируют процесс гемокоагуляции, а затем вызывают гипокоагуляцию (тироксин).
Нервная регуляция. При возбуждении парасимпатической нервной системы увеличивается выход в кровь гепарина, антитромбина III и процесс свертывания крови замедляется. Возбуждение симпатической нервной системы вызывает гиперкоагуляцию за счет усиленного выхода в кровоток тромбопласти-на и К-витаминзависимых факторов свертывания крови.
Рефлекторная регуляция гемокоагуляции осуществляется с хеморецеп-торов сосудов, которые возбуждаются факторами свертывания крови, в частности тромбином. При появлении в кровотоке тромбина
230
он рефлекторно стимулирует через парасимпатический отдел выход в кровоток гепарина и АТ-Ш из печени, легких, сосудистой стенки.
Корковые влияния на свертывание крови реализуются с помощью как симпатического и парасимпатического отделов вегетативной нервной системы, так и гормонов. В кору большого мозга информация поступает от хеморецепторов сосудов и нижележащих отделов центральной нервной системы. Если в коре большого мозга преобладает процесс возбуждения, то наблюдается гиперкоагуляция (импульсы к эффекторным органам передаются через симпатическую нервную систему). Напротив, если преобладает процесс торможения, то наблюдается гипокоагу-ляция (импульсы к эффекторным органам передаются через ядра блуждающих нервов).
11.6.4. МЕХАНИЗМЫ АНТИСВЕРТЫВАНИЯ КРОВИ
В крови содержатся вещества, предотвращающие и замедляющие процесс свертывания крови — ингибиторы (естественные антикоагулянты). Они делятся на две группы: первичные (самостоятельно синтезируемые в печени, легких и других органах) и вторичные (образуются в процессе свертывания крови и фибринолиза). К первичным ингибиторам относят антитромбин III и гепарин, обеспечивающие 80 % антикоагулянтной активности крови, а также антитромбин IV (сь-макроглобулин), дающий 10 % антикоагулянтной активности, К вторичным ингибиторам относят прежде всего отработанные факторы свертывания (фибрин, активные факторы Х1а и Va, фибринпептиды А и В, отщепляемые от фибриногена), а также продукты фибринолиза, в частности антитромбин VI. Наиболее изученными первичными антикоагулянтами являются антитромбин III (АТ-Ш) и гепарин.
Антитромбин-Ш — гликопротеид, мигрирующий с а2-глобулинами и локализованный преимущественно в интиме крупных сосудов. Его биосинтез осуществляется в печени и в эндотелиальных клетках. АТ-Ш тормозит активность тромбина, факторов IXa, Xa, XIa, ХПа, плазмина и калликреина.
Гепарин относится к серосодержащим кислым мукополисахаридам (гликозамино-гликан), синтезируется в базофильных клетках крови и тканей, а также в тучных клетках соединительной ткани. Гепарин содержится почти во всех тканях организма и яв-
ляется антикоагулянтом прямого и широкого спектра действия. Он проявляет свой антикоагулянтный эффект на факторы гемо-коагуляции непосредственно в крови. Гепарин тормозит процесс образования протром-биназы, блокирует превращение протромбина в тромбин, препятствует взаимодействию тромбина с фибриногеном — тормозит протекание всех фаз процесса гемокоагуляции. Антикоагулянтный эффект гепарина объясняется его способностью образовывать комплексные соединения с тромбогенными белками — протромбином, тромбином, фибриногеном. Разрушение гепарина осуществляется ферментом гепариназой. Гепарин усиливает ингибирующий эффект АТ-Ш. Изучено несколько механизмов инактивации тромбина АТ-Ш и гепарином: 1) АТ-Ш взаимодействует с тромбином (медленный процесс), затем к комплексу присоединяется гепарин, что ускоряет нейтрализацию энзима; 2) гепарин взаимодействует с тромбином, обеспечивая его быстрое связывание с АТ-Ш; 3) гепарин взаимодействует с АТ-Ш, ускоряя его связывание с тромбином.
11.6.5. ФИБРИНОЛИЗ
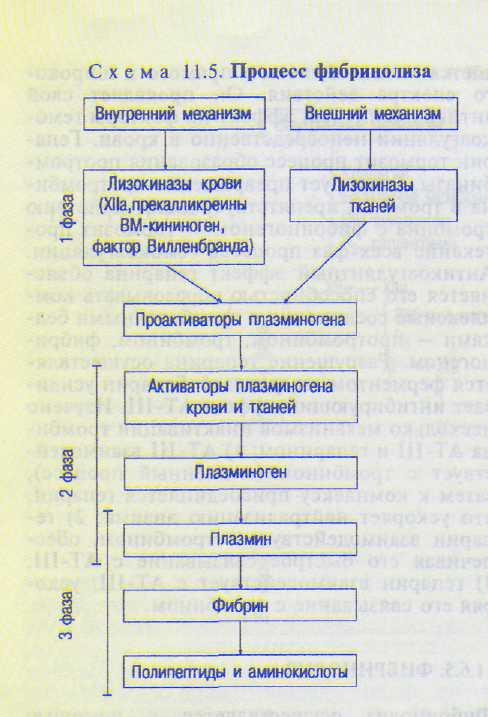
Фибринолиз осуществляется с помощью ферментативной системы, основной функцией которой является расщепление нитей фибрина, образовавшихся в процессе свертывания крови, на растворимые комплексы и восстановление просвета сосуда. В ее состав входят следующие компоненты (схема 11.5).
-
Фермент плазмин (фибринолизин) нахо дится в крови в неактивном состоянии в виде плазминогена (профибринолизина). Плаз мин является протеолитическом ферментом, относящимся к 3,-глобулинам. Он расщепля ет фибрин, фибриноген, некоторые плазмен ные факторы свертывания крови и другие белки плазмы крови.
-
Активаторы плазминогена (профибри нолизина) относятся к глобулиновой фрак ции белков. Различают две группы актива торов плазминогена; 1) прямого действия; 2) непрямого действия. Активаторы прямого действия непосредственно переводят плаз- миноген в активную форму — плазмин. К активаторам прямого действия относят кислые и щелочные фосфатазы, трипсин, урокиназу. Активаторы непрямого действия находятся в плазме крови в неактивном со стоянии в виде профибринолизинокиназы (проактиватора). Для его активации необхо-
231
3. Ингибиторы фибринолиза (антиплазмины) являются альбуминами. Антиплазмины принято делить на две группы. К первой группе относят антиплазмины, тормозящие действие активного фермента фибринолизи-на, ко второй группе — ингибирующие превращение профибринолизина в фибриноли-зин (плазминогена — в плазмин).
Основным быстродействующим ингибитором фибринолиза является а2-макроглобу-лин. При больших концентрациях активатора плазминогена вначале образуется комплекс плазмин — а2-антиплазмин, а затем плазмин — а2-макроглобулин. Предполагается, что главной функцией а2-макроглобулина является нейтрализация плазмина, если он не может быть полностью связан а2-антиплаз-мином.
Таблица 11.1. Содержание активатора плазминогена в различных органах и тканях человека [Андреенко Г.В., 1979]
|
|
Содержание |
|
Содержание |
|
Ткань, орган, |
активатора |
Ткань, орган, |
активатора |
|
жидкость |
(ед/г массы |
жидкость |
(ед/г массы |
|
|
ткани) |
|
ткани) |
|
Матка |
720 |
Почки |
119 |
|
Надпочечник |
410 |
Скелетная |
ПО |
|
|
|
мускулатура |
|
|
Лимфатические |
370 |
Сердце |
82 |
|
узлы |
|
|
|
|
Щитовидная |
325 |
Мозг |
85 |
|
железа |
|
|
|
|
Легкие |
223 |
Семенники |
25 |
|
Яичники |
210 |
Молоко |
20 |
|
Гипофиз |
140 |
Печень |
0 |
К ингибиторам фибринолиза относятся также а2-антиплазмин, а,-антитрипсин, сс,-химотрипсин, AT-III, С|-эстеразный ингибитор. Необходимо отметить, что в условиях нормы эти вещества существенного влияния на активность фибринолиза не оказывают. Ингибиторы фибринолиза, кроме плазмы, обнаружены в форменных элементах крови.
Процесс фибринолиза протекает в три фазы. В первой фазе фибринолиза лизокиназы, поступающие в кровь из тканей и форменных элементов, превращают проактива-тор плазминогена в активную форму, получившую название активатор плазминогена. Эта реакция осуществляется в результате отщепления от проактиватора ряда аминокислот. Вторая фаза фибринолиза заключается в превращении плазминогена (профибринолизина) в плазмин (фибринолизин). Последнее происходит в результате действия активатора на молекулу плазминогена, от которой отщепляется липидный ингибитор. Наконец, в третьей фазе фибринолиза под влиянием плазмина наступает расщепление фибрина до полипептидов (высокомолекулярные фрагменты X и Y, низко молекулярные D и Е) и аминокислот. Эти фрагменты, получившие название продукты деградации фибриногена/фибрина (ПДФ), обладают выраженным антикоагулянтным действием. Они не только ингибируют тромбин, но и тормозят процесс образования протромбин азы, подавляют процесс полимеризации фибрина, адгезию и агрегацию тромбоцитов. Фрагменты D и Е усиливают действие на сосудистую стенку бра-дикинина, ангиотензина и гистамина, что способствует дополнительному выбросу из эндотелия сосудов активаторов фибриноли-
232
за, и, следовательно, ускоряется фибринолиз. Активация фибринолиза, как и процесса свертывания крови, осуществляется по двум путям — внешнему и внутреннему.
По внешнему пути активация фибринолиза осуществляется за счет лизокиназы тканей, тканевых активаторов плазминогена. В первую очередь это относится к активатору, который образуется эндотелием сосудистой стенки, что облегчает его поступление в кровоток. В сосудистом русле активаторы оказывают свое специфическое действие на плаз-миноген. При физических нагрузках, стрессовых состояниях организма наблюдается усиление поступления тканевых активаторов в кровоток.
Внутренний механизм активации фибринолиза значительно сложнее внешнего. В активации фибринолиза по внутреннему механизму принимают участие лизокиназы крови: ХНа фактор, прекалликреины, высокомолекулярный кининоген (ВМК), фактор Вилле-бранда. Комплекс ХПа+ВМК способен превращать проактиваторы в активаторы плазминогена или же действовать непосредственно на профермент и переводить его в плаз-мин.
Значительную роль в процессе растворения фибринового сгустка играют лейкоциты. За счет фагоцитарной активности лейкоциты способны захватывать фибрин, лизировать его и выделять в окружающую среду продукты его деградации. Лизис фибрина в лейкоцитах осуществляется содержащимися в гранулах фибринолитическими протеазами до высокомолекулярных фрагментов X и Y без участия плазмина.
Помимо ферментативного, существует неферментативный фибринолиз. Он обусловлен фибринолитическим эффектом комплексных соединений гепарина с некоторыми гормонами, биогенными аминами и тром-богенными белками крови. Неферментативным фибринолизом осуществляется процесс расщепления нестабилизированного фибрина (фибрин S), в результате чего он из фибриллярной формы превращается в глобулярную, и тем самым происходит очищение сосудистого русла от промежуточных продуктов образования фибрина.
11.7. ГРУППЫ КРОВИ
Австрийский ученый К.Ландштейнер и чешский врач Я.Янский в 1901 — 1903 г. установили существование в Э£Ш£93ШТ&* людей особых антигенов — агглютиногенов и предполо-
жили наличие в сыворотке крови соответствующих им антител — агглютининов. Это послужило основанием для выделения у людей групп крови. Антигены — высокомолекулярные полимеры естественного или искусственного происхождения, которые несут генетически чужеродную информацию. При введении антигенов в организм наблюдается возникновение специфических иммунологических реакций, например образование антител. Групповую принадлежность крови обусловливают изоантигены. У человека описано около 200 изоантигенов. Они объединяются в групповые антигенные системы. Главными носителями антигенных свойств являются эритроциты. Изоантигены передаются по наследству, постоянны в течение всей жизни, не изменяются под воздействием экзогенных и эндогенных факторов. Антитела— иммуноглобулины, образующиеся на введение антигена. Антитела способны взаимодействовать с одноименными антигенами и вызывать ряд реакций, в том числе агглютинацию. В результате этого происходит склеивание антигенных частиц. Различают нормальные (полные) и неполные антитела. Нормальные антитела находятся в сыворотке крови людей, не иммунизированных антигенами. К ним относятся а- и р-агглютинины групповой антигенной системы АВО. Неполные антитела образуются в ответ на введение антигена, например, антирезусагглютинины. Различные группы крови объединяют в системы, в частности ABO, Rh-hr и др. Антигенные системы АВО и Rh-hr имеют большое клиническое значение, так как иммунологический конфликт по указанным системам является наиболее частой причиной осложнений, наблюдающихся при переливании крови.
11.7.1. СИСТЕМА АВО
Антигены (агглютиногены) А и В являются полисахаридами, они находятся в мембране эритроцитов и связаны с белками и липи-дами.
Антитела (агглютинины) а и (3 находятся в плазме крови. Одноименные агглютиногены и агглютининьТв~кровй~ОДного и того же человека не встречаются. Если же в эксперименте в пробирке смешать кровь с одноименными агглютиногенами и агглютининами, то произойдет реакция агглютинации (склеивания) эритроцитов. Подобная реакция может произойти и у пациента в случае ошибки при переливании крови! Деление людей по группам крови в системе АВО основано на раз-
233
личных комбинациях агглютиногенов эритроцитов и агглютининов плазмы. Известны четыре основные группы крови системы АВО: Осф (I), Ар (II), Ва (Ш), АВО (IV). В эритроцитах I группы нет А- и В-агглютиногенов, поэтому ее называют нулевой, а в плазме содержатся а- и р-агглютинины. В эритроцитах II группы есть агглютиноген А, в плазме — агглютинин р. Для III группы характерно наличие в эритроцитах агглютиногена В, в плазме — агглютинина а. Наконец, в эритроцитах IV группы крови находятся агглютино-гены А и В, в плазме агглютининов аир нет. В эритроцитах обнаружены разновидности агглютиногенов А и В: агглютиногены А^, В,_6. Указанные агглютиногены различаются по антигенным свойствам. Найдены также агглютинины а, и а2, получившие название экстраагглютининов. Кроме того, в крови людей различных групп могут находиться иммунные анти-А- и анти-В-антитела.
Иммунологический конфликт может произойти по системе АВО при встрече одноименных антигенов (агглютиногенов) и антител (агглютининов). При этом происходит агглютинация (склеивание) эритроцитов.
Иммунологический конфликт может наблюдаться в следующих случаях: а) при переливании крови, несовместимой в групповом отношении: например, реципиентам ЩАр) группы крови доноров Ш(Ва) группы и наоборот; б) при наличии в переливаемой крови иммунных анти-А- и анти-В-антител; в) при наличии в переливаемой крови экстраагглютининов а, и а2; г) при переливании больших количеств крови (более 200 мл) группы Оар (I) лицам с другими группами крови или лицам с АВО (IV) группой крови другой совместимой группы.
Исходя из сказанного при переливании крови необходимо предупредить встречу одноименных агглютиногенов и агглютининов, в противном случае может произойти агглютинация эритроцитов со смертельным исходом. При этом у донора (человек, который дает кровь) при переливании крови обычно обращают внимание на эритроциты с содержащимися в них агглютиногенами, а у реципиента (человек, которому переливают кровь) — на плазму с находящимися в ней агглютининами.
По системе АВО необходимо переливать только одногруппную кровь (по агглютиноге-нам АВО). В исключительных, экстренных случаях возможно применение правила От-тенберга: допускается переливание крови группы Оар (I), не содержащей групповых агглютиногенов, реципиентам других групп.
Поэтому человека с Оар (I) группой крови можно назвать относительно универсальным донором. В исключительных случаях реципиентам группы АВО (IV), не имеющим групповых агглютининов, допускается переливание крови другой совместимой группы (относительно универсальный реципиент), например, доноров ЦОар), П(ар) и Ш(Ва) групп. Однако количество переливаемой крови в таких случаях должно быть ограничено (не более 200 мл), причем очень осторожно следует переливать такую кровь больным с острой кровопотерей. Детям можно переливать только одногруппную кровь.
11.7.2. СИСТЕМА РЕЗУС (Rh)
Открыта в 1937—1940 гг. К.Ландштейнером и А.Винером при иммунизации кроликов кровью обезьян макак резусов. Антигены системы резус (Rh) являются липо-протеидами. Эритроциты 85 % европейцев содержат Rh-агглютиноген (монгольской расы — 100 %), кровь таких людей называют резус-положительной (Rh+). В эритроцитах 15 % людей резус-антигена нет. Это резус-отрицательная кровь (Rh"). В настоящее время описано несколько разновидностей антигенов системы резус. Наиболее важными из них являются RhO (D), rh'(C) и rh"(E), причем самым активным является антиген D, по которому и определяется резус-принадлежность.
Главной особенностью системы резус, по сравнению с системой АВО, является то, что она не имеет врожденных антител. Резус-антитела (антирезус-агглютинины) формируются при переливании резус-отрицательному человеку резус-положительной крови, что недопустимо.
Иммунологический конфликт по антигенной системе резус происходит в следующих случаях: а) при повторном переливании резус-отрицательному человеку (реципиенту) резус-положительной крови; б) в случаях беременности, когда женщина резус-отрицательна, а плод резус-положителен.
Если кровь резус-положительного донора переливать резус-отрицательному реципиенту, то в организме последнего начнут образовываться специфические по отношению к резус-фактору антитела — антирезус-агглютинины (Rh-антитела). При повторном переливании резус-положительной крови этому реципиенту у него может наблюдаться гемо-трансфузионный шок вследствие агглютинации эритроцитов донора с последующим их
234
гемолизом. Поэтому при повторных переливаниях крови необходимо выяснить резус-принадлежность крови донора и реципиента и резус-отрицательным реципиентам переливать только резус-отрицательную кровь. В настоящее время рекомендуется переливать только резус-совместимую кровь, особенно женщинам и детям.
Несовместимость крови по резус-фактору может привести к гемолитической анемии плода. Если мать резус-отрицательна, а отец резус-положителен, то плод может быть резус-положительным. При нарушении целостности сосудистого плацентарного барьера в период беременности резус-положительным плодом в организме матери могут вырабатываться антирезус-агглютинины. Это происходит вследствие того, что эритроциты RhT крови плода попадают в RrT кровь матери и вызывают выработку у нее Rh-антител. Последние, проникая через плаценту в кровь плода, могут вызвать агглютинацию его эритроцитов с последующим их гемолизом. В результате этого у новорожденного развивается тяжелая гемолитическая анемия, характеризующаяся низким содержанием гемоглобина и снижением количества эритроцитов.
Таким образом, открытие резус-фактора имеет большое практическое значение, так как дает возможность предупреждать гемо-трансфузионные реакции, которые могут возникнуть при переливании крови одноименных групп.
Известен еще ряд антигенных систем, из которых наибольшее значение имеют системы Келл-Челлано, Даффи, Кидд. Иногда встречается Н-антиген у лиц с первой группой крови. К указанным антигенам, как и к антигенам Rh-hr, нет естественных антител либо их роль незначительна.
11.8. ОСОБЕННОСТИ СИСТЕМЫ КРОВИ
ДЕТЕЙ
А. Форменные элементы. Органами кроветворения плода являются печень — со 2-го месяца, селезенка — с 3-го месяца, костный мозг и лимфатические узлы — с 4-го месяца. Роль печени и селезенки сначала возрастает, а с 4—5-го месяца убывает, и к концу внутриутробного развития кроветворение в основном осуществляется костным мозгом. Количество эритроцитов и гемоглобина у плода значительно больше, чем у взрослого, что является результатом стимулирующего влияния гипоксии на эритропоэз. Постоянная гипоксия
у плода объясняется тем, что затруднен газообмен между кровью плода и кровью матери через сравнительно толстую плаценту (ее толщина в 5—10 раз больше альвеолярной мембраны). Кроме того, плацента в отличие от легких включена параллельно относительно тела плода, поэтому через нее проходит только часть крови (см. раздел 13.14.1), которая затем смешивается с венозной кровью плода, что также снижает содержание кислорода в артериальной крови плода. Гипоксия плода частично компенсируется относительно большей массой у него циркулирующей крови и большой скоростью кровотока.
Во время рождения ребенка до 35 % крови находится в плаценте, поэтому, если держать плаценту над ребенком, значительная часть этой крови перейдет в сосуды новорожденного. Кроветворение до 4 лет жизни происходит в костном мозге всех костей, после чего красный мозг ряда костей до 14—15 лет превращается в желтый, а кроветворение сохраняется только в грудине, ребрах, костях черепа, таза и в телах позвонков, т.е. как и у взрослого человека.
Количество циркулирующей крови относительно массы тела новорожденного составляет около 15 %, в конце 1-го года жизни —
11 %, в 7—8 лет соответствует норме взросло го - 7-8 %.
Эритроциты плода содержат в основном фетальный гемоглобин (HbF), обладающий большим сродством к кислороду, что важно для обеспечения плода кислородом, так как в этом случае насыщение гемоглобина кислородом происходит лучше. Гемоглобин взрослого (НЬА) начинает синтезироваться у плода с 16-й недели и на 8-м месяце составляет всего лишь около 10 %, к моменту рождения — около 30 %, а к 4—5 мес жизни ребенка фетальный гемоглобин практически полностью заменяется на гемоглобин взрослого. Фетальный гемоглобин (0,1 — 2 %) сохраняется и у взрослых.
Количество эритроцитов у ребенка сразу после рождения значительно больше, чем у взрослого, и составляет (6—7) х 1012/л; естественно, больше и гемоглобина — 210 г/л. Это объясняется тем, что у плода, особенно в последние месяцы жизни, снижено насыщение гемоглобина крови кислородом, в результате чего возникает компенсаторная реакция — эритроцитоз и повышенное содержание гемоглобина крови. Затем эти показатели быстро падают вследствие разрушения большого количества эритроцитов — срок их жизни у новорожденного всего лишь около
12 дней. В дальнейшем он возрастает и к 10-му
235
месяцу составляет около 40 дней; норма взрослого достигается на 2-м году жизни.
Продукты разрушения эритроцитов стимулируют эритропоэз, появляется много молодых эритроцитов, а повышенное содержание кислорода в крови вызывает угнетение эритропоэза. Самое низкое содержание эритроцитов — в возрасте 3 мес (4,2 х Ю'ул), затем оно постепенно увеличивается и в
-
мес составляет 4,5 х 1012/л, гемоглобин — около 120 г/л; примерно таким он сохраняет ся до 2 лет с некоторым падением, после чего начинает медленно возрастать; у мальчиков больше: стимулируют андрогены, у девочек меньше: угнетают эстрогены. В возрасте 2—
-
лет количество эритроцитов у детей состав ляет 4,7 х 1012/л, старше 14 лет: у мальчи ков — 5,2 х 1012/л, у девочек — 4,8 х 10|2/л. Содержание гемоглобина у девочек и мальчи ков в 2 года — 117, в 4 — 126, в 10 — 130, а в 14 лет — у мальчиков 160, у девочек 140 г/л, т.е. количество эритроцитов и гемоглобина достигает нормы взрослого.
Лейкоциты плода появляются в конце 3-го месяца, на 5-м месяце их количество составляет около 1,8 х 109/л, сразу после рождения — 30 х 109/л (физиологический лейкоцитоз родового стресса), на 3-й день — около 14 х 109/л, в конце месяца — (10—12) х 109/л, далее показатель постепенно уменьшается и в 3—6 лет приближается к норме взрослого. С возрастом существенно изменяется формула лейкоцитов: сразу после рождения соотношение нейтрофилов (около 65 %) и лимфоцитов (около 25 %) как у взрослого, в 5—6 дней после рождения их содержание уравнивается (42—44 %) — первый перекрест, на 2—3-м месяцах число нейтрофилов уменьшается до 25—30 %, а лимфоцитов — возрастает до 60—65 %, после чего число нейтрофилов начинает возрастать, а число лимфоцитов уменьшаться, и в возрасте 4— 6 лет количество лимфоцитов и нейтрофилов снова уравнивается — второй перекрест, затем к 12—14 годам достигает нормы взрослого (схема 11.6).
Количество тромбоцитов в крови детей разного возраста составляет (200—300) х 109/л, что соответствует норме взрослого.
Б. Плазма крови. Содержание белка в плазме у ребенка 2-месячного возраста составляет около 50 г/л, к году достигая 65 г/л, к 7 годам жизни — 70, в 12 лет — 75 г/л, т.е. как у взрослого (70—80 г/л). Содержание глюкозы в крови ребенка сразу после рождения — 80—120 мг% (4,4—6,7 ммоль/л). Затем оно падает и на 15-й день равно 40—70 мг%,

в течение 1,5—2 лет не изменяется, после чего начинает повышаться и в возрасте 6 лет равно 70—105, а к 12—14 годам приближается к норме взрослого (80—120 мг%; 3,3— 5,5 ммоль/л). Содержание липидов и аминокислот близко к норме взрослого.
Плотность, вязкость, рН, осмотическое давление вскоре после рождения достигают уровня показателей взрослого, за исключением того, что у детей всех возрастов наблюдается компенсированный ацидоз (метаболический). СОЭ у новорожденных снижена (1—2 мм/ч), в грудном возрасте — 3—4 мм/ч, на 2-м году достигает нормы взрослого человека — 4—10 мм/ч. Относительно низкая СОЭ у грудных детей связана с пониженным содержанием в плазме фибриногена и холестерина.
Система регуляции агрегатного состояния крови (PACK) плода является незрелой — в крови низкий уровень факторов свертывания и антисвертывания (ингибиторы), за исключением гепарина, уровень которого на 8-м месяце примерно в 2 раза больше, чем у взрослого, а к моменту рождения снижается до нормы взрослого. У детей концентрация факторов свертывания и антисвертывания постепенно возрастает и к 14—15 годам приближается к норме взрослого. Поскольку в крови детей снижено содержание факторов свертывания и антисвертывания, время кровотечения и время свертывания крови у детей всех возрастов примерно как у взрослых лиц, лишь в период полового созревания эти показатели сильно колеблются, что объясняется гормональной перестройкой.
Различные агглютиногены (А и В, М и N, Rh) появляются в эритроцитах на 2—3-м месяце внутриутробного развития.
236
Способность агглютиногенов А и В к реакциям с а- и fl-агглютининами у детей несколько снижена, она достигает нормы взрослого к 10-летнему возрасту. Титр а- и р-агглютини-нов низкий. Свойства М- и N-агглютиноге-нов созревают у плода к 5-му месяцу жизни.
В. Иммунитет детей различного возраста снижен- Так, у новорожденных низки активность Т-киллеров и фагоцитоз, ограничен синтез у-интерферона, незрелыми являются другие Т- и В-лимфоциты, гуморальный иммунитет обеспечивается в основном материнскими антителами, попавшими в кровь плода еще до рождения и продолжающими поступать с грудным молоком после рождения. Имеются и собственные вещества, обеспечивающие гуморальный иммунитет, — ли-зоцим, пропердин, интерферон. Однако сопротивляемость организма к вирусам и микробам снижена. В возрасте 2—6 мес количество лимфоцитов максимально, но они еще незрелы. В этот период материнские антитела в крови разрушаются, а поступающие с грудным молоком у-глобулины метаболизи-руются. Однако начинает созревать собственная иммунная система, в частности возникает первичный ответ на большинство антигенов, хотя иммунная память еще не выражена, но к концу первого года жизни антитела синтезируются более активно. На третьем году жизни количество Т-лимфоцитов достигает уже нормы взрослого. В целом иммунная защита организма достигает максимума в возрасте около 10 лет.
11.9. ОСОБЕННОСТИ СИСТЕМЫ КРОВИ ПРИ СТАРЕНИИ
Интенсивность гемопоэза в пожилом и старческом возрасте несколько снижается, что связано: 1) с ухудшением кровоснабжения костного мозга, 2) с жировым перерождением части кроветворных клеток, 3) с инволюцией лимфоидной ткани селезенки и лимфатических узлов. Небольшое и примерно одинаковое снижение количества эритроцитов и гемоглобина в крови обычно не приводит к изменению цветового показателя. Лейкоцитарная формула и число тромбоцитов существенно не меняются.
При старении изменяются структура и химический состав мембран эритроцитов: уменьшается количество липидов и воды, увеличивается содержание ионов Na+. Уменьшение содержания АТФ в эритроцитах в процессе старения приводит к нарушению энергозависимого транспорта ионов и струк-
туры клетки. По мере старения снижается способность эритроцитов к восстановлению метгемоглобина в гемоглобин. К числу характерных изменений при старении следует отнести и уменьшение уровня в эритроцитах 2,3-дифосфоглицерата, что приводит к ухудшению отдачи кислорода тканям.
В процессе старения у эритроцитов снижается стойкость к осмотическому гемолизу, в меньшей степени — к механической травме. Эритроциты имеют пониженную способность к деформации и не могут проходить через микропоры селезенки. Они поглощаются фагоцитами, находящимися в красной пульпе селезенки. Снижение деформируемости эритроцита связано в определенной мере с изменением его цитоскелета. В эритроцитах обнаруживается агрегация спектрина и гемоглобина. Одновременно изменяется соотношение в мембране эритроцитов фос-фолипидов и холестерина в сторону увеличения последнего, что влияет на их текучесть. Эритроциты у стареющих людей могут стать источником аутоантигенов.
Значительно изменяется состав плазмы крови, в частности ее белковый спектр. Уменьшается количество альбуминов и увеличивается концентрация глобулинов, т.е. происходит сдвиг соотношения белковых фракций в сторону крупнодисперсных белков. С этим связан определенный рост скорости оседания эритроцитов. В возрасте 60— 74 лет этот показатель на 20—40 % выше, чем в возрасте 20—40 лет. Концентрация бета-глобулинов растет в большей степени, чем альфа- и гамма-глобулинов.
Факторами, увеличивающими возрастной риск развития заболеваний сердца и сосудов, являются повышение содержания в плазме крови холестерина и активация гемостатичес-ких механизмов. К 70 годам жизни содержание в плазме крови фибриногена, антиге-мофильного глобулина А увеличивается на 50 %, в старческом возрасте эти параметры повышаются в еще большей степени. Одновременно возрастает и антикоагуляционная способность крови: в 70-летнем возрасте содержание гепарина может увеличиваться в 2 раза и более, что в определенной степени ограничивает развитие тромбозов и тканевой гипоксии, всегда имеющей место у пожилых, особенно старых, людей. Однако в целом в возрасте после 40 лет развивается относительное преобладание коагуляционной активности крови и агрегационной способности тромбоцитов над антикоагуляционной активностью крови и антиагрегационной способностью эндотелия сосудистой стенки.
237
Повышается чувствительность тромбоцитов к агрегантам, возрастает риск тромбозов и эмболии. В старческом возрасте возникает скрыто протекающая форма диссеминиро-ванного внутри с ос уд исто го свертывания крови.
Одним из самых ранних проявлений старения, с возрастом все более и более выраженным, служит ослабление иммунной защиты организма. Нарушаются ранние стадии дифференцировки иммунокомпетентных клеток, процессы активации, пролиферации и межклеточные взаимодействия на антигензави-симых этапах дифференцировки такого рода клеток, с возрастом лимфоциты слабее реа-
гируют на мутагены, уменьшается цитоток-сический эффект киллеров. Количество иммуноглобулинов G и А у пожилых людей обычно составляет лишь 60 % показателей молодых. В связи с этим у таких людей часто оказывается неэффективной противогриппозная вакцинация, в 100—1000 раз повышается риск развития онкологической патологии.
Если в возрасте до 20 лет антитела против собственных тканей (аутоантигенов) выявляются крайне редко, то у 15 % пожилых людей обнаруживается антинуклеарный фактор, а у 6—21 % лиц — антитела к париетальным клеткам желудка.
