
- •Товароведение химической продукции технического назначения
- •Предисловие
- •Глава 1. Основные понятия химической технологии
- •1 Обще сведения о химико-технологическом процессе
- •1.2 Классификация химико-технологических процессов
- •1.3 Равновесие в химико-технологических процессах
- •1.4 Понятие о скорости химико-технологических процессов
- •1.5 Материальный и энергетический балансы
- •Глава 2. Технология производства и потребительские свойства минеральных кислот
- •2.1 Общие сведения о неорганических кислотах
- •2.2 Технология производства и потребительские свойства серной кислоты
- •2.3 Технология производства и потребительские свойства азотной кислоты
- •2.4 Технология производства и потребительские свойства фосфорной кислоты
- •2.5 Технология производства и потребительские свойства соляной кислоты
- •Глава 3. Технология производства и потребительских свойства минеральных удобрений
- •3.1 Значение минеральных удобрений для нтенсификации сельскохозяйственного производства
- •3.2 Классификация удобрений
- •3.3 Качество минеральных удобрений
- •3.4 Технология производства и потребительские свойства азотных удобрений
- •3.5 Технология производства и потребительские свойства фосфорных удобрений
- •1)Обработка природного фосфата фосфорной кислотой 2) сушка полученной пульны 3) получение пастообразной массы двойного суперфосфатат
- •4)Измельчение двойного муперфосфата 5)классификация двойного суперфосфата
- •3.6 Технология производства и потребительские свойства калийных удобрений
- •1)Измельчение сильвинита 2) обработка сельвинита маточным раствором
- •3) Отделение щелока от осадка NaCl
- •4) Охлаждение щелока 5) выделение кристаллов хлорида калия
- •6) Сушка хлорида калия
- •3.7. Технологии производства и потребительские свойства комплексных удобрений
- •3.7.1. Сложные удобрения.
- •3.8 Упаковка, хранение и транспортировка минеральных удобрений (гост 23954-80)
- •Глава 4. Технология переработки и потребительские свойства продукции топливной промышленности
- •4.1 Общие сведения о топливе, основные характеристики топлива, определяющие его качество
- •4.2 Технология переработки и потребительские свойства продукции переработки твердого топлива
- •4.2.1 Состав, свойства и классификация ископаемых углей
- •4.2.2 Способы переработки твердого топлива
- •4.2.3 Некоторые продукты коксования. Требования к качеству согласно госТам
- •4.2.4 Условия поставки, хранения и транспортировки твердого топлива
- •4.2.5 Перспективы использования твердого топлива
- •4.3 Технология переработки и потребительские свойства продукции переработки жидкого топлива
- •4.3.1 Значение нефти и нефтепродуктов в народном хозяйстве
- •4.3.2 Состав, свойства и классификация нефтей
- •4.3.3 Добыча нефти, подготовка ее к переработке, способы переработки нефти и нефтепродуктов
- •4.3.4 Классификация нефтепродуктов
- •4.3.5 Характеристика моторных топлив. Требования к качеству согласно госТам
- •4.3.6 Котельное топливо. Основные показатели качества согласно госТам
- •4.3.7 Получение товарных бензинов для двигателей внутреннего сгорания
- •4.3.8 Условия поставки, хранения и транспортировки жидкого топлива. Правила безопасности
- •4.3.9 Перспективные виды топлива, альтернативные жидкому
- •4.4 Технология переработки и потребительские свойства газового топлива
- •4.4.1 Состав и свойства газового топлива
- •4.4.2 Правила приема, маркировки, упаковки, транспортировки и хранения газового топлива
- •Глава 5. Основы технологии и потребительские свойства полимерных материалов
- •5.1. Общие сведения о полимерных материалах
- •5.2 Методы синтеза высокомолекулярных соединений.
- •5.3 Технология производства и потребительские свойства пластических масс.
- •5.3.1 Классификация и свойства пластмасс.
- •5.3.2 Полимеризационные пластмассы.
- •5.3.3 Поликонденсационные пластмассы
- •5.4 Технология производства и потребительские свойства каучука и резины.
- •5.4.1 Характеристика важнейших видов каучуков.
- •5.4.2 Резина и изделия на ее основе.
- •5.5 Технология производства и потребительские свойства химических волокон.
- •5.5.1 Полимеризационные волокна.
- •5.5.2 Поликонденсационные волокна.
- •5.6 Области применения полимерных материалов.
1.3 Равновесие в химико-технологических процессах
Всякая обратимая реакция, лежащая в основе химико-технологического процесса, при сохраняющихся условиях ее осуществления стремится к равновесию, т.е. к такому состоянию, когда скорости образования и расходования веществ, участвующих в данной реакции, становятся одинаковыми. Равновесие характеризуется вполне определенными концентрациями участвующих в реакции веществ и, следовательно, показывает, какое количество целевого продукта можно получить в данном процессе из заданного количества сырья. Установившееся равновесие можно нарушить, изменив условия, при которых находится система (температуру, давление, концентрацию одного из веществ). Изменение условий повлечет за собой установление нового равновесия.
Направление смещения равновесия может быть оценено с помощью принципа Ле Шателье: если на систему, находящуюся при равновесии, будет оказано внешнее воздействие, выводящее ее из равновесия, то система самопроизвольно будет стремиться уменьшить оказываемое на нее внешнее воздействие.
Рассмотрим произвольную обратимую реакцию:
аА
+ вВ
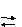 rR
+ Q
rR
+ Q
![]() (1)
(1)
где А, В и R - участвующие в реакции вещества;
а, в и r - стехиометрические коэффициенты;
Q - тепловой эффект реакции.
Принцип Ле Шателье утверждает, что равновесие реакции (1) можно сместить вправо одним из следующих способов: повышением температуры, если а < 0 или понижением температуры, если Q > О, увеличением концентрации А и В, или уменьшением концентрации R, увеличением давления, если объем образующегося вещества R меньше суммы объемов исходных веществ А и В, уменьшением давления, если объем образующегося вещества R больше суммы объемов исходных веществ А и В.
Всякое положение равновесия может быть количественно охарактеризовано величиной константы равновесия (Кр), которую определяют
из следующего соотношения:
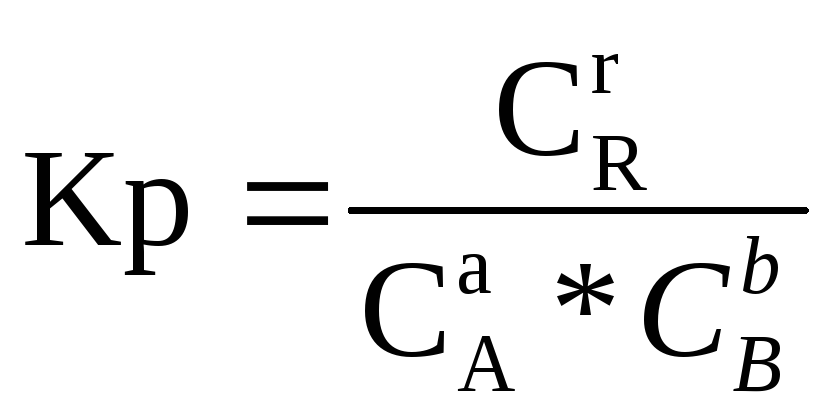
![]() (2)
(2)
где СА, CВ и СR - равновесные концентрации веществ, участвующих в реакции (1),
а, в и r - стехиометрические коэффициенты в уравнении (1).
Зная величину константы равновесия (Кр), можно предсказать, какое количество целевого продукта (R) можно было бы получить из заданного количества исходных веществ А и В по реакции при определенных условиях, т.е. рассчитать равновесный (Хр) или теоретический выход продукта
![]()
![]() (3)
(3)
где Rp - теоретически возможное количество продукта, которое может быть получено из заданного количества исходных веществ при данных условиях;
RM - максимальное количество продукта, которое можно получить из заданного количества исходных веществ, если их полностью превратить в целевой продукт
Наряду с теоретическим выходом продукта пользуются понятием практического выхода (Хп), который определяется отношением фактически полученного количества вещества Rф к Rм, и всегда меньше теоретического для реальных технологических процессов.
