
- •Товароведение химической продукции технического назначения
- •Предисловие
- •Глава 1. Основные понятия химической технологии
- •1 Обще сведения о химико-технологическом процессе
- •1.2 Классификация химико-технологических процессов
- •1.3 Равновесие в химико-технологических процессах
- •1.4 Понятие о скорости химико-технологических процессов
- •1.5 Материальный и энергетический балансы
- •Глава 2. Технология производства и потребительские свойства минеральных кислот
- •2.1 Общие сведения о неорганических кислотах
- •2.2 Технология производства и потребительские свойства серной кислоты
- •2.3 Технология производства и потребительские свойства азотной кислоты
- •2.4 Технология производства и потребительские свойства фосфорной кислоты
- •2.5 Технология производства и потребительские свойства соляной кислоты
- •Глава 3. Технология производства и потребительских свойства минеральных удобрений
- •3.1 Значение минеральных удобрений для нтенсификации сельскохозяйственного производства
- •3.2 Классификация удобрений
- •3.3 Качество минеральных удобрений
- •3.4 Технология производства и потребительские свойства азотных удобрений
- •3.5 Технология производства и потребительские свойства фосфорных удобрений
- •1)Обработка природного фосфата фосфорной кислотой 2) сушка полученной пульны 3) получение пастообразной массы двойного суперфосфатат
- •4)Измельчение двойного муперфосфата 5)классификация двойного суперфосфата
- •3.6 Технология производства и потребительские свойства калийных удобрений
- •1)Измельчение сильвинита 2) обработка сельвинита маточным раствором
- •3) Отделение щелока от осадка NaCl
- •4) Охлаждение щелока 5) выделение кристаллов хлорида калия
- •6) Сушка хлорида калия
- •3.7. Технологии производства и потребительские свойства комплексных удобрений
- •3.7.1. Сложные удобрения.
- •3.8 Упаковка, хранение и транспортировка минеральных удобрений (гост 23954-80)
- •Глава 4. Технология переработки и потребительские свойства продукции топливной промышленности
- •4.1 Общие сведения о топливе, основные характеристики топлива, определяющие его качество
- •4.2 Технология переработки и потребительские свойства продукции переработки твердого топлива
- •4.2.1 Состав, свойства и классификация ископаемых углей
- •4.2.2 Способы переработки твердого топлива
- •4.2.3 Некоторые продукты коксования. Требования к качеству согласно госТам
- •4.2.4 Условия поставки, хранения и транспортировки твердого топлива
- •4.2.5 Перспективы использования твердого топлива
- •4.3 Технология переработки и потребительские свойства продукции переработки жидкого топлива
- •4.3.1 Значение нефти и нефтепродуктов в народном хозяйстве
- •4.3.2 Состав, свойства и классификация нефтей
- •4.3.3 Добыча нефти, подготовка ее к переработке, способы переработки нефти и нефтепродуктов
- •4.3.4 Классификация нефтепродуктов
- •4.3.5 Характеристика моторных топлив. Требования к качеству согласно госТам
- •4.3.6 Котельное топливо. Основные показатели качества согласно госТам
- •4.3.7 Получение товарных бензинов для двигателей внутреннего сгорания
- •4.3.8 Условия поставки, хранения и транспортировки жидкого топлива. Правила безопасности
- •4.3.9 Перспективные виды топлива, альтернативные жидкому
- •4.4 Технология переработки и потребительские свойства газового топлива
- •4.4.1 Состав и свойства газового топлива
- •4.4.2 Правила приема, маркировки, упаковки, транспортировки и хранения газового топлива
- •Глава 5. Основы технологии и потребительские свойства полимерных материалов
- •5.1. Общие сведения о полимерных материалах
- •5.2 Методы синтеза высокомолекулярных соединений.
- •5.3 Технология производства и потребительские свойства пластических масс.
- •5.3.1 Классификация и свойства пластмасс.
- •5.3.2 Полимеризационные пластмассы.
- •5.3.3 Поликонденсационные пластмассы
- •5.4 Технология производства и потребительские свойства каучука и резины.
- •5.4.1 Характеристика важнейших видов каучуков.
- •5.4.2 Резина и изделия на ее основе.
- •5.5 Технология производства и потребительские свойства химических волокон.
- •5.5.1 Полимеризационные волокна.
- •5.5.2 Поликонденсационные волокна.
- •5.6 Области применения полимерных материалов.
2.3 Технология производства и потребительские свойства азотной кислоты
Азотная кислота широко применяется в различных отраслях народного хозяйства, и по объёму производства уступает среди кислот только серной. Это обусловлено её окислительными свойствами и тем, что в состав кислоты входит азот – один из основных питательных элементов растений. До 80% азотной кислоты расходуется в производстве нитратов и минеральных удобрений. Другими важными потребителями кислоты являются производства красителей и взрывчатых веществ, лаков, фармацевтических препаратов, фото- и киноматериалов, серной и фосфорной кислот. Азотная кислота используется как окислитель ракетного топлива, при разделении золота и серебра, в металлургии. В ближайшие годы намечено увеличить производство азотной кислоты в связи с необходимостью увеличения выпуска минеральных удобрений и новых синтетических материалов. Основным источником сырья для производства азотной кислоты служит аммиак, 30-35% которого перерабатывается в азотную кислоту.
Безводная азотная кислота (HNO3) при нормальных условиях представляет собой бесцветную, быстро желтеющую при хранении жидкость плотностью 1500кг/м3 с температурой кипения 830С и кристаллизации – 420С. Азотная кислота легко разлагается при нагревании и на свету по схеме:
4
 HNO3
4 NO2
+ O2
+2 H2О
HNO3
4 NO2
+ O2
+2 H2О
Жёлтая или даже красно-бурая окраска азотной кислоты обусловлена растворённым в ней оксидом азота (IV).
В водных растворах азотной кислоты образуются гидраты состава HNO3*n H2О ( где n = 3,1).
Окислительные свойства азотной кислоты проявляются в том, что под её действием сера превращается в серную кислоту, фосфор – в фосфорную, а многие органические соединения в контакте с азотной кислотой даже воспламеняются. Так, одной капли дымящей азотной кислоты достаточно для воспламенения нагретых древесных опилок. Для азотной кислоты также характерны реакции нитрования органических соединений.
Разбавленная азотная кислота растворяет все металлы за исключением платины, золота, тантала, родия и некоторых других металлов платиновой группы. При этом образуются соответствующие нитраты, оксиды азота и воды.
Концентрированная азотная кислота не действует на железо, хром, алюминий, кальций вследствие пассирования этих металлов. Смесь 1 моля азотной кислоты с 3 молями соляной кислоты называют «царской водкой». В «царской водке» растворимы даже платина и золото.
Разбавленную азотную кислоту с концентрацией до 65% получают по блок-схеме, показанной на рис 3.2. На первой стадии проводят контактное окисление аммиака, затем образующийся оксид азота (II) окисляют до оксида азота (IV), а оксид азота (IV) абсорбируют водой с образованием азотной кислоты.
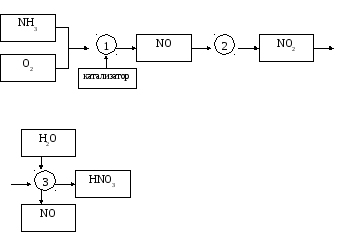
Рис. 3.2. Блок-схема технологического процесса производства азотной кислоты: 1) контактное окисление аммиака; 2) окисление оксида азота (II) в оксид азота (IV); 3) поглощение оксида азота (IV) водой и получение азотной кислоты
Контактное окисление аммиака, протекающее по схеме 4 NH3 + 5O2 = 4NO + 6H2O + Q , может быть осуществлено только при определённых условиях. Такими условиями являются наличие катализатора и определённое время контактирования аммиачно–воздушной смеси с ним, оптимальные температура и давление газовой смечи. Всякое отклонение от оптимальных условий снижает выход оксида азота (II), приводит к образованию наряду с ним других азотосодержащих продуктов (N2O, N2O3,N2 и т.п.). Наиболее эффективным катализатором данного процесса является сплав платины с родием и палладием. Катализатор изготовляют из тонкой проволоки (Ø = 006… 009 мм) в виде сетки (на 1 см2 сетки более 1000ячеек), через которую продувают аммиачно-воздушную смесь. Оптимальной температурой окисления аммиака при атмосферном давлении является 8000С, оптимальное время контактирования смеси с катализатором – 0,0001…0,0002 с.
О кисление
азота (II)
протекает с выделением теплоты и
уменьшением газового объёма, поэтому
оптимальными условиями осуществления
реакции
кисление
азота (II)
протекает с выделением теплоты и
уменьшением газового объёма, поэтому
оптимальными условиями осуществления
реакции
2 NO
+ O2
2NO2
+ Q
являются возможно более высокое
давление и низкая температура.
NO
+ O2
2NO2
+ Q
являются возможно более высокое
давление и низкая температура.
А
 бсорбция
(поглощение) двуокиси азота водой –
конечная стадия производства разбавленной
азотной кислоты – протекает по уравнению
реакции 3NO2
+
H2О
2НNO2
+ NO
+Q3
. Этот процесс, как и окисление NO,
протекает интенсивнее при понижении
температуры и повышении давления.
бсорбция
(поглощение) двуокиси азота водой –
конечная стадия производства разбавленной
азотной кислоты – протекает по уравнению
реакции 3NO2
+
H2О
2НNO2
+ NO
+Q3
. Этот процесс, как и окисление NO,
протекает интенсивнее при понижении
температуры и повышении давления.
В зависимости от применяемого давления установки производства разбавленной азотной кислоты классифицируют на:
Работающие при атмосферном давлении;
работающие при повышенном давлении (до 1 МПа);
комбинированные, в которых окисление аммиака осуществляется при атмосферном давлении, а окисление NO и абсорбция NO2 водой – при повышенном.
Комбинированные установки являются наиболее экономичными и получили наибольшее распространение.
Некоторые потребители нуждаются в азотной кислоте с концентрацией большей, чем 65%. Концентрированную азотную кислоту можно получить двумя методами: концентрированием разбавленной азотной кислоты или прямым синтезом.
При кипячении смеси разбавленной азотной кислоты с концентрированной серной кислотой, серная кислота связывает воду в гидраты состава H2SO4 * nH2O , имеющие температуру кипения значительно более высокую, чем азотная кислота. Пары азотной кислоты отводят и конденсируют путём охлаждения. Этот способ связан с необходимостью использования дорогостоящих коррозионностойких материалов для изготовления аппаратуры, расходом серной кислоты и тепловой энергии для кипячения растворов, поэтому в последнее время более широкое распространение получил метод прямого синтеза концентрированной азотной кислоты. Сущность метода состоит в охлаждении оксида азота (IV) до температуры -80С, при которой NO2 переходит в жидкое состояние с образованием N2O4 , с последующим взаимодействием N2O4 с кислородом и водой при 750С и 5 МПа приводящем к образованию азотной кислоты по реакции
2
 N2O4
+ H2О
+ O2
4НNO3
+Q
N2O4
+ H2О
+ O2
4НNO3
+Q
Качества азотной кислоты регламентируются государственными стандартами, приведенными в таблице 3.2.
Большие количества слабой азотной кислоты (45-60%) хранят и транспортируют в резервуарах из нержавеющей стали, концентрированной – в резервуарах из алюминия. К хранению и транспортированию особо чистой кислоты предназначенной для электронной и радиоэлектронной промышленности, предъявляется целый ряд специфических требований. Так, особо чистую кислоту можно транспортировать только в сосудах из оплавленного кварцевого стекла ёмкостью до 10 л или по согласованию с потребителем во фторопластовых контейнерах большей ёмкости. Закупоренные и маркированные сосуды с кислотой особой чистоты помещают во вторичную транспортную тару из полиэтилена или другого материала, стойкого к действию азотной кислоты. Особо чистая кислота должна храниться в закрытых, тёмных помещениях обособлено от других реактивов при температуре не выше 20-250С.
Таблица 3.2. – Физико-химические свойства азотной кислоты
|
ГОСТ |
Показатели
Сорта азотной кислоты
|
Содержание %, не менее |
Содержание оксидов азота, %, не более |
Содержание остатка после прокаливания, %, не более |
Содержание серной кислоты, %, не более |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
701-88 |
Кислота азотная концентрированная - Марка А |
6 |
0,3 |
0,02 |
0,03 |
|
- Марка Б |
5 |
0,4 |
0,04 |
0,12 | |
|
125-84 |
Кислота азотная особой чистоты, о.с.ч 27-4 |
70 |
0,1 |
4*10-4 |
1*10-4 |
|
- особой чистоты, о.с.ч. 18-4 |
70 |
0,1 |
2*10-4 |
2*10-4 | |
|
- особой чистоты, о.с.ч. 27-5 |
70 |
0,1 |
1*10-4 |
2*10-5 | |
|
4461-77 |
Кислота азотная реактивная, х.ч. |
65(56) |
- |
0,001 |
1*10-4 |
|
- реактивная, ч.д.а. |
65(56) |
- |
0,003 |
5*10-4 | |
|
- реактивная, ч. |
65(56) |
- |
0,005 |
2*10-3 |
