
- •от ХХ УУУУ 20007 г. МГУП
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •ISBN 978-5-7262-0822-0 (т.1)
- •Глава 1. ФИЗИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ
- •Предисловие к тому 1
- •Глава 1. ФИЗИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ
- •1.1. Кристаллическое состояние
- •1.1.3. Решетка и структура кристаллов
- •1.2. Основы кристаллографии
- •1.2.1. Кристаллографические проекции
- •1.2.2. Пространственная решетка
- •1.2.3. Кристаллографические символы
- •1.2.4. Обратная решетка
- •1.2.5. Матрица ортогонального преобразования
- •1.2.6. Преобразование индексов направлений
- •1.3. Симметрия кристаллов
- •1.3.1. Поворотные оси симметрии
- •1.3.2. Инверсионные оси
- •1.3.3. Зеркально-поворотные оси
- •1.3.4. Элементы теории групп
- •1.3.5. Точечные группы симметрии
- •Бравэ
- •Бравэ
- •Распределение ячеек Бравэ по сингониям показано в табл. 1.4.
- •1.3.6. Пространственные группы
- •1.3.7. Предельные группы симметрии
- •1.4. Структура кристаллов
- •1.4.1. Плотнейшие упаковки в структурах
- •1.4.3. Структурные типы соединений типа АВ
- •1.4.4. Структурные типы соединений типа АВ2
- •1.4.5. Структурные типы соединений типа АmВnCk
- •1.4.7. Структура фуллеренов, фуллеритов
- •1.4.8. Структура поверхности
- •1.5. Физические свойства кристаллов
- •1.5.1. Принцип симметрии в кристаллофизике
- •1.5.4. Упругие свойства кристаллов
- •1.6. Кристаллография пластической деформации
- •1.6.1. Геометрия пластической деформации
- •1.6.2. Кристаллографическая текстура
- •1.7. Кристаллография границ зерен
- •1.7.1. Малоугловые границы
- •1.7.2. Высокоугловые границы
- •1.8. Кристаллография мартенситных превращений
- •1.8.1. Морфология мартенситных превращений
- •1.8.2. Кристаллография мартенситных превращений
- •Контрольные вопросы, задачи и упражнения
- •Глава 2. ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
- •2.1. Точечные дефекты
- •2.1.1. Вакансии и межузельные атомы
- •2.1.2. Энергия образования точечных дефектов
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 3. ФИЗИКА ТВЕРДОГО ТЕЛА
- •3.1. Строение атомов и межатомные взаимодействия
- •3.1.1. Классификация конденсированных систем
- •3.1.4. Энергия связи кристаллов
- •3.1.5. Типы связи в твердых телах
- •Металлическая связь. В отличие от ковалентной связи, которая образуется между двумя соседними атомами в результате коллективизации двух валентных электронов, металлическая связь появляется вследствие коллективизации всех валентных электронов. Эти электроны не локализуются у отдельных атомов, а принадлежат всему коллективу атомов. Поэтому они называются свободными электронами, перемещающимися по всему объему металла и в каждый момент времени равномерно распределенными в нем. Классическим подтверждением наличия таких свободных электронов в металлах является опыт Мандельштама и Папалекси, когда при резкой остановке вращающейся катушки, сделанной из металлической проволоки, в ней возникал электрический ток. Ярким подтверждением этому являются высокие электро- и теплопроводность металлов.
- •Ионная связь. Атомы, стоящие в периодической системе Д. И. Менделеева рядом с инертными газами, обладают склонностью принимать их конфигурацию либо путем отдачи, либо путем принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон слабо связан с ядром, так как движется вне заполненного слоя. Поэтому этот электрон может быть легко удален от атома. У галоидов, стоящих непосредственно перед инертными газами, недостает одного электрона для заполнения устойчивого слоя благородного газа. Поэтому галоиды обладают высоким сродством к дополнительному электрону.
- •Изоморфизм и морфотропия. Рассмотрим несколько ионных соединений щелочных металлов с галоидом бромом: LiBr, NaBr, KBr, RbBr и CsBr. Первые четыре соединения имеют решетку типа NaCl, а пятое соединение CsBr кристаллизуется в решетке типа CsCl.
- •3.2. Основы электронной теории кристаллов
- •3.2.1. Квантовая теория свободных электронов
- •3.2.2. Зонная теория металлов
- •3.3. Теория фаз в сплавах
- •3.3.1. Классификация фаз в сплавах
- •3.3.2. Твердые растворы
- •3.3.3. Промежуточные фазы
- •1B3.4. Диффузия и кинетика фазовых превращений
- •2Bв металлах и сплавах
- •4B3.4.1. Линейные феноменологические законы
- •5B3.4.2. Макроскопическое описание явления диффузии
- •6B3.4.3. Атомная теория диффузии в металлах
- •9B3.4.5. Диффузия и фазовые превращения в металлах
- •10Bи сплавах
- •3B3.5. Электрические свойства твердых тел
- •11B3.5.1. Основы электронной теории электропроводности
- •14B3.5.3. Эффект Холла
- •15B3.5.4. Связь электросопротивления со строением сплавов
- •20B3.5.7. Сверхпроводимость
- •3.6. Магнитные свойства твердых тел
- •3.6.1. Основные определения. Классификация веществ по магнитным свойствам
- •3.6.2. Магнитные свойства свободных атомов
- •3.6.3. Физическая природа диамагнетизма
- •3.6.4. Физическая природа парамагнетизма
- •3.6.5. Магнитная восприимчивость слабых магнетиков
- •3.6.6. Основы теории магнитного упорядочения
- •3.6.7. Доменная структура ферромагнетиков
- •3.6.8. Магнитные свойства ферромагнетиков
- •3.6.9. Антиферромагнетики и ферримагнетики
- •3.7. Тепловые свойства твердых тел
- •3.7.2. Теплоемкость кристаллических твердых тел
- •3.7.3. Теплопроводность твердых тел
- •3.7.4. Термическое расширение твердых тел
- •3.8. Упругие свойства твердых тел
- •3.8.1. Основные характеристики упругости
- •3.8.2. Упругость чистых металлов и сплавов
- •3.8.3. Ферромагнитная аномалия упругости
- •3.8.5. Внутреннее трение
- •Контрольные вопросы
- •Список использованной литературы
Значения ионных радиусов для к.ч. = 6, приведенные в таблицах, составленных различными авторами, совпадают в пределах ошибки в ±3%.
Если проследить за такими элементами, как 11Na, 12Mg, 13Al, 14Si, которые следуют один за другим в периодической таблице, то при удалении у них внешних валентных электронов все вновь образовавшиеся катионы приобретают одинаковое электронное строение
– структуру инертного неона. Однако радиусы этих катионов оказываются не одинаковыми. Хотя оболочка этих ионов одна и та же по количеству электронов и их энергетическому состоянию, но размеры ионов различны и уменьшаются с увеличением числа отобранных электронов при ионизации. Это явление объясняется тем, что при увеличении числа отобранных электронов в этих элементах увеличивается заряд ядра. Следовательно, оставшиеся электроны сильнее притягиваются к ядру.
Во всех группах периодической системы радиусы одинаково построенных ионов возрастают с увеличением атомного номера элемента, но за счет лантаноидного сжатия радиусы ионов элементов шестого периода оказываются приблизительно равными радиусам ионов элементов пятого периода.
Изоморфизм и морфотропия. Рассмотрим несколько ионных соединений щелочных металлов с галоидом бромом: LiBr, NaBr, KBr, RbBr и CsBr. Первые четыре соединения имеют решетку типа NaCl, а пятое соединение CsBr кристаллизуется в решетке типа CsCl.
В первых четырех случаях наблюдается явление изоморфизма – сохранение типа структуры при замене одних структурных частиц на другие, химически родственные. Но при переходе от Rb к Cs отмечается изменение типа структуры, наблюдается явление мор-
фотропии.
Геометрическую основу явления морфотропии можно легко увидеть из данных табл. 3.9. Как видно из таблицы, у соединений LiBr, Nabr, KBr и RbBr отношение rк / ra находится в пределах
0,41–0,73, т.е. в тех пределах, когда энергетически и геометрически наиболее выгодно заполнение октаэдрических пустот. Правда, у соединения RbBr это отношение (0,76) находится на пределе и, как будет ясно далее при рассмотрении явления полиморфизма, при
366
определенных условиях в соединении RbBr может наблюдаться изменение структуры.
Таблица 3.9
Геометрическая основа явлений изоморфизма и морфотропии в ионных кристаллах
Ионы |
Ионный |
rк/ra |
Ионы |
Ионный |
rк/ra |
|
радиус, нм |
радиус, нм |
|||||
|
|
|
|
|||
Li+ |
0,078 |
0,40 |
Rb+ |
0,149 |
0,76 |
|
Na+ |
0,098 |
0,50 |
Cs+ |
0,165 |
0,84 |
|
K+ |
0,133 |
0,68 |
Br- |
0,196 |
- |
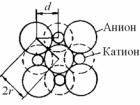
Только для одного, из этих соединений, а именно для CsBr отношение rк / ra = 0,84 , т.е. значительно выше 0,73, поэтому для него
наиболее выгодным является заполнение кубических пустот катионами.
Полиморфизм. Как было отмечено выше, отношение rк / ra для
соединения RbBr лежит выше морфотропного перехода, однако кристалл RbBr при нормальных условиях сохраняет структуру типа NaCl с октаэдрической конфигурацией. Однако под влиянием давления соединение RbBr испытывает полиморфное превращение. Рентгеновские исследования показали, что при высоких давлениях соединение RbBr имеет структуру типа CsCl, т.е. катионы Rb+ уже располагаются в кубических пустотах, а не в октаэдрических. Такая перестройка вызвана тем, что изменение координационного числа от 6 до 8 сопровождается значительным увеличением компактности, от 50 до 68%, при этом объем уменьшается примерно на 15%.
Такого типа полиморфные превращения наблюдаются и в соединениях RbCl, RbI.
Полиморфные превращения в ионных соединениях могут наблюдаться и при изменении температуры. Так, низкотемпературная модификация CsCl имеет структуру типа NaCl, когда катионами Cs+ заполняют-
ся октаэдрические, а не кубические пустоты (рис. 3.39).
367
Это явление объясняется тем, что при изменении температуры радиусы различных ионов в соединении изменяются по-разному и отношение также изменяется. При этом если отношение rк / ra при нормальных условиях было близко к критическому, возможно такое изменение отношенияrк / ra при изменении внешних условий,
что более выгодным будет заполнение пустот другого вида.
Силы Ван-дер-Ваальса. Структуры молекулярных кристал-
лов. Число кристаллов, образованных силами Ван-дер-Ваальса, достаточно велико. Эти силы действуют в кристаллах инертных элементов и в кристаллах, состоящих из насыщенных молекул, которые сами образованы из отдельных атомов с помощью ковалентной связи.
Происхождение сил Ван-дер-Ваальса обусловлено наличием поляризации нейтральных атомов или молекул под действием электрического поля и возникновением дипольных электрических момоентов.
Необходимо отметить, что эта связь самая слабая из всех рассмотренных выше типов химической связи. К примеру, энергия связи атомов в молекуле водорода, которая может характеризоваться энергией диссоциации, равна примерно 4,35 эВ. Для разрушения же кристалла, состоящего из молекул водорода и образованного силами Ван-дер-Ваальса, достаточно затратить теплоту сублимации, которая в 200 раз меньше энергии диссоциации. Однако силы Ван-дер-Ваальса, создающие межмолекулярную связь, являются важнейшими, определяющими свойства вещества в твердом состоянии,
Силы Ван-дер-Ваальса характеризуются тремя эффектами: ори-
ентационным, индукционным и дисперсионным. Все эти эффекты объединяет одно общее качество – электростатическое взаимодействие между собой электрических диполей.
Ориентационный эффект представляет самый простейший вид взаимодействия молекул, имеющих постоянные электрические дипольные моменты. Наличие у молекул, образованных с помощью ковалентной связи, постоянных дипольных моментов легко себе представить, если учесть различную электроотрицательность взаи-
368
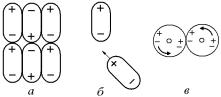
модействующих атомов и часто встречающуюся несимметричность расположения атомов в пространстве. Последнее приводит у таких молекул к появлению некоторой доли ценности связи. Типичным примером такой молекулы может служить молекула аммиака NH3.
Если теперь расположить молекулы так, чтобы отрицательные половины одних диполей находились рядом с положительными половинами других, т.е. если создать упорядоченное правильное чередование диполей, то появится притяжение между молекулами
(рис. 3.40, а).
Рис. 3.40. Эффекты сил Ван-дер-Ваальса: ориентационный (а), индукционный (б) и дисперсионный (в)
Энергия такой кристаллической структуры будет значительно меньше энергии хаотического расположения, а говоря более точно, будет наблюдаться минимум энергии системы.
Второй эффект не имеет самостоятельного значения, он является дополнением к первому и отражает то обстоятельство, что дипольные моменты изолированных молекул меньше дипольных моментов тех же молекул при их попадании в кристаллическую решетку. В последнем случае они находятся в окружении электрических зарядов соседних диполей. Когда же к данному диполю приближается другой электрический заряд, то в силу большой подвижности электронного облака в молекуле наводится (индуцируется) дополнительный дипольный момент, который суммируется с первоначальным (рис. 3.40, б).
Наряду с описанными выше эффектами в молекулярных кристаллах всегда присутствует третий эффект – дисперсионный. Он приобретает основную роль, когда связь Ван-дер-Ваальса образуется между симметричными атомами или молекулами. Так, атомы инертных элементов не образуют молекул и обладают сферически симметричными электронными облаками. Никаких постоянных дипольных моментов у них, конечно, нет. Однако из-за невозможности постоянно поддерживать динамическое строго сферически
369
симметричное расположение электронов в любой момент времени у таких атомов всегда будут существовать мгновенные дипольные моменты (наподобие существования такого момента у простейшего атома – водорода). Если расположить атомы инертных элементов на реальном для кристалла межатомном расстоянии, то энергия такой системы уменьшится при условии, что положение в пространстве мгновенных дипольных моментов во времени будет изменяться одинаково, синхронно (рис. 3.40, в). При этом должно наблюдаться взаимное притяжение атомов.
Дисперсионные силы являются универсальными силами, которые действуют не только между атомами с заполненными оболочками (инертными), но и между любыми атомами, ионами и молекулами. При наличии сильного взаимодействия (химической связи) дисперсионное взаимодействие играет роль небольшой добавки, которая часто не учитывается. В остальных случаях дисперсионное взаимодействие составляет значительную долю общего межмолекулярного взаимодействия, а в случаях, аналогичных взаимодействию атомов инертных элементов, дисперсионные силы являются единственным типом сил притяжения между частицами.
Уже отмечалось, что прочность связей в случае сил Ван-дер- Ваальса невелика по сравнению с другими видами связей. В некоторой степени мерой характеристики сил связи могут служить температуры плавления и кипения. В табл. 3.10 приведены данные по Tпл и Ткип для некоторых инертных элементов.
|
|
|
|
|
|
Таблица 3.10 |
|
|
Температуры плавления и кипения инертных элементов |
||||||
|
|
|
|
|
|
|
|
Элемент |
|
Тпл, °C |
Ткип, °C |
Элемент |
Тпл, °C |
Ткип, °C |
|
|
|
|
|
|
|
|
|
Ne |
|
–248,7 |
–246,3 |
Kr |
–156,9 |
–152,9 |
|
Ar |
|
–189,3 |
–185,6 |
Xe |
–111,8 |
–108,0 |
|
Как видно из данных табл. 3.10, инертные элементы имеют очень низкие температуры плавления и кипения, что подтверждает слабость связи в кристаллах этих элементов. Следует также отметить, что при переходе от неона к ксенону Тпл и Ткип заметно повы-
370
