
- •от ХХ УУУУ 20007 г. МГУП
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •ISBN 978-5-7262-0822-0 (т.1)
- •Глава 1. ФИЗИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ
- •Предисловие к тому 1
- •Глава 1. ФИЗИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ
- •1.1. Кристаллическое состояние
- •1.1.3. Решетка и структура кристаллов
- •1.2. Основы кристаллографии
- •1.2.1. Кристаллографические проекции
- •1.2.2. Пространственная решетка
- •1.2.3. Кристаллографические символы
- •1.2.4. Обратная решетка
- •1.2.5. Матрица ортогонального преобразования
- •1.2.6. Преобразование индексов направлений
- •1.3. Симметрия кристаллов
- •1.3.1. Поворотные оси симметрии
- •1.3.2. Инверсионные оси
- •1.3.3. Зеркально-поворотные оси
- •1.3.4. Элементы теории групп
- •1.3.5. Точечные группы симметрии
- •Бравэ
- •Бравэ
- •Распределение ячеек Бравэ по сингониям показано в табл. 1.4.
- •1.3.6. Пространственные группы
- •1.3.7. Предельные группы симметрии
- •1.4. Структура кристаллов
- •1.4.1. Плотнейшие упаковки в структурах
- •1.4.3. Структурные типы соединений типа АВ
- •1.4.4. Структурные типы соединений типа АВ2
- •1.4.5. Структурные типы соединений типа АmВnCk
- •1.4.7. Структура фуллеренов, фуллеритов
- •1.4.8. Структура поверхности
- •1.5. Физические свойства кристаллов
- •1.5.1. Принцип симметрии в кристаллофизике
- •1.5.4. Упругие свойства кристаллов
- •1.6. Кристаллография пластической деформации
- •1.6.1. Геометрия пластической деформации
- •1.6.2. Кристаллографическая текстура
- •1.7. Кристаллография границ зерен
- •1.7.1. Малоугловые границы
- •1.7.2. Высокоугловые границы
- •1.8. Кристаллография мартенситных превращений
- •1.8.1. Морфология мартенситных превращений
- •1.8.2. Кристаллография мартенситных превращений
- •Контрольные вопросы, задачи и упражнения
- •Глава 2. ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
- •2.1. Точечные дефекты
- •2.1.1. Вакансии и межузельные атомы
- •2.1.2. Энергия образования точечных дефектов
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 3. ФИЗИКА ТВЕРДОГО ТЕЛА
- •3.1. Строение атомов и межатомные взаимодействия
- •3.1.1. Классификация конденсированных систем
- •3.1.4. Энергия связи кристаллов
- •3.1.5. Типы связи в твердых телах
- •Металлическая связь. В отличие от ковалентной связи, которая образуется между двумя соседними атомами в результате коллективизации двух валентных электронов, металлическая связь появляется вследствие коллективизации всех валентных электронов. Эти электроны не локализуются у отдельных атомов, а принадлежат всему коллективу атомов. Поэтому они называются свободными электронами, перемещающимися по всему объему металла и в каждый момент времени равномерно распределенными в нем. Классическим подтверждением наличия таких свободных электронов в металлах является опыт Мандельштама и Папалекси, когда при резкой остановке вращающейся катушки, сделанной из металлической проволоки, в ней возникал электрический ток. Ярким подтверждением этому являются высокие электро- и теплопроводность металлов.
- •Ионная связь. Атомы, стоящие в периодической системе Д. И. Менделеева рядом с инертными газами, обладают склонностью принимать их конфигурацию либо путем отдачи, либо путем принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон слабо связан с ядром, так как движется вне заполненного слоя. Поэтому этот электрон может быть легко удален от атома. У галоидов, стоящих непосредственно перед инертными газами, недостает одного электрона для заполнения устойчивого слоя благородного газа. Поэтому галоиды обладают высоким сродством к дополнительному электрону.
- •Изоморфизм и морфотропия. Рассмотрим несколько ионных соединений щелочных металлов с галоидом бромом: LiBr, NaBr, KBr, RbBr и CsBr. Первые четыре соединения имеют решетку типа NaCl, а пятое соединение CsBr кристаллизуется в решетке типа CsCl.
- •3.2. Основы электронной теории кристаллов
- •3.2.1. Квантовая теория свободных электронов
- •3.2.2. Зонная теория металлов
- •3.3. Теория фаз в сплавах
- •3.3.1. Классификация фаз в сплавах
- •3.3.2. Твердые растворы
- •3.3.3. Промежуточные фазы
- •1B3.4. Диффузия и кинетика фазовых превращений
- •2Bв металлах и сплавах
- •4B3.4.1. Линейные феноменологические законы
- •5B3.4.2. Макроскопическое описание явления диффузии
- •6B3.4.3. Атомная теория диффузии в металлах
- •9B3.4.5. Диффузия и фазовые превращения в металлах
- •10Bи сплавах
- •3B3.5. Электрические свойства твердых тел
- •11B3.5.1. Основы электронной теории электропроводности
- •14B3.5.3. Эффект Холла
- •15B3.5.4. Связь электросопротивления со строением сплавов
- •20B3.5.7. Сверхпроводимость
- •3.6. Магнитные свойства твердых тел
- •3.6.1. Основные определения. Классификация веществ по магнитным свойствам
- •3.6.2. Магнитные свойства свободных атомов
- •3.6.3. Физическая природа диамагнетизма
- •3.6.4. Физическая природа парамагнетизма
- •3.6.5. Магнитная восприимчивость слабых магнетиков
- •3.6.6. Основы теории магнитного упорядочения
- •3.6.7. Доменная структура ферромагнетиков
- •3.6.8. Магнитные свойства ферромагнетиков
- •3.6.9. Антиферромагнетики и ферримагнетики
- •3.7. Тепловые свойства твердых тел
- •3.7.2. Теплоемкость кристаллических твердых тел
- •3.7.3. Теплопроводность твердых тел
- •3.7.4. Термическое расширение твердых тел
- •3.8. Упругие свойства твердых тел
- •3.8.1. Основные характеристики упругости
- •3.8.2. Упругость чистых металлов и сплавов
- •3.8.3. Ферромагнитная аномалия упругости
- •3.8.5. Внутреннее трение
- •Контрольные вопросы
- •Список использованной литературы
U = 1 ∑∑N N (Uik ) , 2 i =1 k =1
где Uik – парные потенциалы межатомного взаимодействия в кристаллической системе с числом частиц N.
3.1.5. Типы связи в твердых телах
Классификация кристаллических твердых тел и химической связи. Нет строго однозначного определения типов твердых тел. Но все же, основываясь на физических, химических, электрических, магнитных и других свойствах, кристаллические твердые тела можно разделить на четыре типа: металлы, ионные кристаллы, валентные кристаллы и молекулярные кристаллы.
Отметим бегло только основные, самые характерные свойства названных типов твердых тел. Более подробное рассмотрение будет проведено далее.
Металлы образуются из атомов электроположительных элементов, обладают большими пластичностью, теплопроводностью и электропроводностью. Переносчиками электричества в них являются электроны. Металлы непрозрачны и имеют металлический блеск. Температуры плавления лежат в широких пределах.
Ионные кристаллы образуются сочетанием сильно электроположительных и электроотрицательных элементов. Они обладают ионной проводимостью, которая увеличивается с повышением температуры в связи с возрастанием диффузионной подвижности. Свободных электронов в них нет, поэтому они прозрачны.
Валентные кристаллы образуются легкими элементами средних столбцов периодической системы. Ионная проводимость в них отсутствует. Как правило, отсутствует и электронная проводимость, но при повышении температуры некоторые кристаллы приобретают полупроводниковые свойства. Они имеют сравнительно большую твердость и хрупкость, в большинстве прозрачны.
Молекулярные кристаллы – это твердые тела, которые образованы атомами инертных элементов или насыщенными молекулами. Они обладают низкими температурами плавления и кипения, испа-
332
ряются в виде устойчивых молекул, не обладают электропроводностью.
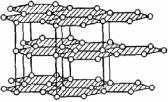
Условность делений всех твердых тел на четыре типа можно подтвердить тем, что существуют вещества, которые нельзя строго отнести только к одному типу. Примером такого вещества является графит. Как видно из рис. 3.17, графит имеет слоистое строение.
В каждом слое ближайшие расстоя- |
|
|
ния между атомами углерода равны |
|
|
0,141 нм, причем каждый атом в одном |
|
|
слое имеет трех соседей. Таким обра- |
|
|
зом, как и в валентном кристалле, у |
|
|
атома углерода насыщаются только |
|
|
три связи из четырех. Эти три связи |
Рис. 3.17. Кристаллическая |
|
создают как бы огромную однослой- |
структура графита |
|
ную молекулу. Сами слои – молекулы |
||
|
– сдвинуты относительно друг друга на половину периода и связаны между собой в некоторой степени так же, как в молекулярных кристаллах связываются насыщенные молекулы. С помощью четвертого свободного электрона связь между слоями получается аналогичной связи в металлах. Необходимо иметь в виду, что слои отстоят друг от друга на очень больших расстояниях 0,34 нм. Поэтому в свойствах графита отмечается сильная межатомная связь в каждом слое и слабая связь между слоями. Графит имеет металлический блеск и обладает электронной проводимостью.
Аналогично классификации твердых тел современные представления о природе химической связи позволяют условно все виды связи разделить также на четыре типа:
-ковалентная связь – гомеополярная, так как образуется между электроотрицательными атомами («–» c «–»);
-металлическая связь – гомеополярная связь, образующаяся между электроположительными атомами («+» c «+»);
-ионная связь, когда электроположительные атомы соединяются
сэлектроотрицательными, т.е. гетерополярная связь (упрощенно ее можно обозначить: «+» c «–»);
-силы Ван-дер-Ваальса, когда связываются инертные атомы или насыщенные молекулы(«0» c «0»).
333
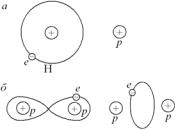
Ковалентная связь. Типичным примером проявления ковалентной связи является образование молекулы водорода. Однако предварительно сугубо качественно рассмотрим, как образуется положительный ион молекулы водорода. Такие ионы существуют в природе, они обнаружены масс-спектрометрически. Если сближать
атом водорода и протон (рис. 3.18, a), то на сравнительно больших расстояниях (5 нм) никакого взаимодействия между ними не отмечается. Но уже при сближении на расстояние 0,2 нм будет происходить интенсивный обмен электроном между двумя протонами. При установлении равновесного расстояния 0,106 нм единственный электрон в ионе молекулы водорода оказывается обобществленным. Можно представить движение электрона в ионе схематически, как показано на рис. 3.18, б.
Конечно, четкие орбиты, изображенные на этом рисунке, являются лишь схемой. На самом же деле можно говорить лишь о вероятности нахождения электрона, о плотности электронного облака. Главный же вывод заключается в том, что электрон находится в основном между протонами, электронное облако как бы втянуто в пространство между протонами и этим самым связывает два протона в ион молекулы водорода. При этом распределение электронной плотности имеет такой характер, что по своему действию на электрон ни одно из ядер не имеет преимущества перед другим.
Точно так же можно рассматривать образование молекулы водорода. Известно, что Нильс Бор представлял строение молекулы водорода, как показано на рис. 3.18, б, только на круговой серединной орбите в противоположных местах должны находиться два электрона. Следовательно, ковалентная связь является парной, в ее образовании участвует пара электронов – по одному от каждого атома. В результате этого в области пространства между ядрами концентрируется высокая электронная плотность.
334
Более корректно все выводы о сущности ковалентной связи можно сделать при рассмотрении решений уравнения Шредингера, т.е. с точки зрения квантовой теории. Точного решения уравнения Шредингера для молекул не существует, поэтому здесь в еще большей степени, чем при рассмотрении многоэлектронных атомов, необходимо использовать приближенные методы.
Рассмотрим примеры образования молекул с ковалентной связью. Молекула F2 так же, как и молекула водорода, – двухатомная, но в отличие от последней двойная электронная связь в молекуле
фтора образуется путем взаимодействия пары 2p-электронов. Если воспользоваться представлениями о квантовых ячейках, то
связь в молекуле водорода, осуществляемая с помощью 1s-элект- ронов, будет выглядеть, как показано на рис. 3.19, а.
Рис. 3.19. Образование молекул H2 (а) и F2 (б) с ковалентными связями
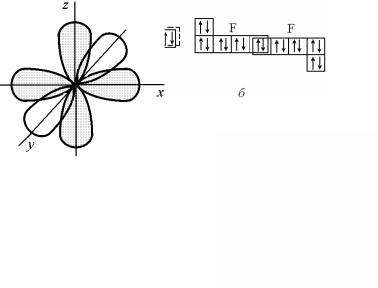
Аналогично в молекуле F2 связь образуется с помощью 2p- электронов. Как видно из рис. 3.19, б, обобществление двух электронов (по одному от каждого атома) происходит в 2p- ячейках с ml = –1. Схематически угловая часть электронного облака 2p- состояния атома фтора, которая характеризует «форму» атома, может быть изображена в виде полярной диаграммы (рис. 3.20), на которой не показаны полностью занятые 1s- и 2s-состояния со сферической симметрией электронного облака.
Участвовать в образовании связи может только одна «гантель», расположенная вдоль оси y. Поэтому при образовании молекулы F2
335
два атома фтора должны сближаться вдоль оси y (в этом проявляется направленность связи), имея при ml = –1 электроны с противоположными спинами (рис. 3.21, а). Во вновь образованной молекуле фтора, в которой произошло перераспределение электронной плотности, большая часть электронного облака оказалась втянутой в пространство между ядрами.
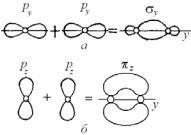
Молекула O2. При образовании
молекул H2 и F2 молекулярные волновые функции, образованные двумя s- или двумя py-функциями, обладают аксиальной симметрией, и плотность валентных электронов в этом случае максимальна на оси молекулы (см. рис. 3.21, а). Существенно иное распределение электронной плотности получается при взаимодействии двух атомов кисло-
рода, в которых, кроме двух py-электронов, дающих перекрывание орбиталей, подобное F2, взаимодействуют два px- или pz-электрона. Угловые части электронной плотности последних имеют форму гантелей, оси которых направлены перпендикулярно к оси молекулы O2 (рис. 3.21, б). В этом случае образуются две области перекрывания, расположенные по обе стороны от линии, соединяющей ядра атомов, и максимум электронной плотности находится не на оси молекулы, а по обе стороны от нее.
Связи, для которых электронная плотность концентрируется вдоль оси молекул, называются σ-связями, а если электронная плотность концентрируется перпендикулярно оси молекул, то π-
связями. При взаимодействии атомов в первую очередь образуются σ-связи, а затем дополнительно одна или две π-связи в зависимости от числа валентных электронов. Соответствующие связи называются двойными или тройными; простые σ-связи называются одинарными. В образовании одинарной связи участвуют два электрона, двойной связи – четыре и тройной связи – шесть электронов.
Молекулы H2, F2, O2, образованные одинаковыми атомами, называются гомонуклеарными. Связь в таких, молекулах чисто ковалентная.
336
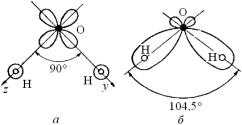
Молекула H2O – гетеронуклеарная, так как состоит из разноименных атомов. Как было показано на рис. 3.12, у атома кислорода имеется две 2p-ячейки, каждая из которых занята только наполовину, т.е. только одним электроном. Эта две наполовину занятых 2p-ячейки можно изобразить с помощью полярной диаграммы в виде двух гантелей, расположенных вдоль осей y и z (рис. 3.22, а). Если вдоль этих осей приближать к кислороду два атома водорода с электронами, находящимися в сферически симметричном 1s- состоянии, то в результате образуется молекула воды, у которой в каждой объединенной квантовой ячейке находится по два обобществленных электрона с противоположно направленными спинами
(рис. 3.22, б).
Рис. 3.22. Образование молекулы H2O:
распределение электронной плотности изолированных атомов Н и O (а) и атомов
вмолекуле (б)
Врезультате перераспределения электронного облака максимальная электронная плотность будет располагаться между ядрами кислорода и водорода, т.е. электронный заряд отойдет от атомов водорода. Поэтому водородные концы молекулы окажутся электроположительными, а кислородная часть – электроотрицательной.
Ктому же необходимо учитывать, что кислород по шкале электроотрицательностей более электроотрицателен, чем водород. Все это приводит к появлению у молекулы воды постоянного дипольного момента. Отталкивание положительных водородных концов моле-
кулы вызывает увеличение валентного утла от 90 до 104,5 °С В молекуле воды атом кислорода занимает доминирующее по-
ложение и связан с двумя атомами водорода. Длина связей O-H равна 0,107 нм, что примерно равно сумме ковалентных радиусов атомов кислорода rО и водорода rH: rО + rH = 0,066 нм + 0,037 нм = =0,103 нм. Расстояние между ядрами водорода (протонами) в молекуле воды составляет примерно 0,16 нм, что более чем в два раза,
337
превышает соответствующее расстояние в молекуле водорода, где длина связи H-H равна 0,074 нм. Эти результаты показывают, что в молекуле воды между ядрами водорода нет непосредственного взаимодействия, подобного взаимодействию между водородом и кислородом. Основную роль в молекуле воды играют связи O-H.
Таким образом, можно заключить, что многоатомные молекулы следует рассматривать как системы, образованные совокупностью отдельных связей, т.е. в многоатомных молекулах можно выделить атомы, непосредственно связанные друг с другом (например, связи O-H в H2O) и не связанные (связи H-H в той же молекуле).
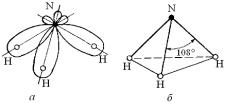
Молекула NH3. Как известно, в атоме азота имеется три наполовину занятые 2p-ячейки (см. рис. 3.12). Поэтому, направленно приближая три атома водорода вдоль трех координатных осей, можно получить молекулуаммиака(рис. 3.23, а).
Рис. 3.23. Образование молекулы NH3:
а – перекрытие электронных облаков;
б – структура связей N–H
В этой молекуле происходит перераспределение электронной плотности из-за перекрывания электронных облаков при взаимодействии атомовазота иводорода, максимумэлектроннойплотностирасполагается между ядрами азота и водорода (ближе к азоту). Поэтому в молекуле NH3, так же как и в молекуле H2O, из-за образования диполей на связях N-H с положительным концом на водороде происходит отталкивание между водородными частями, и поэтому угол между связями N-H приазотной вершине тетраэдра не 90, а 108° (рис. 3.23, б).
Молекула ZnCl2. В отличие от предыдущих примеров, когда отдельные атомы при создании молекулы образовывали связи с помощью электронов только одного типа (только s- или только p - электронов), в случае молекулы ZnCl2 появляется совершенно иная ситуация. У атома Zn химическая активность обнаруживается только в возбужденном состоянии, т.е. тогда, когда в отличие от основного состояния у цинка один валентный электрон находится в
338
4s-ячейке, а второй – в 4p-ячейке. Хлор, как и фтор, имеет один неспаренный электрон в 3p-ячейке. Следовательно, из двух связей Zn-Cl в молекуле формально одна связь должна быть (3p-4s)-типа,
авторая – (3p-4p)-типа, что должно приводить к возможной неравноценности этих связей. Известно, что s-электрон образует более слабую вязь, чем p-электрон. Однако опытные данные не подтверждают неэквивалентность этих связей. Отсюда следует одинаковость состояний для обоих валентных электронов в возбужденном состоянии атома цинка.
Этот факт в квантово-механической теории химической связи получает следующее истолкование. В валентном состоянии атома, отвечающем возбужденному электронному sp-состоянию, каждый из двух валентных электронов находится не в s- или в p-состоянии,
ав смешанном или так называемом гибридном состоянии, получающемся из этих состояний. Это гибридное состояние описывается волновой функцией, представляющей собой линейную комбинацию функций, отвечающих s- и p-состояниям.
Расчет показывает, что гибридные функции обеспечивают наибольшее перекрывание электронных облаков и, следовательно, наибольшую прочность связи. В общем случае каждая гибридная
функция ψi и ψk должна быть нормирована, т.е. ∫ψi2dV =1: для этих функций должны соблюдаться условия ортогональности ( ∫ψiψk dV = 0 ) и эквивалентности.
Таким образом, гибридные электронные функции – это волновые функции, образованные из функций разного типа и удовлетворяющие условию эквивалентности.
Конкретно в случае sp-гибридизации орбит (для Zn) теоретический подсчет демонстрирует, что обе гибридные волновые функции имеют одинаковое распределение электронной плотности; угол между связями равен 180°, что объясняет линейную форму молекул типа ZnCl2 и эквивалентность обеих связей Cl-Zn-Cl.
Между прочим, линейный характер молекулы, образованной гибридными sp-связями, можно объяснить самыми простыми соображениями: р-состояние образует связь вдоль одной из координатных осей, а сферическая симметрия s-состояния позволяет второму
339

атому хлора в силу электростатического отталкивания максимально удаляться от первого; после получения такой линейной формы молекулы создается полная эквивалентность двух гибридных sp- состояний, их неразличимость.
Молекула GaCl3. Галлий – трехвалентный элемент, имеющий в возбужденном состоянии один электрон в 4s-состоянии и два электрона в 4p-состоянии. При образовании молекулы GaCl3 также имеет место гибридизация орбит валентных электронов галлия 4s- и 4p-состояния. Три гибридные sp2-связи галлия равномерно распределены на плоскости и образуют друг с другом валентные углы в 120° связи от атома галлия, расположенного в центре равностороннего треугольника (рис. 3.24), направлены к его вершинам, где располагаются атомы хлора.
|
|
|
|
Рис. 3.24. Схема молекулы GaCl3 |
Рис. 3.25. Схема молекулы CH4 |
||
Молекула CH4. В состоянии с наинизшей энергией углерод двухвалентен (см. рис. 3.12), в возбужденном – четырехвалентен с четырьмя гибридными волновыми функциями sp3-электронов. Форма молекулы показана на рис. 3.25.
Прочность гибридных sp3-связей больше прочности всех рассмотренных выше гибридных связей.
Структуры валентных кристаллов. Координационное число в кристаллах (к.ч. – см. п. 1.4), образованных ковалентной связью, подчиняется правилу октета или правилу 8 – N. Здесь N – номер группы периодической системы элементов, а число 8 равно электронной емкости (s-p)-ячеек. Таким образом, 8 – N – это число возможных неспаренных электронов у одного атома, т.е. число атомов, с которыми данный атом должен быть связан для того, чтобы
340
произошло насыщение его валентностей. Правило 8 – N справедливо только в том случае, если рассматриваемый кристалл образуется исключительно путем создания нормальных ковалентных связей.
VII группа периодической системы. Типичным представителем
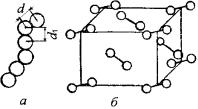
VII группы является йод (I). Координационное число для элементов VII группы, связанных ковалентной связью, равно 8 – N = 1. Каждый атом йода имеет одного соседа, с которым связан ковалентной связью. Атом йода имеет один неспаренный электрон на 5p- оболочке и, следовательно, пара атомов иода образует насыщенную молекулу с ковалентной связью. Эта молекулы образуют цепочки, в которых связь между насыщенными молекулами I2 образована силами Ван-дер-Ваальса (рис. 3.26, a).
Рис. 3.26. Образование валентных кристаллов галоидов:
а– цепочка молекул;
б– кристаллическая структура
На рисунке d = 0,266 нм – расстояние между атомами в молекуле I2; d1 = 0,44 нм– расстояние между насыщенными молекулами I2; оно значительно больше d. Такого рода цепочки образуют кристаллы. Кристаллы галоидов, в том числе и йода – ромбические гранецентрированные (рис. 3.26, б).
VI группа периодической системы. Для элементов VI группы,
связанных ковалентной связью, к.ч. = 2. Типичными представителями этой группы являются селен, теллур и сера.
В твердых селене и теллуре атомы располагаются в форме своеобразной винтовой цепочки, в которой каждый атом участвует в образовании электронных пар с двумя ближайшими соседями, находящимися от него на равных расстояниях.
Одна атомная цепочка представлена на рис. 3.27, а. Здесь α – валентный угол. У селена α = 105°, а у теллура α = 102 °.
Атомные цепочки такого вида представляют собой насыщенные молекулы и между собой связаны силами Ван-дер-Ваальса. Кри-
341
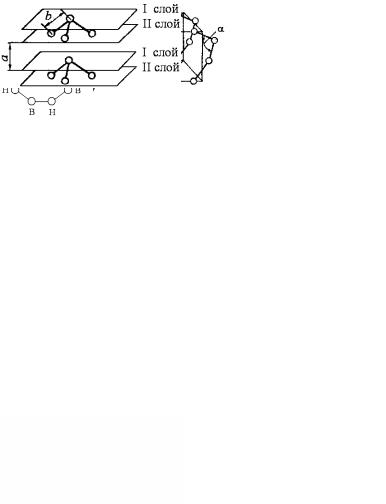
сталлические селен и теллур образуют гексагональную сингонию и имеют строение, показанное на рис 3.27, б.
У серы в отличие от селена и теллура цепочка атомов, связанных ковалентной связью, не бесконечная, а замкнутая, состоящая из 8 атомов (рис. 3.28).
|
|
|
|
Рис. 3.27. Образование валентных |
|
|
|
|
|
|
|
кристаллов Se и Te: |
Рис. 3.28. Схема молекулы S8 |
||
а – атомная цепочка; б – кристаллическая |
(вид сбоку и сверху) |
||
структура |
|
|
|
Молекулы серы насыщенные и в кристалле связаны между собой силами Ван-дер-Ваальса. Расстояние между атомами в молекуле 0,208 нм. Одна молекула от другой отстоит на расстоянии 0,36 нм. На одну элементарную ячейку кристаллической серы приходится 16 молекул, т.е. 128 атомов.
V группа периодической системы. Для элементов V группы,
имеющих ковалентную связь, к.ч. = 3. Представителями V группы являются мышьяк, сурьма и висмут. Эти элементы имеют три неспаренных электрона на p-оболочках, которые образуют три ковалентные связи, направленные по ребрам трехгранной пирамиды, что приводит к образованию слоистых кристаллов мышьяка, сурьмы, висмута, построенных из сдвоенных атомных слоев такого ти-
па (рис. 3.29).
Рис. 3.29. Образование валентных кристаллов As, Sb, Bi
Мышьяк, сурьма и висмут имеют ромбоэдрическую кристаллическую структуру. Кристаллы состоят из двухслойных бесконечных насыщенных молекул, в которых каждый атом посредством ковалентной связи присоединяется к трем своим соседям, находящимся во втором слое на
342
равном расстоянии b от атома. Двухслойные молекулы удерживаются вместе силами Ван-дер-Ваальса. Расстояние между молекулами определяется величиной a. Количест-венные данные параметров a и b для мышьяка, сурьмы и висмута приведены в табл. 3.2.
Таблица 3.2
Расстояния между молекулами и слоями в двухслойных упаковках мышьяка, сурьмы, висмута
Элемент |
a, нм |
b, нм |
b/a |
|
|
|
|
As |
0,315 |
0,251 |
0,08 |
Sb |
0,337 |
0,287 |
0,085 |
Bi |
0,347 |
0,310 |
0,09 |
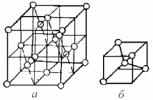
IV группа периодической системы. Для элементов четвертой группы к.ч. = 4. Представителями IV группы являются германий, кремний, олово и алмаз. Эти элементы имеют четыре валентных электрона и могут образовывать четыре ковалентных связи с соседними атомами. Типичной решеткой для этой группы кристаллов является решетка алмаза. Кристалл алмаза имеет кубическую симметрию. Строится элементарная ячейка алмаза следующим образом
(рис. 3.30, а). |
|
Большой куб делится на 8 частей. Из |
|
большого куба атомами углерода стро- |
|
ится решетка ГЦК. В центры четырех |
|
малых кубиков из восьми (через один) |
|
помещаются также атомы углерода. По- |
|
лученная структура может быть описана |
Рис. 3.30. Структура кристалла |
как объемноцентрированное тетраэдри- |
|
ческое расположение атомов, в котором |
алмаза (а) и одного из четырех |
малых кубиков с центральным |
|
любой атом углерода занимает центр |
атомом углерода (б) |
тетраэдра и связан с каждым из четырех |
|
других атомов углерода, расположенных по его углам. Это хорошо видно, если выделить 1/8 элементарной ячейки (рис. 3.30, б).
Алмаз – это структура типичного валентного кристалла. Других связей, кроме ковалентных, в алмазе нет.
Кремний, германий, серое олово, атомы которых в кристаллах связаны ковалентной связью, также имеют структуру алмаза.
343
