
- •Глава 1. Развитие представлений о природе теплоты
- •§ 1.1. Физика и механика
- •Что дает механика Ньютона?
- •Физика во времена Ньютона
- •Механическая картина мира
- •Крах механической картины мира
- •Тепловые и электромагнитные явления
- •§ 1.2. Тепловые явления
- •Роль тепловых явлений
- •Свойства тел и температура
- •Тепловые процессы и строение вещества
- •Тепловые явления в технике
- •§ 1.3. Краткий очерк развития представлений о природе тепловых явлений
- •Воззрения древних
- •Зарождение научной теории тепла
- •Теория теплорода
- •Крах теории теплорода
- •§ 1.4. Термодинамика и молекулярно-кинетическая теория Термодинамика
- •Молекулярно-кинетическая теория
- •Термодинамика и статистическая механика
- •Глава 2. Основы молекулярно-кинетической теории
- •§ 2.1. Основные положения молекулярно-кинетической теории
- •Доказательства существования молекул
- •Туннельный микроскоп
- •Размеры атомов и молекул
- •Число молекул
- •§ 2.2. Масса молекул. Постоянная Авогадро
- •Масса молекулы воды
- •Относительная молекулярная масса
- •Количество вещества
- •Постоянная Авогадро
- •Молярная масса
- •§ 2.3. Броуновское движение
- •Тепловое движение молекул
- •Модель броуновского движения
- •Наблюдение броуновского движения
- •Объяснение броуновского движения
- •Броуновское движение и измерительные приборы
- •§ 2.4. Силы взаимодействия молекул
- •Молекулярные силы
- •Электромагнитная природа молекулярных сил
- •Ориентационные силы
- •Индукционные (поляризационные) силы
- •Дисперсионные силы
- •Силы отталкивания
- •График зависимости молекулярных сил от расстояния между молекулами
- •Происхождение сил упругости
- •Атомно-силовой микроскоп
- •§ 2.5. Потенциальная энергия взаимодействия молекул
- •Зависимость потенциальной энергии от расстояния между молекулами
- •Главная задача
- •Движение частицы в пространстве с заданной потенциальной энергией
- •§ 2.6. Строение газообразных, жидких и твердых тел
- •Жидкости
- •Твердые тела
- •§ 2.7. Примеры решения задач
- •Упражнение 1
- •Глава 3. Температура. Газовые законы
- •§ 3.1. Состояние макроскопических тел в термодинамике
- •Макроскопические параметры
- •Давление газа в молекулярно-кинетической теории
- •§ 3.2. Температура. Тепловое равновесие
- •Субъективные представления о температуре
- •Происхождение терминов «температура» и «градус»
- •Первые термометры
- •Современные термометры
- •Тепловое равновесие
- •Температура
- •Молекулярно-кинетическое истолкование температуры
- •§ 3.3. Уравнение состояния
- •§ 3.4. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •§ 3.5. Газовые законы. Закон Бойля-Мариотта
- •Газовые законы
- •Закон Бойля—Мариотта
- •Молекулярно-кинетическое истолкование закона Бойля—Мариотта
- •§ 3.6. Закон Гей-Люссака. Идеальный газ
- •Закон Гей-Люссака
- •Экспериментальное определение зависимости объема газа от температуры
- •Изобары
- •Идеальный газ
- •Газовая шкала температур
- •§ 3.7. Абсолютная температура
- •Абсолютный нуль температуры
- •Шкала Кельвина
- •Зависимость объема от абсолютной температуры
- •§ 3.8. Законы Авогадро и Дальтона
- •Закон Авогадро
- •Закон Дальтона
- •§ 3.9. Уравнение состояния идеального газа
- •Уравнение состояния
- •Изменение состояния газа
- •Вывод уравнения состояния идеального газа
- •Универсальная газовая постоянная
- •Уравнение Менделеева—Клапейрона
- •§ 3.10. Закон Шарля. Газовый термометр
- •Закон Шарля
- •Газовый термометр постоянного объема
- •§ 3.11. Применение газов в технике
- •Управление давлением газа
- •Большая сжимаемость газов
- •Зависимость объема газа от температуры
- •Разреженные газы
- •§ 3.12. Примеры решения задач
- •Разделив почленно уравнение (3.12.4) на уравнение (3.12.5), получим
- •При этом
- •Упражнение 2
- •Глава 4. Молекулярно-кинетическая теория идеального газа
- •§ 4.1. Системы с большим числом частиц и законы механики. Статистическая механика
- •Термодинамические параметры с микроскопической точки зрения
- •Системы из большого числа частиц и законы механики
- •Статистическая механика
- •Средние по времени и статистические средние
- •Два этапа становления статистической механики (молекулярно-кинетической теории)
- •§ 4.2. Идеальный газ в молекулярно-кинетической теории
- •Идеальный газ
- •Значение столкновений между молекулами
- •§ 4.3. Среднее значение скорости теплового движения молекул
- •Средние значения
- •Среднее значение квадрата скорости
- •§ 4.4. Основное уравнение молекулярно-кинетической теории
- •Столкновение молекулы со стенкой
- •Число соударений со стенкой молекул, скорости которых близки к VIX
- •Импульс средней силы, действующий на стенку со стороны всех молекул
- •Давление газа
- •§ 4.5. Температура— мера средней кинетической энергии молекул
- •Постоянная Больцмана
- •Физический смысл постоянной Больцмана
- •Зависимость давления газа от концентрации его молекул и температуры
- •§ 4.6. Распределение максвелла
- •Вероятность случайного события
- •Распределение молекул по скоростям — распределение Максвелла
- •Распределение модулей скоростей молекул
- •Наиболее вероятная скорость молекул
- •Роль быстрых молекул
- •§ 4.7. Измерение скоростей молекул газа
- •Средняя скорость теплового движения молекул
- •Экспериментальное определение скоростей молекул
- •Средняя скорость броуновской частицы
- •§ 4.8. Внутренняя энергия идеального газа
- •Внутренняя энергия молекулярных газов
- •§ 4.9. Примеры решения задач
- •Упражнение 3
- •Глава 5. Законы термодинамики
- •§ 5.1. Работа в термодинамике
- •Работа в механике и термодинамике
- •Вычисление работы
- •Геометрическое истолкование работы
- •§ 5.2. Количество теплоты
- •Калориметрические опыты
- •Количество теплоты. Уравнение теплового баланса
- •Теплоемкость
- •§ 5.3. Эквивалентность количества теплоты и работы
- •Опыты Джоуля
- •Механический эквивалент теплоты
- •§ 5.4. Закон сохранения энергии. Внутренняя энергия
- •Закон сохранения энергии
- •Внутренняя энергия
- •Зависимость внутренней энергии от макроскопических параметров
- •§ 5.5. Первый закон термодинамики
- •Первый закон термодинамики
- •Суть первого закона термодинамики
- •Невозможность создания вечного двигателя
- •Работа и количество теплоты — характеристики процесса изменения энергии
- •§ 5.6. Теплоемкости газа при постоянном объеме и постоянном давлении
- •Теплоемкость газа при постоянном объеме Найдем молярную теплоемкость газа при постоянном объеме. Согласно определению теплоемкости
- •Теплоемкость газа при постоянном давлении
- •Теплоемкость идеального газа при изотермическом процессе
- •§ 5.7. Адиабатный процесс
- •Теплообмен в замкнутой системе
- •§ 5.8. Необратимость процессов в природе
- •§ 5.9. Второй закон термодинамики
- •§ 5.10. Статистическое истолкование необратимости процессов в природе
- •Противоречие между обратимостью микропроцессов и необратимостью макропроцессов
- •Житейский пример необратимости
- •Микроскопическое и макроскопическое состояния
- •Вероятность состояния
- •Переход системы к наиболее вероятному состоянию
- •Расширение «газа» из четырех молекул
- •Необратимость расширения газа с большим числом молекул
- •Стрела времени
- •Границы применимости второго закона термодинамики
- •«Демон Максвелла»
- •§ 5.11. Тепловые двигатели
- •Простейшая модель тепловой машины
- •Принципы действия тепловых двигателей
- •Роль холодильника
- •Кпд теплового двигателя
- •Применение тепловых двигателей
- •Тепловые двигатели и охрана природы
- •§ 5.12. Максимальный кпд тепловых двигателей
- •Идеальная тепловая машина Карно
- •Идеальная холодильная машина
- •Тепловой насос
- •Максимальный кпд тепловых машин (теорема Карно)
- •Кпд реальных тепловых машин
- •§ 5.13. Примеры решения задач
- •Вычитая почленно из второго уравнения первое, получим
- •Упражнение 4
- •Глава 6. Взаимные превращения жидкостей и газов
- •§ 6.1. Испарение жидкостей
- •Испарение
- •Молекулярная картина испарения
- •Конденсация пара
- •Охлаждение при испарении
- •Испарение твердых тел
- •§ 6.2. Равновесие между жидкостью и паром
- •Насыщенный пар
- •Ненасыщенный пар
- •§ 6.3. Изотермы реального газа
- •Давление насыщенного пара
- •Семейство изотерм реального газа
- •Зависимость давления и плотности насыщенного пара от температуры
- •§ 6.4. Критическая температура. Критическое состояние
- •Критическая температура
- •Критическое состояние
- •Плотность жидкости и ее насыщенного пара при критической температуре
- •Экспериментальное исследование критического состояния
- •Диаграмма равновесных состояний газа и жидкости
- •§ 6.5. Кипение
- •Зависимость температуры кипения жидкости от давления
- •Различие температур кипения жидкостей
- •§ 6.6. Теплота парообразования
- •Зависимость удельной теплоты парообразования от температуры
- •§ 6.7. Сжижение газов
- •Установки для сжижения газов
- •Хранение жидких газов
- •Применение сжиженных газов
- •Значение сжижения газов для научных исследований
- •§ 6.8. Влажность воздуха
- •Парциальное давление водяного пара
- •Абсолютная влажность
- •Относительная влажность
- •Точка росы
- •Гигрометр
- •Волосной гигрометр
- •Психрометр
- •Значение влажности
- •§ 6.9. Примеры решения задач
- •Упражнение 5
- •Глава 7. Поверхностное натяжение в жидкостях
- •§ 7.1. Поверхностное натяжение
- •Поверхностные эффекты
- •Поверхность жидкости стремится к сокращению
- •§ 7.2. Молекулярная картина поверхностного слоя
- •Происхождение сил поверхностного натяжения
- •Молекулярная картина поверхностного слоя
- •§ 7.3. Поверхностная энергия
- •Поверхностное натяжение
- •§ 7.4. Сила поверхностного натяжения
- •Измерение силы поверхностного натяжения
- •От чего зависит сила поверхностного натяжения?
- •Измерение коэффициента поверхностного натяжения
- •Зависимость поверхностного натяжения от примесей
- •§ 7.5. Смачивание и несмачивание
- •Явления на границе жидкость — твердое тело
- •Значение смачивания
- •§ 7.6. Давление под искривленной поверхностью жидкости
- •Влияние кривизны поверхности на давление внутри жидкости
- •Избыточное давление под сферической поверхностью жидкости
- •§ 7.7. Капиллярные явления
- •Высота поднятия жидкости в капиллярных трубках
- •Капиллярные явления в природе, быту и технике
- •§ 7.8. Примеры решения задач
- •Упражнение 6
- •Глава 8. Твердые тела и их превращение в жидкости § 8.1. Кристаллические тела
- •Кристаллы
- •Монокристаллы и поликристаллические тела
- •Форма и размеры кристаллов
- •Полиморфизм
- •Анизотропия кристаллов
- •§ 8.2. Кристаллическая решетка
- •Четыре типа кристаллов
- •Молекулярные кристаллы
- •Ковалентные кристаллы
- •Ионные кристаллы
- •Металлические кристаллы
- •Строение кристалла объясняет его свойства
- •§ 8.3. Аморфные тела
- •Сходство аморфных тел с жидкостями
- •Переход аморфных тел в кристаллические
- •Ближний порядок
- •Объяснение свойств аморфных тел
- •§ 8.4. Жидкие кристаллы
- •Молекулы жидких кристаллов
- •Нематические жидкие кристаллы
- •Смектические жидкие кристаллы
- •Холестерические* жидкие кристаллы
- •Применение жидких кристаллов
- •§ 8.5. Дефекты в кристаллах
- •Точечные дефекты
- •Дислокации
- •Винтовая дислокация
- •Рост кристаллов
- •§ 8.6. Объяснение механических свойств твердых тел на основании молекулярно-кинетической теории
- •Механизм пластических деформаций
- •Дислокации и прочность твердых тел
- •§ 8.7. Плавление и отвердевание
- •Плавление кристаллических тел
- •Плавление аморфных тел
- •Отвердевание кристаллических и аморфных тел
- •Объяснение плавления и отвердевания на основании молекулярно-кинетической теории
- •Переохлаждение жидкости
- •§ 8.8. Теплота плавления
- •Удельная теплота плавления
- •Теплота кристаллизации
- •Роль теплоты плавления льда и кристаллизации воды в природе
- •Сопло космической ракеты
- •Фазовые переходы. Сублимация
- •§ 8.9. Изменение объема тела при плавлении и отвердевании. Тройная точка
- •Объяснение «странного» поведения льда и воды
- •Вода и лед в природе
- •Зависимость температуры плавления от давления
- •Тройная точка
- •§ 8.10. Примеры решения задач
- •На плавление льда пошло количество теплоты
- •Следовательно, согласно закону сохранения энергии
- •Упражнение 7
- •Глава 9. Тепловое расширение твердых и жидких тел
- •§ 9.1. Тепловое расширение тел
- •Молекулярная картина теплового расширения
- •§ 9.2. Тепловое линейное расширение
- •§ 9.3. Тепловое объемное расширение
- •Связь между коэффициентами линейного и объемного расширения
- •Зависимость плотности вещества от температуры
- •Пользуясь формулой (9.3.3), можно записать
- •Пренебрегая выражением (αΔt)2по сравнению с единицей, получим
- •Тепловое расширение жидкостей
- •Особенности расширения воды
- •§ 9.4. Учет и использование теплового расширения тел в технике
- •Учет теплового расширения тел
- •Использование теплового расширения в технике
- •Терморегулятор
- •§ 9.5. Примеры решения задач
- •Образовавшийся зазор между пробкой и горлышком составит
- •Подставляя числовые значения величин, найдем
- •Упражнение 8
- •Ответы к упражнениям
- •Содержание
Количество вещества
Чем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в нем. Число молекул в макроскопических телах огромно. Поэтому удобно указывать не абсолютное число атомов, а относительное.
Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества.
Количеством вещества v называют отношение числа молекул N в данном теле к числу атомов NA в 12 г углерода*.
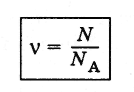 (2.2.2)
(2.2.2)
* Если вещество состоит из отдельных атомов, не объединенных в молекулы, то здесь и в дальнейшем под числом молекул надо подразумевать число атомов.
Зная количество вещества v и число NA, мы тем самым знаем число молекул N в веществе. Количество вещества выражают в молях.
Моль — это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г.
Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 12 г углерода, т. е. равно 2,5 NA.
Постоянная Авогадро
Число молекул или атомов в моле вещества называют постоянной Авогадро. Это название дано в честь итальянского ученого XIX в. А. Авогадро**.
** А. Авогадро (1776—1856) — итальянский физик и химик; автор четырехтомного труда, который был первым руководством по молекулярной физике.
Согласно определению моля постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в моле углерода, т. е. в 12 г углерода.
Для вычисления постоянной Авогадро надо найти массу одного атома углерода (или любого другого атома). Грубую оценку массы можно сделать так, как это было выполнено для массы молекулы воды. Наиболее точные методы определения массы основаны на отклонении пучков ионов электромагнитным полем. Измерения дают для массы атома углерода т0С = 1,995·10-23 г. Отсюда постоянная Авогадро равна
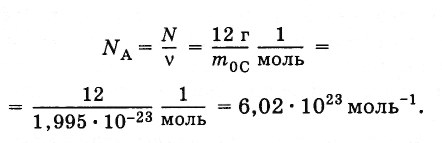 (2.2.3)
(2.2.3)
Наименование моль-1 указывает, что NA — число атомов любого вещества, взятого в количестве одного моля. Если количество вещества v = 2,5 моль, то число молекул в теле N = vNA = 1,5·1024.
Существует много других методов определения постоянной Авогадро, не связанных с нахождением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной постоянной.
Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры.
Молярная масса
Наряду с относительной молекулярной массой Мr, в физике и химии широко используется понятие молярной массы М.
Молярной массой называют массу вещества, взятого в количестве одного моля.
Согласно этому определению молярная масса равна произведению массы молекулы на постоянную Авогадро:
 (2.2.4)
(2.2.4)
Молярная масса простым образом связана с относительной молекулярной массой. Подставив в формулу (2.2.4) выражения т0 из (2.2.2) и NA из (2.2.3), получим:
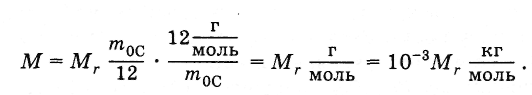 (2.2.5)
(2.2.5)
Например, молярная масса воды Н2О равна 18 г/моль, или 0,18 кг/моль, так как относительная молекулярная масса воды приближенно равна 18.
Масса m произвольного количества вещества v и молярная масса М связаны соотношением:
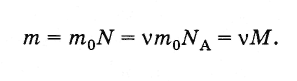 (2.2.6)
(2.2.6)
Так, масса 3 моль воды равна: m = 3 моль·0,018 кг/моль = 0,054 кг.
Используя формулы (2.2.6) и (2.2.2), можно получить формулу для числа молекул в теле в зависимости от массы тела m и молярной массы М:
![]() (2.2.7)
(2.2.7)
Нужно запомнить значение постоянной Авогадро: достаточно знать порядок величины 1023. Столько молекул содержится в 12 г углерода, в 18 г воды и т. д. Формулы (2.2.1), (2.2.2) и (2.2.4) дают определения новым физическим величинам: относительной молекулярной массе, количеству вещества и молярной массе. Вывести их нельзя, их надо просто запомнить. Остальные формулы можно вывести, и запоминать их необязательно.
