
- •Глава 1. Развитие представлений о природе теплоты
- •§ 1.1. Физика и механика
- •Что дает механика Ньютона?
- •Физика во времена Ньютона
- •Механическая картина мира
- •Крах механической картины мира
- •Тепловые и электромагнитные явления
- •§ 1.2. Тепловые явления
- •Роль тепловых явлений
- •Свойства тел и температура
- •Тепловые процессы и строение вещества
- •Тепловые явления в технике
- •§ 1.3. Краткий очерк развития представлений о природе тепловых явлений
- •Воззрения древних
- •Зарождение научной теории тепла
- •Теория теплорода
- •Крах теории теплорода
- •§ 1.4. Термодинамика и молекулярно-кинетическая теория Термодинамика
- •Молекулярно-кинетическая теория
- •Термодинамика и статистическая механика
- •Глава 2. Основы молекулярно-кинетической теории
- •§ 2.1. Основные положения молекулярно-кинетической теории
- •Доказательства существования молекул
- •Туннельный микроскоп
- •Размеры атомов и молекул
- •Число молекул
- •§ 2.2. Масса молекул. Постоянная Авогадро
- •Масса молекулы воды
- •Относительная молекулярная масса
- •Количество вещества
- •Постоянная Авогадро
- •Молярная масса
- •§ 2.3. Броуновское движение
- •Тепловое движение молекул
- •Модель броуновского движения
- •Наблюдение броуновского движения
- •Объяснение броуновского движения
- •Броуновское движение и измерительные приборы
- •§ 2.4. Силы взаимодействия молекул
- •Молекулярные силы
- •Электромагнитная природа молекулярных сил
- •Ориентационные силы
- •Индукционные (поляризационные) силы
- •Дисперсионные силы
- •Силы отталкивания
- •График зависимости молекулярных сил от расстояния между молекулами
- •Происхождение сил упругости
- •Атомно-силовой микроскоп
- •§ 2.5. Потенциальная энергия взаимодействия молекул
- •Зависимость потенциальной энергии от расстояния между молекулами
- •Главная задача
- •Движение частицы в пространстве с заданной потенциальной энергией
- •§ 2.6. Строение газообразных, жидких и твердых тел
- •Жидкости
- •Твердые тела
- •§ 2.7. Примеры решения задач
- •Упражнение 1
- •Глава 3. Температура. Газовые законы
- •§ 3.1. Состояние макроскопических тел в термодинамике
- •Макроскопические параметры
- •Давление газа в молекулярно-кинетической теории
- •§ 3.2. Температура. Тепловое равновесие
- •Субъективные представления о температуре
- •Происхождение терминов «температура» и «градус»
- •Первые термометры
- •Современные термометры
- •Тепловое равновесие
- •Температура
- •Молекулярно-кинетическое истолкование температуры
- •§ 3.3. Уравнение состояния
- •§ 3.4. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •§ 3.5. Газовые законы. Закон Бойля-Мариотта
- •Газовые законы
- •Закон Бойля—Мариотта
- •Молекулярно-кинетическое истолкование закона Бойля—Мариотта
- •§ 3.6. Закон Гей-Люссака. Идеальный газ
- •Закон Гей-Люссака
- •Экспериментальное определение зависимости объема газа от температуры
- •Изобары
- •Идеальный газ
- •Газовая шкала температур
- •§ 3.7. Абсолютная температура
- •Абсолютный нуль температуры
- •Шкала Кельвина
- •Зависимость объема от абсолютной температуры
- •§ 3.8. Законы Авогадро и Дальтона
- •Закон Авогадро
- •Закон Дальтона
- •§ 3.9. Уравнение состояния идеального газа
- •Уравнение состояния
- •Изменение состояния газа
- •Вывод уравнения состояния идеального газа
- •Универсальная газовая постоянная
- •Уравнение Менделеева—Клапейрона
- •§ 3.10. Закон Шарля. Газовый термометр
- •Закон Шарля
- •Газовый термометр постоянного объема
- •§ 3.11. Применение газов в технике
- •Управление давлением газа
- •Большая сжимаемость газов
- •Зависимость объема газа от температуры
- •Разреженные газы
- •§ 3.12. Примеры решения задач
- •Разделив почленно уравнение (3.12.4) на уравнение (3.12.5), получим
- •При этом
- •Упражнение 2
- •Глава 4. Молекулярно-кинетическая теория идеального газа
- •§ 4.1. Системы с большим числом частиц и законы механики. Статистическая механика
- •Термодинамические параметры с микроскопической точки зрения
- •Системы из большого числа частиц и законы механики
- •Статистическая механика
- •Средние по времени и статистические средние
- •Два этапа становления статистической механики (молекулярно-кинетической теории)
- •§ 4.2. Идеальный газ в молекулярно-кинетической теории
- •Идеальный газ
- •Значение столкновений между молекулами
- •§ 4.3. Среднее значение скорости теплового движения молекул
- •Средние значения
- •Среднее значение квадрата скорости
- •§ 4.4. Основное уравнение молекулярно-кинетической теории
- •Столкновение молекулы со стенкой
- •Число соударений со стенкой молекул, скорости которых близки к VIX
- •Импульс средней силы, действующий на стенку со стороны всех молекул
- •Давление газа
- •§ 4.5. Температура— мера средней кинетической энергии молекул
- •Постоянная Больцмана
- •Физический смысл постоянной Больцмана
- •Зависимость давления газа от концентрации его молекул и температуры
- •§ 4.6. Распределение максвелла
- •Вероятность случайного события
- •Распределение молекул по скоростям — распределение Максвелла
- •Распределение модулей скоростей молекул
- •Наиболее вероятная скорость молекул
- •Роль быстрых молекул
- •§ 4.7. Измерение скоростей молекул газа
- •Средняя скорость теплового движения молекул
- •Экспериментальное определение скоростей молекул
- •Средняя скорость броуновской частицы
- •§ 4.8. Внутренняя энергия идеального газа
- •Внутренняя энергия молекулярных газов
- •§ 4.9. Примеры решения задач
- •Упражнение 3
- •Глава 5. Законы термодинамики
- •§ 5.1. Работа в термодинамике
- •Работа в механике и термодинамике
- •Вычисление работы
- •Геометрическое истолкование работы
- •§ 5.2. Количество теплоты
- •Калориметрические опыты
- •Количество теплоты. Уравнение теплового баланса
- •Теплоемкость
- •§ 5.3. Эквивалентность количества теплоты и работы
- •Опыты Джоуля
- •Механический эквивалент теплоты
- •§ 5.4. Закон сохранения энергии. Внутренняя энергия
- •Закон сохранения энергии
- •Внутренняя энергия
- •Зависимость внутренней энергии от макроскопических параметров
- •§ 5.5. Первый закон термодинамики
- •Первый закон термодинамики
- •Суть первого закона термодинамики
- •Невозможность создания вечного двигателя
- •Работа и количество теплоты — характеристики процесса изменения энергии
- •§ 5.6. Теплоемкости газа при постоянном объеме и постоянном давлении
- •Теплоемкость газа при постоянном объеме Найдем молярную теплоемкость газа при постоянном объеме. Согласно определению теплоемкости
- •Теплоемкость газа при постоянном давлении
- •Теплоемкость идеального газа при изотермическом процессе
- •§ 5.7. Адиабатный процесс
- •Теплообмен в замкнутой системе
- •§ 5.8. Необратимость процессов в природе
- •§ 5.9. Второй закон термодинамики
- •§ 5.10. Статистическое истолкование необратимости процессов в природе
- •Противоречие между обратимостью микропроцессов и необратимостью макропроцессов
- •Житейский пример необратимости
- •Микроскопическое и макроскопическое состояния
- •Вероятность состояния
- •Переход системы к наиболее вероятному состоянию
- •Расширение «газа» из четырех молекул
- •Необратимость расширения газа с большим числом молекул
- •Стрела времени
- •Границы применимости второго закона термодинамики
- •«Демон Максвелла»
- •§ 5.11. Тепловые двигатели
- •Простейшая модель тепловой машины
- •Принципы действия тепловых двигателей
- •Роль холодильника
- •Кпд теплового двигателя
- •Применение тепловых двигателей
- •Тепловые двигатели и охрана природы
- •§ 5.12. Максимальный кпд тепловых двигателей
- •Идеальная тепловая машина Карно
- •Идеальная холодильная машина
- •Тепловой насос
- •Максимальный кпд тепловых машин (теорема Карно)
- •Кпд реальных тепловых машин
- •§ 5.13. Примеры решения задач
- •Вычитая почленно из второго уравнения первое, получим
- •Упражнение 4
- •Глава 6. Взаимные превращения жидкостей и газов
- •§ 6.1. Испарение жидкостей
- •Испарение
- •Молекулярная картина испарения
- •Конденсация пара
- •Охлаждение при испарении
- •Испарение твердых тел
- •§ 6.2. Равновесие между жидкостью и паром
- •Насыщенный пар
- •Ненасыщенный пар
- •§ 6.3. Изотермы реального газа
- •Давление насыщенного пара
- •Семейство изотерм реального газа
- •Зависимость давления и плотности насыщенного пара от температуры
- •§ 6.4. Критическая температура. Критическое состояние
- •Критическая температура
- •Критическое состояние
- •Плотность жидкости и ее насыщенного пара при критической температуре
- •Экспериментальное исследование критического состояния
- •Диаграмма равновесных состояний газа и жидкости
- •§ 6.5. Кипение
- •Зависимость температуры кипения жидкости от давления
- •Различие температур кипения жидкостей
- •§ 6.6. Теплота парообразования
- •Зависимость удельной теплоты парообразования от температуры
- •§ 6.7. Сжижение газов
- •Установки для сжижения газов
- •Хранение жидких газов
- •Применение сжиженных газов
- •Значение сжижения газов для научных исследований
- •§ 6.8. Влажность воздуха
- •Парциальное давление водяного пара
- •Абсолютная влажность
- •Относительная влажность
- •Точка росы
- •Гигрометр
- •Волосной гигрометр
- •Психрометр
- •Значение влажности
- •§ 6.9. Примеры решения задач
- •Упражнение 5
- •Глава 7. Поверхностное натяжение в жидкостях
- •§ 7.1. Поверхностное натяжение
- •Поверхностные эффекты
- •Поверхность жидкости стремится к сокращению
- •§ 7.2. Молекулярная картина поверхностного слоя
- •Происхождение сил поверхностного натяжения
- •Молекулярная картина поверхностного слоя
- •§ 7.3. Поверхностная энергия
- •Поверхностное натяжение
- •§ 7.4. Сила поверхностного натяжения
- •Измерение силы поверхностного натяжения
- •От чего зависит сила поверхностного натяжения?
- •Измерение коэффициента поверхностного натяжения
- •Зависимость поверхностного натяжения от примесей
- •§ 7.5. Смачивание и несмачивание
- •Явления на границе жидкость — твердое тело
- •Значение смачивания
- •§ 7.6. Давление под искривленной поверхностью жидкости
- •Влияние кривизны поверхности на давление внутри жидкости
- •Избыточное давление под сферической поверхностью жидкости
- •§ 7.7. Капиллярные явления
- •Высота поднятия жидкости в капиллярных трубках
- •Капиллярные явления в природе, быту и технике
- •§ 7.8. Примеры решения задач
- •Упражнение 6
- •Глава 8. Твердые тела и их превращение в жидкости § 8.1. Кристаллические тела
- •Кристаллы
- •Монокристаллы и поликристаллические тела
- •Форма и размеры кристаллов
- •Полиморфизм
- •Анизотропия кристаллов
- •§ 8.2. Кристаллическая решетка
- •Четыре типа кристаллов
- •Молекулярные кристаллы
- •Ковалентные кристаллы
- •Ионные кристаллы
- •Металлические кристаллы
- •Строение кристалла объясняет его свойства
- •§ 8.3. Аморфные тела
- •Сходство аморфных тел с жидкостями
- •Переход аморфных тел в кристаллические
- •Ближний порядок
- •Объяснение свойств аморфных тел
- •§ 8.4. Жидкие кристаллы
- •Молекулы жидких кристаллов
- •Нематические жидкие кристаллы
- •Смектические жидкие кристаллы
- •Холестерические* жидкие кристаллы
- •Применение жидких кристаллов
- •§ 8.5. Дефекты в кристаллах
- •Точечные дефекты
- •Дислокации
- •Винтовая дислокация
- •Рост кристаллов
- •§ 8.6. Объяснение механических свойств твердых тел на основании молекулярно-кинетической теории
- •Механизм пластических деформаций
- •Дислокации и прочность твердых тел
- •§ 8.7. Плавление и отвердевание
- •Плавление кристаллических тел
- •Плавление аморфных тел
- •Отвердевание кристаллических и аморфных тел
- •Объяснение плавления и отвердевания на основании молекулярно-кинетической теории
- •Переохлаждение жидкости
- •§ 8.8. Теплота плавления
- •Удельная теплота плавления
- •Теплота кристаллизации
- •Роль теплоты плавления льда и кристаллизации воды в природе
- •Сопло космической ракеты
- •Фазовые переходы. Сублимация
- •§ 8.9. Изменение объема тела при плавлении и отвердевании. Тройная точка
- •Объяснение «странного» поведения льда и воды
- •Вода и лед в природе
- •Зависимость температуры плавления от давления
- •Тройная точка
- •§ 8.10. Примеры решения задач
- •На плавление льда пошло количество теплоты
- •Следовательно, согласно закону сохранения энергии
- •Упражнение 7
- •Глава 9. Тепловое расширение твердых и жидких тел
- •§ 9.1. Тепловое расширение тел
- •Молекулярная картина теплового расширения
- •§ 9.2. Тепловое линейное расширение
- •§ 9.3. Тепловое объемное расширение
- •Связь между коэффициентами линейного и объемного расширения
- •Зависимость плотности вещества от температуры
- •Пользуясь формулой (9.3.3), можно записать
- •Пренебрегая выражением (αΔt)2по сравнению с единицей, получим
- •Тепловое расширение жидкостей
- •Особенности расширения воды
- •§ 9.4. Учет и использование теплового расширения тел в технике
- •Учет теплового расширения тел
- •Использование теплового расширения в технике
- •Терморегулятор
- •§ 9.5. Примеры решения задач
- •Образовавшийся зазор между пробкой и горлышком составит
- •Подставляя числовые значения величин, найдем
- •Упражнение 8
- •Ответы к упражнениям
- •Содержание
§ 3.10. Закон Шарля. Газовый термометр
С помощью уравнения состояния можно найти зависимость давления газа от температуры при постоянном объеме. Эту зависимость экспериментально установил французский физик Ж. Шарль (1746—1823) в 1787 г.* Располагая уравнением состояния идеального газа, прибегать к опыту уже нет необходимости.
* Ж. Шарль в 1787 г., т. е. раньше, чем Гей-Люссак, установил и зависимость объема от температуры при постоянном давлении, но он своевременно не опубликовал своих работ.
Закон Шарля
Согласно уравнению (3.9.9)
![]() (3.10.1)
(3.10.1)
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре. В этом и состоит закон Шарля.
Из закона Шарля следует, что отношение давлений данной массы газа при постоянном объеме равно отношению его абсолютных температур:
![]()
Процесс изменения давления газа, вызванный изменением температуры при постоянном объеме, называют изохорным (от греческих слов isos — равный и chora — занимаемое место). Зависимость давления газа от температуры графически изображается прямой линией — изохорой. Разным объемам соответствуют различные изохоры (рис. 3.14). Так как с ростом объема газа при постоянной температуре давление его падает (закон Бойля—Мариотта), то изохора, соответствующая объему V2, лежит ниже изохоры, соответствующей объему V1 < V2.
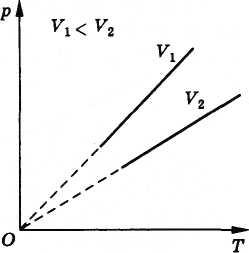
Рис. 3.14
Все прямые заканчиваются в начале координат. Значит, давление идеального газа при абсолютном нуле равно нулю, так же как и объем.
Предлагаем читателю самостоятельно убедиться в том, что закон Шарля можно записать в форме
![]() (3.10.3)
(3.10.3)
где р0 — давление газа при температуре Т = 273 К, а коэффициент γ, называемый температурным коэффициентом давления газа, равен температурному коэффициенту объемного расширения:
![]()
Коэффициент γ представляет собой относительное изменение давления при изменении температуры газа на 1 К.
Газовый термометр постоянного объема
В § 3.6 говорилось об идеальной газовой шкале температур. Для определения температуры по этой шкале используют газовые термометры. Наиболее простым газовым термометром является термометр постоянного объема. Измерение температуры с помощью этого термометра основано на законе Шарля (3.10.2).
Газовый термометр представляет собой сосуд, заполненный тем или иным газом: азотом, аргоном или гелием. Сосуд соединен гибкой трубкой с ртутным манометром, которым измеряют давление газа и поддерживают его постоянный объем (рис. 3.15, а, б). Сначала измеряют давление при некоторой фиксированной температуре Т0 (см. рис. 3.15, а)*. Затем измеряют давление при температуре Т (см. рис. 3.15, б). Зная давление р0 при температуре То и давление р при температуре Т, температуру Т определяют по формуле
![]() (3.10.4)
(3.10.4)
* В качестве этой температуры обычно выбирается температура тройной точки воды, т. е. температура состояния, в котором лед, вода и водяной пар находятся в тепловом равновесии.

а) б)
Рис. 3.15
Газовый термометр для точных измерений — очень сложное устройство. Для измерения температуры при физических исследованиях он применяется редко. Основное его назначение — использование для градуировки более простых, вторичных термометров. Эта градуировка производится в бюро стандартов, в метрологических институтах и в отдельных физических лабораториях. Для градуировки обычных, широко применяемых термометров используются вторичные термометры.
На законе Шарля основано устройство газового термометра для определения температуры по идеальной газовой шкале.
