
- •Глава 1. Развитие представлений о природе теплоты
- •§ 1.1. Физика и механика
- •Что дает механика Ньютона?
- •Физика во времена Ньютона
- •Механическая картина мира
- •Крах механической картины мира
- •Тепловые и электромагнитные явления
- •§ 1.2. Тепловые явления
- •Роль тепловых явлений
- •Свойства тел и температура
- •Тепловые процессы и строение вещества
- •Тепловые явления в технике
- •§ 1.3. Краткий очерк развития представлений о природе тепловых явлений
- •Воззрения древних
- •Зарождение научной теории тепла
- •Теория теплорода
- •Крах теории теплорода
- •§ 1.4. Термодинамика и молекулярно-кинетическая теория Термодинамика
- •Молекулярно-кинетическая теория
- •Термодинамика и статистическая механика
- •Глава 2. Основы молекулярно-кинетической теории
- •§ 2.1. Основные положения молекулярно-кинетической теории
- •Доказательства существования молекул
- •Туннельный микроскоп
- •Размеры атомов и молекул
- •Число молекул
- •§ 2.2. Масса молекул. Постоянная Авогадро
- •Масса молекулы воды
- •Относительная молекулярная масса
- •Количество вещества
- •Постоянная Авогадро
- •Молярная масса
- •§ 2.3. Броуновское движение
- •Тепловое движение молекул
- •Модель броуновского движения
- •Наблюдение броуновского движения
- •Объяснение броуновского движения
- •Броуновское движение и измерительные приборы
- •§ 2.4. Силы взаимодействия молекул
- •Молекулярные силы
- •Электромагнитная природа молекулярных сил
- •Ориентационные силы
- •Индукционные (поляризационные) силы
- •Дисперсионные силы
- •Силы отталкивания
- •График зависимости молекулярных сил от расстояния между молекулами
- •Происхождение сил упругости
- •Атомно-силовой микроскоп
- •§ 2.5. Потенциальная энергия взаимодействия молекул
- •Зависимость потенциальной энергии от расстояния между молекулами
- •Главная задача
- •Движение частицы в пространстве с заданной потенциальной энергией
- •§ 2.6. Строение газообразных, жидких и твердых тел
- •Жидкости
- •Твердые тела
- •§ 2.7. Примеры решения задач
- •Упражнение 1
- •Глава 3. Температура. Газовые законы
- •§ 3.1. Состояние макроскопических тел в термодинамике
- •Макроскопические параметры
- •Давление газа в молекулярно-кинетической теории
- •§ 3.2. Температура. Тепловое равновесие
- •Субъективные представления о температуре
- •Происхождение терминов «температура» и «градус»
- •Первые термометры
- •Современные термометры
- •Тепловое равновесие
- •Температура
- •Молекулярно-кинетическое истолкование температуры
- •§ 3.3. Уравнение состояния
- •§ 3.4. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •§ 3.5. Газовые законы. Закон Бойля-Мариотта
- •Газовые законы
- •Закон Бойля—Мариотта
- •Молекулярно-кинетическое истолкование закона Бойля—Мариотта
- •§ 3.6. Закон Гей-Люссака. Идеальный газ
- •Закон Гей-Люссака
- •Экспериментальное определение зависимости объема газа от температуры
- •Изобары
- •Идеальный газ
- •Газовая шкала температур
- •§ 3.7. Абсолютная температура
- •Абсолютный нуль температуры
- •Шкала Кельвина
- •Зависимость объема от абсолютной температуры
- •§ 3.8. Законы Авогадро и Дальтона
- •Закон Авогадро
- •Закон Дальтона
- •§ 3.9. Уравнение состояния идеального газа
- •Уравнение состояния
- •Изменение состояния газа
- •Вывод уравнения состояния идеального газа
- •Универсальная газовая постоянная
- •Уравнение Менделеева—Клапейрона
- •§ 3.10. Закон Шарля. Газовый термометр
- •Закон Шарля
- •Газовый термометр постоянного объема
- •§ 3.11. Применение газов в технике
- •Управление давлением газа
- •Большая сжимаемость газов
- •Зависимость объема газа от температуры
- •Разреженные газы
- •§ 3.12. Примеры решения задач
- •Разделив почленно уравнение (3.12.4) на уравнение (3.12.5), получим
- •При этом
- •Упражнение 2
- •Глава 4. Молекулярно-кинетическая теория идеального газа
- •§ 4.1. Системы с большим числом частиц и законы механики. Статистическая механика
- •Термодинамические параметры с микроскопической точки зрения
- •Системы из большого числа частиц и законы механики
- •Статистическая механика
- •Средние по времени и статистические средние
- •Два этапа становления статистической механики (молекулярно-кинетической теории)
- •§ 4.2. Идеальный газ в молекулярно-кинетической теории
- •Идеальный газ
- •Значение столкновений между молекулами
- •§ 4.3. Среднее значение скорости теплового движения молекул
- •Средние значения
- •Среднее значение квадрата скорости
- •§ 4.4. Основное уравнение молекулярно-кинетической теории
- •Столкновение молекулы со стенкой
- •Число соударений со стенкой молекул, скорости которых близки к VIX
- •Импульс средней силы, действующий на стенку со стороны всех молекул
- •Давление газа
- •§ 4.5. Температура— мера средней кинетической энергии молекул
- •Постоянная Больцмана
- •Физический смысл постоянной Больцмана
- •Зависимость давления газа от концентрации его молекул и температуры
- •§ 4.6. Распределение максвелла
- •Вероятность случайного события
- •Распределение молекул по скоростям — распределение Максвелла
- •Распределение модулей скоростей молекул
- •Наиболее вероятная скорость молекул
- •Роль быстрых молекул
- •§ 4.7. Измерение скоростей молекул газа
- •Средняя скорость теплового движения молекул
- •Экспериментальное определение скоростей молекул
- •Средняя скорость броуновской частицы
- •§ 4.8. Внутренняя энергия идеального газа
- •Внутренняя энергия молекулярных газов
- •§ 4.9. Примеры решения задач
- •Упражнение 3
- •Глава 5. Законы термодинамики
- •§ 5.1. Работа в термодинамике
- •Работа в механике и термодинамике
- •Вычисление работы
- •Геометрическое истолкование работы
- •§ 5.2. Количество теплоты
- •Калориметрические опыты
- •Количество теплоты. Уравнение теплового баланса
- •Теплоемкость
- •§ 5.3. Эквивалентность количества теплоты и работы
- •Опыты Джоуля
- •Механический эквивалент теплоты
- •§ 5.4. Закон сохранения энергии. Внутренняя энергия
- •Закон сохранения энергии
- •Внутренняя энергия
- •Зависимость внутренней энергии от макроскопических параметров
- •§ 5.5. Первый закон термодинамики
- •Первый закон термодинамики
- •Суть первого закона термодинамики
- •Невозможность создания вечного двигателя
- •Работа и количество теплоты — характеристики процесса изменения энергии
- •§ 5.6. Теплоемкости газа при постоянном объеме и постоянном давлении
- •Теплоемкость газа при постоянном объеме Найдем молярную теплоемкость газа при постоянном объеме. Согласно определению теплоемкости
- •Теплоемкость газа при постоянном давлении
- •Теплоемкость идеального газа при изотермическом процессе
- •§ 5.7. Адиабатный процесс
- •Теплообмен в замкнутой системе
- •§ 5.8. Необратимость процессов в природе
- •§ 5.9. Второй закон термодинамики
- •§ 5.10. Статистическое истолкование необратимости процессов в природе
- •Противоречие между обратимостью микропроцессов и необратимостью макропроцессов
- •Житейский пример необратимости
- •Микроскопическое и макроскопическое состояния
- •Вероятность состояния
- •Переход системы к наиболее вероятному состоянию
- •Расширение «газа» из четырех молекул
- •Необратимость расширения газа с большим числом молекул
- •Стрела времени
- •Границы применимости второго закона термодинамики
- •«Демон Максвелла»
- •§ 5.11. Тепловые двигатели
- •Простейшая модель тепловой машины
- •Принципы действия тепловых двигателей
- •Роль холодильника
- •Кпд теплового двигателя
- •Применение тепловых двигателей
- •Тепловые двигатели и охрана природы
- •§ 5.12. Максимальный кпд тепловых двигателей
- •Идеальная тепловая машина Карно
- •Идеальная холодильная машина
- •Тепловой насос
- •Максимальный кпд тепловых машин (теорема Карно)
- •Кпд реальных тепловых машин
- •§ 5.13. Примеры решения задач
- •Вычитая почленно из второго уравнения первое, получим
- •Упражнение 4
- •Глава 6. Взаимные превращения жидкостей и газов
- •§ 6.1. Испарение жидкостей
- •Испарение
- •Молекулярная картина испарения
- •Конденсация пара
- •Охлаждение при испарении
- •Испарение твердых тел
- •§ 6.2. Равновесие между жидкостью и паром
- •Насыщенный пар
- •Ненасыщенный пар
- •§ 6.3. Изотермы реального газа
- •Давление насыщенного пара
- •Семейство изотерм реального газа
- •Зависимость давления и плотности насыщенного пара от температуры
- •§ 6.4. Критическая температура. Критическое состояние
- •Критическая температура
- •Критическое состояние
- •Плотность жидкости и ее насыщенного пара при критической температуре
- •Экспериментальное исследование критического состояния
- •Диаграмма равновесных состояний газа и жидкости
- •§ 6.5. Кипение
- •Зависимость температуры кипения жидкости от давления
- •Различие температур кипения жидкостей
- •§ 6.6. Теплота парообразования
- •Зависимость удельной теплоты парообразования от температуры
- •§ 6.7. Сжижение газов
- •Установки для сжижения газов
- •Хранение жидких газов
- •Применение сжиженных газов
- •Значение сжижения газов для научных исследований
- •§ 6.8. Влажность воздуха
- •Парциальное давление водяного пара
- •Абсолютная влажность
- •Относительная влажность
- •Точка росы
- •Гигрометр
- •Волосной гигрометр
- •Психрометр
- •Значение влажности
- •§ 6.9. Примеры решения задач
- •Упражнение 5
- •Глава 7. Поверхностное натяжение в жидкостях
- •§ 7.1. Поверхностное натяжение
- •Поверхностные эффекты
- •Поверхность жидкости стремится к сокращению
- •§ 7.2. Молекулярная картина поверхностного слоя
- •Происхождение сил поверхностного натяжения
- •Молекулярная картина поверхностного слоя
- •§ 7.3. Поверхностная энергия
- •Поверхностное натяжение
- •§ 7.4. Сила поверхностного натяжения
- •Измерение силы поверхностного натяжения
- •От чего зависит сила поверхностного натяжения?
- •Измерение коэффициента поверхностного натяжения
- •Зависимость поверхностного натяжения от примесей
- •§ 7.5. Смачивание и несмачивание
- •Явления на границе жидкость — твердое тело
- •Значение смачивания
- •§ 7.6. Давление под искривленной поверхностью жидкости
- •Влияние кривизны поверхности на давление внутри жидкости
- •Избыточное давление под сферической поверхностью жидкости
- •§ 7.7. Капиллярные явления
- •Высота поднятия жидкости в капиллярных трубках
- •Капиллярные явления в природе, быту и технике
- •§ 7.8. Примеры решения задач
- •Упражнение 6
- •Глава 8. Твердые тела и их превращение в жидкости § 8.1. Кристаллические тела
- •Кристаллы
- •Монокристаллы и поликристаллические тела
- •Форма и размеры кристаллов
- •Полиморфизм
- •Анизотропия кристаллов
- •§ 8.2. Кристаллическая решетка
- •Четыре типа кристаллов
- •Молекулярные кристаллы
- •Ковалентные кристаллы
- •Ионные кристаллы
- •Металлические кристаллы
- •Строение кристалла объясняет его свойства
- •§ 8.3. Аморфные тела
- •Сходство аморфных тел с жидкостями
- •Переход аморфных тел в кристаллические
- •Ближний порядок
- •Объяснение свойств аморфных тел
- •§ 8.4. Жидкие кристаллы
- •Молекулы жидких кристаллов
- •Нематические жидкие кристаллы
- •Смектические жидкие кристаллы
- •Холестерические* жидкие кристаллы
- •Применение жидких кристаллов
- •§ 8.5. Дефекты в кристаллах
- •Точечные дефекты
- •Дислокации
- •Винтовая дислокация
- •Рост кристаллов
- •§ 8.6. Объяснение механических свойств твердых тел на основании молекулярно-кинетической теории
- •Механизм пластических деформаций
- •Дислокации и прочность твердых тел
- •§ 8.7. Плавление и отвердевание
- •Плавление кристаллических тел
- •Плавление аморфных тел
- •Отвердевание кристаллических и аморфных тел
- •Объяснение плавления и отвердевания на основании молекулярно-кинетической теории
- •Переохлаждение жидкости
- •§ 8.8. Теплота плавления
- •Удельная теплота плавления
- •Теплота кристаллизации
- •Роль теплоты плавления льда и кристаллизации воды в природе
- •Сопло космической ракеты
- •Фазовые переходы. Сублимация
- •§ 8.9. Изменение объема тела при плавлении и отвердевании. Тройная точка
- •Объяснение «странного» поведения льда и воды
- •Вода и лед в природе
- •Зависимость температуры плавления от давления
- •Тройная точка
- •§ 8.10. Примеры решения задач
- •На плавление льда пошло количество теплоты
- •Следовательно, согласно закону сохранения энергии
- •Упражнение 7
- •Глава 9. Тепловое расширение твердых и жидких тел
- •§ 9.1. Тепловое расширение тел
- •Молекулярная картина теплового расширения
- •§ 9.2. Тепловое линейное расширение
- •§ 9.3. Тепловое объемное расширение
- •Связь между коэффициентами линейного и объемного расширения
- •Зависимость плотности вещества от температуры
- •Пользуясь формулой (9.3.3), можно записать
- •Пренебрегая выражением (αΔt)2по сравнению с единицей, получим
- •Тепловое расширение жидкостей
- •Особенности расширения воды
- •§ 9.4. Учет и использование теплового расширения тел в технике
- •Учет теплового расширения тел
- •Использование теплового расширения в технике
- •Терморегулятор
- •§ 9.5. Примеры решения задач
- •Образовавшийся зазор между пробкой и горлышком составит
- •Подставляя числовые значения величин, найдем
- •Упражнение 8
- •Ответы к упражнениям
- •Содержание
Давление насыщенного пара
Что будет происходить с насыщенным паром, если уменьшать занимаемый им объем, например, если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной?
При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ. Это будет происходить до тех пор, пока вновь не установится динамическое равновесие, и плотность пара, а значит, и концентрация его молекул не примут прежнее значение. Следовательно, концентрация молекул насыщенного пара не зависит от его объема при постоянной температуре.
Состояние насыщенного пара приближенно описывается уравнением р = nkT, полученным нами для идеального газа (см. § 4.5). Для насыщенного пара эта формула выполняется тем точнее, чем ниже температура и соответственно давление пара.
Так как давление пропорционально концентрации молекул (р = nkT), то из независимости концентрации молекул (или плотности) насыщенных паров от объема следует независимость давления насыщенного пара от занимаемого им объема.
Независящее от объема давление пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При одной и той же температуре, как показывает опыт, давление насыщенного пара различных веществ различно. Например, при температуре 20 °С давление насыщенного пара эфира равно 440 мм рт. ст., насыщенного пара спирта — 45 мм рт. ст., а водяного насыщенного пара — 17 мм рт. ст.
Семейство изотерм реального газа
До
сих пор мы рассматривали только одну
определенную изотерму реального газа.
Познакомимся теперь с тем, как будет
вести себя, например, тот же углекислый
газ при другой, более высокой (но также
постоянной) температуре T1.
Новая изотерма, как и прежняя, довольно
точно совпадает с изотермой идеального
газа при больших объемах. Начиная с
некоторого объема
![]() < V1,
она
также идет горизонтально (рис. 6.4).
Наконец, при объеме
< V1,
она
также идет горизонтально (рис. 6.4).
Наконец, при объеме
![]() > V2
изотерма
круто поднимается вверх. Это означает,
что при объеме V2
весь
цилиндр заполнен жидкостью.
> V2
изотерма
круто поднимается вверх. Это означает,
что при объеме V2
весь
цилиндр заполнен жидкостью.
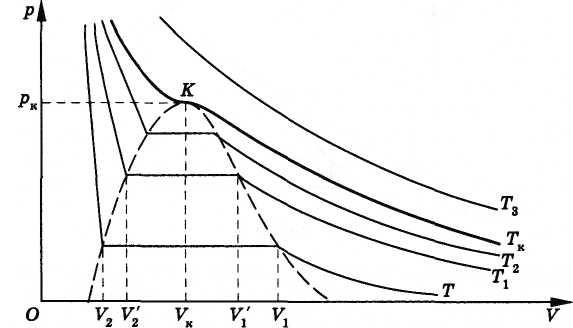
Рис. 6.4
Если на основе опытных данных построить еще несколько изотерм, получится семейство изотерм реального газа (см. рис. 6.4). При этом обнаружится закономерность, общая для всех газов. Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа (пара). Объясняется это тем, что молекулы при более высокой температуре движутся быстрее, и необходима большая плотность газа для того, чтобы силы притяжения могли бы удержать молекулы около друг друга. Во-вторых, чем выше температура, тем больше объем, занимаемый жидкостью после того, как весь газ конденсируется. Ведь объем жидкости с увеличением температуры растет. Следовательно, длина прямолинейного горизонтального участка изотермы, соответствующего равновесию между жидкостью и насыщенным паром, с ростом температуры уменьшается. Конденсация начинается при больших плотностях газа и заканчивается при меньших плотностях жидкости. Другими словами, плотность газа и жидкости при одном и том же давлении тем ближе друг к другу, чем выше температура.
