
- •Под редакцией профессора э. В. Недашковского
- •Отв. Редактор - проф. Э.Недашковский
- •Оглавление
- •Раздел 1. Вопросы общей анестезиологии
- •Раздел 2. Вопросы частной анестезиологии
- •Раздел 3. Регионарная анестезия, лечение боли
- •Раздел 4. Вопросы интенсивной терапии
- •Раздел 5. Общая информация
- •Раздел 6. Актуальные аспекты респираторной терапии
- •Раздел 1. Вопросы общей анестезиологии
- •Медикаментозное лечение интраоперационной ишемии миокарда
- •Принципы риска и безопасность
- •Раздел 1. Смерть младенца вследствие трудных родов
- •Раздел 2. Проблема оказания помощи
- •Участие ррак в переносе сигнальной информации и апоптозе
- •Ингибиторы ренин-ангиотензиновой системы и анестезия
- •Методы определения глубины анестезии
- •Анализ электроэнцефалограммы
- •Гипертрофическая обструктивная кардиомиопатия
- •Гемодинамические цели при митральной регургитации
- •163061, Архангельск, пр. Троицкий, 51, каб.330.
- •Одиночные или множественные подергивания?
- •Роль послеоперационной анальгезии при амбулаторных хирургических вмешательствах
- •Литература
- •Лечение хронических болевых синдромов детского возраста
- •Лекарства и плацента
- •Физиологические изменения фармакологии при беременности Сердечно-сосудистая система
- •2. Факторы, влияющие на плацентарный транспорт
- •2.1 Маточные факторы
- •2.2 Плацентарные факторы
- •2.3 Факторы плода
- •3. Анестезиологические препараты и трансплацентарный транспорт
- •3.1 Внутривенные препараты
- •3.2 Закись азота и галогенные анестетики
- •3.3 Миорелаксанты
- •3.4 Опиоиды ,
- •3.5 Местные анестетики и регионарная анестезия
- •Применение ларингеальной маски в акушерстве
- •Анестезиологический осмотр в акушерстве
- •24 Часов
- •I. Нужна ли госпитализация?
- •II. Тяжелые ожоги: что должно быть сделано до перевода в ожоговый центр?
- •1) Как поступить: охлаждать ожоги или согревать пациента?
- •2) Подготовка к дальнейшему лечению
- •3) Количество и состав сред инфузионной терапии
- •4) Анальгезия и седация '
- •5) Респираторная поддержка
- •6) Особые случаи
- •1. Мониторный контроль состояния кардио-респираторной системы и жидкостных секторов организма
- •1. Патогенез
- •1.1. Методика дилюционной тромбоцитопении и коагулопатии
- •1.2. Диссеминированное внутрисосудистое свертывание (двс)
- •1.3. Гипотермия
- •2.1. Профилактические компоненты терапии
- •2.2. Можем ли мы полагаться на клинические данные?
- •2.3. Можем ли мы полагаться на данные исследований гемостаза?
- •2.4. Дополнительные подходы
- •Вопрос 1: как пользоваться компасом в лесу информации?
- •Вопрос 3: насколько интересно название статьи? кто авторы? насколько различается профиль ваших лечебных учреждений?
- •Вопрос 4: четко ли изложены выводы работы в тезисах статьи?
- •Вопрос 5: надежда и вера: где гипотеза?
- •Вопрос 6: какие методы используются для сбора данных? насколько подробно они описаны?
- •Вопрос 7: как представлены средние величины?
- •Вопрос 8: были ли представлены наиболее важные клинические параметры и исходы?
- •Вопрос 9: достоверны ли результаты статистически? насколько они важны с клинической точки зрения?
- •Вопрос 10: верю ли я результатам прочитанной работы?
Участие ррак в переносе сигнальной информации и апоптозе
В 1991 году реактивные радикалы кислорода были определены как активные агенты активации ядерных факторов передачи информации подгруппы ЯФ-kB/Rel (12). Благодаря этим первым наблюдениям накоплены доказательства того, что РРК играют роль внутриклеточных факторов посредников в регуляции переноса сигнальной информации и апоптоза (11,13,14). Для этого необходимы специальные условия: небольшой объем, высокая диффузионная способность, равномерность воздействия, быстрый синтез и разрушение. РРК удовлетворяют всем этим условиям, но они высоко токсичны в силу окислительных свойств, поэтому только в низких концентрациях РРК можно считать физиологическими внутриклеточными посредниками переноса информации, а также следует четко различать оксидазный стресс и изменение РОВ при появлении «физиологических доз» РРАК. В большинстве исследований уделяется внимание роли РРК в цепочке переноса сигнальной информации при участии перекиси водорода в концентрации 3 х 10—4 М, которая необычно высокая для ситуаций in vivo, за исключением внутриклеточной среди активированных фагоцитов (или родственных клеток).
В большинстве публикаций сообщается об активации ЯФ-кВ РРК, в основном перекисью водорода, но и другие ядерные факторы транскрипции информации и некоторые каскады протеинкиназ чувствительны к РРК. Наиболее частой мишенью для РРК в протеинкиназах и передающих сигнальную информацию белках является регуляторный домен, который в норме активируется фосфорилированием. Другой мишенью РРК многих белков и ферментов, участвующих в переносе информации, является глутатион и функция тиоловых групп. В клеточной культуре РРК вызывают окислительную инактивацию ЦАП (окисление -SH групп), апоптоз или некроз в зависимости от их концентрации и типа клетки (15). Факторы транскрипции, чувствительные к РОВ, такие как гипоксией индуцируемый фактор-1а (ГИФ-1а) и ЯФ-кВ, четко зависят от уровня ГТИ. В лейкоцитах вырабатывается физиологическое количество перекиси водорода при воздействии цитокинов, таким образом ее можно считать физиологическим вторичным посредником передачи информации.
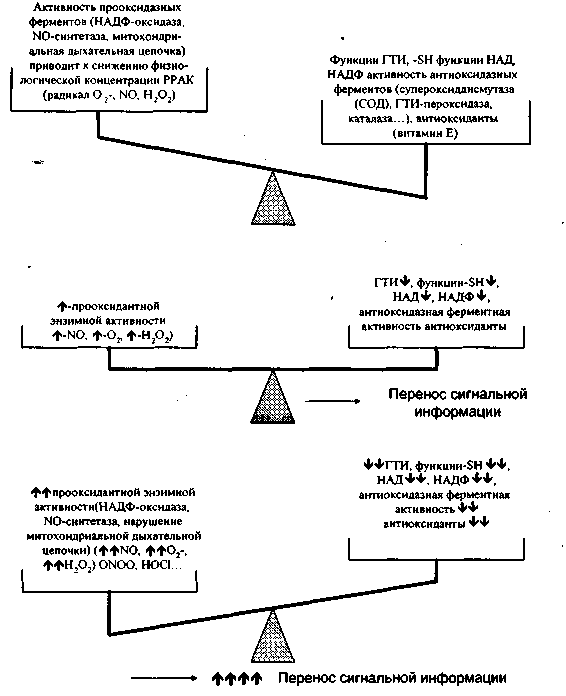
Рисунок 7. РОВ в цитоплазме. В норме цитоплазма находится в несколько основном состоянии; внешний сигнал может стимулировать продукцию физиологических концентраций РРАК, приводя к небольшому снижению содержания оснований в цитоплазме, что запускает перенос сигнальной информации. В патологических условиях (избыточная внешняя стимуляция, бесконтрольная активность фагоцитов) РОВ смещается в сторону оксидазной активности, при этом концентрация восстановительных агентов (в основном -SH функция) и активность антиоксидантных ферментов значительно падает.
Однако точные механизмы активации РРК процесса передачи сигнальной информации остаются в большинстве случаев необъяснимыми. Было также показано, что РРК индуцируют фосфорилирование тирозина в лимфоидных клетках. Так как уровень фосфорилирования тирозина является результатом баланса двух процессов: фосфорилирования протеин тирозин киназами и дефосфорилирования протеин тирозин фосфатазами (ПТФ), то очевидно, что наилучший эффект РРК на фосфорилирование тирозина может быть достигнут при активации киназ или ингибиции фосфатаз. Продукты окисления ли-пидов (окисленный LDL, окисленные формы холестерола и липоальдегиды, например 4-гидроксиноленол) также влияют на процессы регуляции генного проявления в виде адгезии молекул, появления протеинов при тепловом ударе, цитокинов, факторов роста (16). В любом случае их механизм действия, роль РРК подтверждены использованием компонентов антиоксидантов (N-ацетил-цистеин) и ферментов (каталаза), которые ингибируют перенос сигнальной информации, в основном, за счет угнетения фосфорилирования тирозина. Тем не менее, до сих пор тестируется и оценивается участие РРК в процессе переноса сигнальной информации. В недавних исследованиях на эндотелиальных клетках было показано, что перекись водорода индуцирует появление активности связывания ДНК с ЯФ-кВ, но результатом этого является «молчание» считывания информации (17). Остаются проблемы в оценке роли РРК/РРАК в апоптозе. В результате оксидазного стресса, вызванного перекисью водорода, клетка может разрушиться путем апоптоза или некроза в зависимости от концентрации перекиси водорода: в дозе 3 х 1 мМ (оксидаз-ный стресс) клетка претерпевает некротические изменения, а в микромолярных концентрациях - апоптоз. Различие в эволюционных изменениях будет зависить от уровня АТФ (18).
Практическая роль NO и пероксинитрита: играет ли пероксинитрит ключевую роль в повреждении процесса переноса сигнальной информации?
NO является прототипом молекулы, участвующей в модификации РОВ и цепочке передачи сигнальной информации. NO и его производные (см. рис.6), по-видимому, регулируют перенос сигнальной информации в специфическом направлении в зависимости от типа клетки, характера стимуляции, концентрации NO и состояния РОВ клетки. В результате активации NO-синтетазы и переноса сигнальной информации, связанной со стрессовой стимуляцией протеинкиназ, изменяется кровоток в эндотелиальной ткани (стрессовый синдром «ножниц») (19). NO также будет влиять на процесс активации ЦАП и регуляции генной экспрессии путем 8-нитрозилизации/8-денитрозилизации (20) и станет влиятельным фактором в митохондриальном пути апоптоза (21). Однако в последние годы увеличивается число исследований пероксинитрита (ONOO-), нестабильного продукта окисления NO с супероксидионом (см.рис.6), как главного компонента регуляции процесса переноса сигнальной информации при повреждении рецепторов или как участника переноса информации во многих внутриклеточных местах (22). Путем нитрирования уменьшается количество истинного тирозина, ONOO- способен повреждать ферменты, участвующие в процессе переноса информации, такие как тирозинкиназа (рис.8).
Нитрированные протеины таким образом станут не только функционально неактивными за счет действия ONOO-, но и активными веществами, поддерживающими процесс заболевания. Киназы тирозина сами по себе должны быть фосфорилированы, чтобы в соответствующем тирозиновом участке проявлять активность в процессе передачи сигнальной информации. В последующем, когда они дефосфорилируются, перенос информации прекращается. Ферменты, участвующие в дефосфорилировании, также являются тирозин-ответственными энзимами. Остатки нитрирования тирозина могут нарушать функции энзимов путем торможения фосфорилирования киназ тирозина и путем инактивации дефосфорилирующих ферментов. Пероксинитрит, таким образом, способен выступать в роли агента, нарушающего регуляцию апоптоза, блокирующего или усиливающего перенос информации, в зависимости от точки воздействия и типа энзима-мишени. Пероксинитрит также внедряется и в другие звенья цепочки апоптоза. Недавно сообщалось, что ONOO- принадлежит способность активировать переход проЦАП в ЦАП, исполнителей функции запуска апоптоза, который инициируется активацией рецепторов мембраны клетки. Было отмечено, что ONOO- активирует проЦАП-3 и 9. Пероксинитрит способен также повреждать фарторы транскрипции за счет разрушения их цистеиновых участков и путем окисления их основных железо-серных кластеров и пальчиковых цинковых компонентов. При этом теряется способность белков к связыванию с ДНК или к распознаванию соответствующих участков.
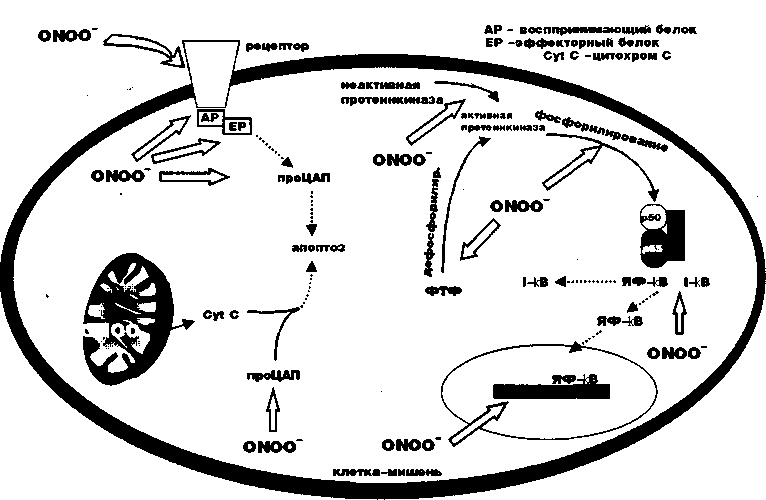
Рисунок 8. Возможные эффекты действия пероксинитрита (ONOO-) на цепочку переноса сигнальной информации. ONOO- путем окисления будет воздействовать на функцию -SH групп и за счет нитрирования белков, взаимодействующих с истинными протеинами (воспринимающими и эффекторными, АР и ЕР), ядерными факторами (ЯФ-кВ) и активного участия в процессах активации ферментов, участвующих в фосфорилировании (тирозин протеинкиназы, РК) и дефосфорилировании (фосфотирозин фосфатазы, ФТФ).
Влияние РРК на перенос сигнальной информации in vivo
Влияние РРАК и оксидазного стресса на перенос сигнальной информации in vivo плохо документировано. Действительно, трудно представить, что существует прямая ко-реляция между продукцией РРАК in vivo и активацией ядерных факторов. В настоящее время накапливаются непрямые доказательства того, что РРАК продуцируются in vivo в крови и легких. Эти данные получают путем оценки изменений состояния антиоксидантов (снижение концентрации витамина Е, активности антиоксидантных ферментов, общей емкости антиоксидантов в плазме,) и определения оксидазных молекул (окисленные антипротеиназы, нитрированные протеины) в жидкости после бронхо-альвеолярного лаважа у пациентов отделения интенсивной терапии (23,24). В большинстве клеток дыхательного тракта при остром поражении легких NO образуется при участии NO-синтетазы и супероксиданиона путем активизации НАДФ-оксидазы. Присутствие при этом активированных альвеолярных макрофагов и стимулированных захваченных нейтрофилов повы--шает продукцию РРАК. Это создает благоприятные условия для выработки продуктов РРК, нитритов, пероксинитрита, перекиси водорода, супероксидиона, HOCI. В сочетании с цитокинами lL-1b и ТНФа РРАК регулируют чувствительный к РОВ процесс транскрипции ЯФ-кВ, который участвует в острой фазе многих иммунных и воспалительных реакций. В силу того, что этот фактор становится все более распознаваемым как анти-апоптозный фактор, значительная активация ЯФ-кВ в легких при РДСВ может повышать выживаемость провоспалительных нейтрофилов, поддерживающих воспалительный процесс в легких (25-27). При сепсисе была обнаружена усиленная активация ЯФ-кВ в моноцитах периферической крови. Этот показатель коррелировал с неблагоприятным исходом пациентов (28). У пациентов с РДСВ обнаружена повышенная активация ЯФ-кВ в альвеолярных макрофагах. У пациентов на искусственной вентиляции легких, но без РДСВ получены сходные результаты в острой стадии воспаления в легких (29). Недавно, исследуя жидкость после бронхо-альвеолярного лаважа (БАЛ) у пациентов с вентилятор-ассоциированной пневмонией (ВАП), в нормальных альвеолоцитах мы обнаружили повышенную активность ЯФ-кВ. Таких данных мы не получили в группе пациентов на ИВЛ, но без ВАП и РДСВ. Как ожидалось, активность ЯФ-кВ коррелировала с концентрацией в жидкости БАЛ IL-1. Помимо этого повышенной оказалась концентрация IL-8, активной миелопероксидазы и количество нейтрофилов. Параллельно мы оценивали влияние РРК на активность ЯФ-кВ в альвеолоцитах, используя изолированную МПО продукты N0 (нитриты и пероксинитрит). Было обнаружено, что последние в концентрации от 10~7 до 10'5 М активировали ЯФ-кВ в такой же степени, как и ТНФа, перекись водорода в концентрации 10—5 Ми 10—5 М HOCI, - вещества, ранее называвшиеся активаторами ЯФ-кВ. Мы также обнаружили, что человеческая МПО в количестве 5 мкг также активна, как и ТНФа, и соответствует по активности реакции МПО in situ с перекисью водорода или продуктами NO, которые продуцируются альвеолоцитами.
Роль РРАК в активации переноса информации in vivo, таким образом, представляется значительной при нарушении РОВ. У пациентов в отделении интенсивной терапии (ОИТ) следует ожидать появления оксидазного стресса при избыточной стимуляции фагоцитов. Нобходимо разработать стратегию терапии, чтобы ограничить изменение РОВ как путем снижения активности фагоцитов (без иммуносупрессии), так и повышения ан-тиоксидантного потенциала в крови и альвеолах. Дополнительные назначения в комплексе интенсивной терапии таких антиоксидантов, как витамин Е, молекул, богатых цистеи-ном, веществ с присутствием следовых концентраций селена, ароматических аминокислот, благоприятны в такой же степени, как использование селективных антибиотиков, анестетиков, противовоспалительных препаратов (30,31).
Заключение
Некоторые результаты влияния РРАК и оксидазного стресса на процесс переноса сигнальной информации и апоптоза ясны, но научные данные, в основном получаемые в лабораторных исследованиях на уровне клеток человека, вирусов и бактерий, быстро изменяются. Эти исследования очень необходимы и значительны, часто приводя к элегантным и простым концепциям, в которых возникают идеи прямого воздействия на регуляцию процессов переноса информации. Они начинаются со стимуляции и заканчиваются активацией генов или протеолизом. In vivo активация ЯФ-кВ альвеолярных макрофагов и снижение фагоцитарного апоптоза продемонстрирована при заболеваниях с острой фазой воспаления (сепсис, РДСВ). Но данные многообразны и их следует связывать с индивидуальными генетическими факторами. Очевидно, что простые схемы переноса информации в реальной жизни не применимы (32). Роль оксидазного стресса и РРАК в процессе переноса сигнальной информации и апоптоза остается далеко не полностью определенной, особенно в отношении «физиологических» концентраций специфических РРК.
Литература
1. Krauss G. Biochemistry of signal transduction and regulation. Wiley-VCH, Weinheim; 1999, 506 p. Recommended lecture fot a complete view on signal transduction
2. Rathmell JC, Thompson CB. The central effectors of cell death in the immune system. Annu Rev Immunol 1999; 17: 781-828.
3. Hunter T. Protein kinase classification. Methods in Enzym 1991; 200:3-37.
4. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination; the control of NF-kB activity. Annu Rev Immunol 2000; 18: 621-63.
5. Ghosh S, May MJ, Kopp EB. NF-kB and Rel proteins: Evolutionary conserved mediators of immune responses. Annu. Rev. Immunol. 1998; 16:225 - 60
6. Kidd VJ. Proteolytic activities that mediate apoptosis. Annu. Rev. Physiol. 1998; 60:533 - 73.
7. Thompson CB. Apoptosis in the pathogenesis and treatment of diseases. Science 1995; 267:1456-62.
8. Budihardjo I, Oliver H, Lutter M, Luo X, Wang X. Biochemical pathways ofcaspase activation during apoptosis. Annu Rev Cell Dev В/о/1999; 15:269-90.
9. Earnshaw WC, Martins LM, Kaufmann SH. Mammalian caspases: structure, activation, substrates and functions during apoptosis. Annu Rev Biochem 1999; 68:383-424. 10.
10. Thornberry NA. Caspases: key mediators of apoptosis. Chem Biol 1998; 5: R97-R103
11. Forman HJ, Cadehas E (eds) Ox/dative stress and signal transduction. Chapman & Hall, New York, 1997, 475 p. Recommended lecture for a general view on the role ofoxidative stress and signal transduction
12. Schreck R, Rieber P, Baeuerle PA. Reactive oxygen intermediates as apparently widely used messengers in the activation of the NF-kappa В transcription factor and HIV-I. EMBO J1991; 10:2247-58.
13. Chandra J, Samali A, Orrenius S. Triggering and modulation ofapopotosis by oxidative stress.. Free Radic Biol Med 2000; 29: 323-33.
14. Hensley K, Robinson KA, Gabbita SP, Salsman S, Floyd RA Reactive oxygen species, cell signaling, and cell injury. Free Radic Biol Med 2000; 28:1456 - 62.
15. Warren MC, Bump EA, Medeiros D, Braunhut SJ. Oxidative stress-induced apoptosis of endothelial cells. Free Radic Biol Med 2000; 29: 537-47
16. Leonarduzz/ G, M C. Arkan, H Basaga, E Chiarpotto, A Sevan/an, G Poll. Lipid oxidation products in cell signaling Free Radic Biol Med 2000; 28:1370 - 8.
17. True AL, Rahman A, Malik AB. Activation of NF-kB induced by H202 and TNF-a and its effects on ICAM-1 expression in endothelial cells. Am J Physio/ Lung Cell Mo/ Physiol 2000; 279: L302 -11.
18. Lelli JL Jr, Becks LL, Dabrowska MI, Hinshaw DB. A TP converts necrosis to apoptosis in oxidant-injured endothelial cells. Free Radic Biol Med, 1998; 25:. 694 - 702.
19. Go YM, Pate/ RP, Ma/and MC, Park H, Beckman JS, Darley-Usmar VM, Jo H. Evidence for peroxynitrite as a signaling molecule in flow-dependent activation ofc-Jun NH(2)-terminal kinase. Am J Physiol 1999; 277: H1647-53.
20. Marshall HE, Merchant K. Stamler JS. N/trosation and oxidation in the regulation of gene expression. FASEB J 2000; 14:1889 -900.
21. Bosca L, Hortelano S. Mechanisms of nitric-oxide dependent apoptosis: involvement of mitochondria! mediators. Cell Signal 1999; 11: 239-44.
22. Valdez LB, Alvarez S, Arnaiz LS, Sch pffer F, Carreras MC, Poderoso JJ, Boveris A. Reactions of peroxynitrite in the mitochondria/ matrix. Free Radic Biol Med 2000; 29:349-56
23. Lamb NJ, Qu/nlan GJ, Westerman ST, Gutteridge JM, Evans TW. Nitration of proteins in bronchoalveolar lavage fluid from patients with acute respiratory distress syndrome receiving inhaled nitric oxide. Am J Respir Crit Care Med 1999; 160:1031-1034
24. Mathy-Hartert M, Damas P, Nys M, Deby-Dupont G, Can/vet JL, Ledoux D, Lamy M. Nitrated proteins in bronchoalveolar lavage fluid of patients at risk of ventilator-associated bronchopneumonia. Eur Respir J. 2000; 16:296-301.
25. Matute-Bello G, Liles WC, Radella F, Steinberg KP, RuzinskiJT, Jonas M, Chi EY, Hudson LD, Martin TR. Neutrophil apoptosis in the acute respiratory distress syndrome. Am J Respir Crit Care Med 1997; 156:1969-1977..
26. Parsey MV, Kaneko D, Shenkar R, Abraham £ Neutrophil apoptosis in the lung after hemorrhage or endotoxemia: apoptosis and migration are independent of IL-lb. Clin Immunol 91:219-225,1999
27. Matute-Bello G, Liles WC, Radella F2nd, Steinberg KP, RuzinskiJT, Hudson LD, Martin TR. Modulation of neutrophil apoptosis by granulocyte colony-stimulating factor during the course of acute respiratory distress syndrome. Crit Care Med 2000; 28: 1-7
28. Bohrer H, Qiu F, Zimmerman T, Zhang Y, Jllmer T, Mannel D, Bottiger BW, Stern DM, Waldherr R, Saeger HD, Ziegler R, BierhausA, Martin E, Nawroth PP. Role of NF-kB in the mortality of sepsis. J Clin Invest 1997; 156:1969-1977.
29. Schwartz MF, Moore ЕЕ, Moore FA et al. NF-kB is activated in alveolar macrophages from patients with acute respiratory distress syndrome. Crit Care Med 24:1285-1292,1996.
30. Mouithys-Mickalad A, Hans P, Deby-Dupont G, Hoebeke M, Deby C, Lamy M. Propofol reacts with peroxynitrite to form a phenoxyl radical: demonstration by electron spin resonance. Biochem Biophys Res Commun. 1998; 249: 833-837.
31. Mathy-Hartert M, Mouithys-Mickalad A, Kohnen S, Deby-Dupont G, Lamy M, Hans P. Effects of propofol on endothelial cells subjected to a peroxynitrite donor (SIN-1). Anaesthesia. 2000; 55:1066-1071.
32. Lockshin RA, Osborne B, Zakeri Z. Cell death in the third millenium. Editorial. Cell Death Differ 2000; 7:2-7.
