
- •Под редакцией профессора э. В. Недашковского
- •Отв. Редактор - проф. Э.Недашковский
- •Оглавление
- •Раздел 1. Вопросы общей анестезиологии
- •Раздел 2. Вопросы частной анестезиологии
- •Раздел 3. Регионарная анестезия, лечение боли
- •Раздел 4. Вопросы интенсивной терапии
- •Раздел 5. Общая информация
- •Раздел 6. Актуальные аспекты респираторной терапии
- •Раздел 1. Вопросы общей анестезиологии
- •Медикаментозное лечение интраоперационной ишемии миокарда
- •Принципы риска и безопасность
- •Раздел 1. Смерть младенца вследствие трудных родов
- •Раздел 2. Проблема оказания помощи
- •Участие ррак в переносе сигнальной информации и апоптозе
- •Ингибиторы ренин-ангиотензиновой системы и анестезия
- •Методы определения глубины анестезии
- •Анализ электроэнцефалограммы
- •Гипертрофическая обструктивная кардиомиопатия
- •Гемодинамические цели при митральной регургитации
- •163061, Архангельск, пр. Троицкий, 51, каб.330.
- •Одиночные или множественные подергивания?
- •Роль послеоперационной анальгезии при амбулаторных хирургических вмешательствах
- •Литература
- •Лечение хронических болевых синдромов детского возраста
- •Лекарства и плацента
- •Физиологические изменения фармакологии при беременности Сердечно-сосудистая система
- •2. Факторы, влияющие на плацентарный транспорт
- •2.1 Маточные факторы
- •2.2 Плацентарные факторы
- •2.3 Факторы плода
- •3. Анестезиологические препараты и трансплацентарный транспорт
- •3.1 Внутривенные препараты
- •3.2 Закись азота и галогенные анестетики
- •3.3 Миорелаксанты
- •3.4 Опиоиды ,
- •3.5 Местные анестетики и регионарная анестезия
- •Применение ларингеальной маски в акушерстве
- •Анестезиологический осмотр в акушерстве
- •24 Часов
- •I. Нужна ли госпитализация?
- •II. Тяжелые ожоги: что должно быть сделано до перевода в ожоговый центр?
- •1) Как поступить: охлаждать ожоги или согревать пациента?
- •2) Подготовка к дальнейшему лечению
- •3) Количество и состав сред инфузионной терапии
- •4) Анальгезия и седация '
- •5) Респираторная поддержка
- •6) Особые случаи
- •1. Мониторный контроль состояния кардио-респираторной системы и жидкостных секторов организма
- •1. Патогенез
- •1.1. Методика дилюционной тромбоцитопении и коагулопатии
- •1.2. Диссеминированное внутрисосудистое свертывание (двс)
- •1.3. Гипотермия
- •2.1. Профилактические компоненты терапии
- •2.2. Можем ли мы полагаться на клинические данные?
- •2.3. Можем ли мы полагаться на данные исследований гемостаза?
- •2.4. Дополнительные подходы
- •Вопрос 1: как пользоваться компасом в лесу информации?
- •Вопрос 3: насколько интересно название статьи? кто авторы? насколько различается профиль ваших лечебных учреждений?
- •Вопрос 4: четко ли изложены выводы работы в тезисах статьи?
- •Вопрос 5: надежда и вера: где гипотеза?
- •Вопрос 6: какие методы используются для сбора данных? насколько подробно они описаны?
- •Вопрос 7: как представлены средние величины?
- •Вопрос 8: были ли представлены наиболее важные клинические параметры и исходы?
- •Вопрос 9: достоверны ли результаты статистически? насколько они важны с клинической точки зрения?
- •Вопрос 10: верю ли я результатам прочитанной работы?
Раздел 5. Общая информация
ПРОПОФОЛ В ЭМУЛЬСИИ ТРИГЛИЦЕРИДОВ ДЛИННОЙ И СРЕДНЕЙ ЦЕПОЧЕК И. Рау, М.Ройцен, А.Донике, М.О'Коннор (Мюнхен, Германия) -пер. В.Антушев...................................................................................................204
КАК ЧИТАТЬ МЕДИЦИНСКИЕ ЖУРНАЛЫ: 10 ВОПРОСОВ О НАУКЕ
И.Виллар, А.Улиарте (Тенерифе, Испания) -пер. М.Киров............................207
ИНТРАОПЕРАЦИОННАЯ ГИПОТЕРМИЯ: ПРИЧИНЫ, ПАТОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ, ПРОФИЛАКТИКА (SIMS Portex) Бердикян А.С., Марченко А.В.......272
СОВРЕМЕННАЯ КОНЦЕПЦИЯ ОРГАНИЗАЦИИ ЭКСПРЕСС ДИАГНОСТИКИ НЕОТЛОЖНЫХ СОСТОЯНИЙ (Radiometer, Petrolab) Торшин В.А......................230
ПРИМЕНЕНИЕ БЛОКАТОРА Н2-РЕЦЕПТОРОВ ГИСТАМИНА ФАМОТИДИНА (КВАМАТЕЛА) В СХЕМЕ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ С ИСКУССТВЕННЫМ КРОВООБРАЩЕНИЕМ
Н.А. Трекова, А.Г. Яворовский, М. М. Шмырин, В. В. Гришин........................232
Раздел 6. Актуальные аспекты респираторной терапии
НЕИНВАЗИВНАЯ ИВЛ В ОТДЕЛЕНИЯХ ИНТЕНСИВНОЙ ТЕРАПИИ
Дж. Конти, М. Антонелли, С. Арзано (Рим, Италия) -пер.В.Кузьков..........238
СОВРЕМЕННЫЕ ДОСТИЖЕНИЯ В ТЕРАПИИ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА Кл. Левандовски, X. Лобрюннер (Берлин, Германия) -пер.В.Кузьков.........................................245
КРИВЫЕ ДАВЛЕНИЕ/ОБЪЕМ ПРИ РДСВ: СТАРЫЕ И НОВЫЕ АСПЕКТЫ
С. Карасон, О. Стенквист (Гетеборг, Швеция) пер. М. Романов................253
ИНФУЗИОННАЯ ТЕРАПИЯ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ Жан-Луи Винсен (Брюссель, Бельгия) - пер.В.Кузьков........261
БРОНХИАЛЬНАЯ АСТМА: КРАЙНЕ ТЯЖЕЛОЕ ТЕЧЕНИЕ
Артур Слутцки (Торонто, Канада) -пер.В.Кузьков........................................266
ВЕНТИЛЯТОР-АССОЦИИРОВАННОЕ ПОВРЕЖДЕНИЕ ЛЕГКИХ: ВЛИЯНИЕ ВЕНТИЛЯТОРА, ПЕРФУЗИИ И ПОЛОЖЕНИЯ
Алан Броккард (Лозанна, Швейцария) пер. М.Романов..................................271
ГАЗООБМЕН ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ
Горан Хеденстриерна (Уппсала, Швеция) пер. М.Романов...........................276
ТРАХЕОСТОМИЯ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
М.Квинтел (Мангейм, Германия) пер. М.Романов..........................................280
ТЕРАПИЯ ОТКРЫТЫХ ЛЕГКИХ В АНЕСТЕЗИИ И ИНТЕНСИВНОЙ ТЕРАПИИ
Д. Поэльма, Б. Лахманн (Роттердам, Нидерланды) -пер. А.Елисеев............283
Раздел 1. Вопросы общей анестезиологии
ПОЧЕМУ ВАШ ПАЦИЕНТ ПРЕКРАТИЛ ДЫШАТЬ?
Г.Друммонд (Эдинбург, Шотландия)
Остановка дыхания, развивающаяся вслед за введением анестетиков или седативных средств, общеизвестна и потенциально опасна. В данном обзоре обсуждаются факторы, которые вызывают центральное апноэ во время анестезии и седации и его непосредственные последствия.
Седативные и анестетики часто вызывают обструктивное апноэ, многие считают механические факторы одной из основных его причин. У пожилых пациентов, если не используется вспомогательная вентиляция, сопротивление дыхательных путей имеет большое значение, у молодых зависимость между изменением сопротивления и изменением вентиляции не играет решающей роли [1]. Факторы, вызывающие обструкцию дыхательных путей, разнообразны по своей природе, но более просты в понимании и устранении, поэтому в данном обзоре рассматриваться не будут.
Центральное апноэ (отсутствие дыхательных усилий) достаточно часто встречается во время внутривенной вводной анестезии. По большей части данное событие не влечет за собой каких-либо последствий, а при определенных условиях даже несет определенные преимущества. Апноэ, нередко возникающее после внутривенной индукции пропофолом, трактуется обычно как "несущественное событие, не требующее сложных мероприятий". Остановка дыхания, развивающаяся при использовании более старых внутривенных препаратов, рассматривается обычно уже как "побочное действие". Обеспечение спокойного перехода к спонтанному дыханию часто имеет отчетливое преимущество, но когда апноэ возникает неожиданно, оно может быть чревато серьезными осложнениями вплоть до летального исхода [2].
Какова же причина апноэ во время вводного наркоза? Наиболее распространенным объяснением является "дыхательная депрессия", вызываемая анестетиком. Это справедливо, поскольку большинство препаратов действительно вызывают угнетение дыхания. Глубина дыхательной депрессии обычно определяется значениями РаСО2 или СО2 в конце выдоха при спонтанном дыхании, другими словами, респираторным ответом на увеличение содержания углекислоты в крови. Следует помнить, что оба показателя не эквивалентны друг другу и строгого соответствия между ними нет. После внутривенного введения пропофола дыхательный ответ на увеличение концентрации двуокиси углерода угнетается в течение определенного промежутка времени, причем по продолжительности он дольше, чем при введении тиопентала [3]. Однако это не объясняет, почему после внутривенной индукции наступает полная остановка дыхания. Анестетики не способны абсолютно затормозить прохождение импульсов от хеморецепторов в дыхательный центр. Каротидные тела сохраняют способность отвечать на двуокись углерода и гипоксию даже при отсутствии дыхательной активности, а центральные хеморецепторы сохраняют активность [4,5] вплоть до снижения РСО2 до 0,5 КРа [6]. Таким образом, апноэ при вводной анестезии не является результатом отсутствия хеморецепторного ответа. К тому же, дыхание, как правило, восстанавливается, когда гиперкапнический ответ все еще угнетен пропофолом. Это подтверждает, что воздействие анестетиков на хеморецепторы, а также сила хеморефлексов, не являются причиной апноэ.
С другой стороны, даже самые мягкие анестетики при определенных условиях могут вызвать апноэ и стать причиной гипоксемии. Закись азота в концентрации во вдыхаемой смеси ниже 20% не способна вызвать дыхательную депрессию [7], но при активной вентиляции в концентрации с 50% кислорода при исследовании на добровольцах вызывала гипоксемию [8]. Предполагалось, что причиной является сама закись азота в альвеолах, но позднее было установлено, что причина заключается в гипервентиляции и дополнительном седативном воздействии, т.е. устранении боли и чувства беспокойства, стимулирующих вентиляцию [9].
Пациенты, у которых перед индукцией пропофолом имеется гипокапния, более склонны к апноэ после выключения сознания [10]. Создание модели повторного вдоха перед внутривенной индукцией может значительно снизить риск развития апноэ, тем самым облегчить переход к ингаляционной анестезии. Это может быть просто и надежно выполнено при помощи уменьшения притока свежего газа в дыхательный контур Ват (Mapleson D) [11], а также отключением адсорбера из системы циркуляции. Вероятность апноэ может быть снижена также за счет медленного введения пропофола (50 мг/мин). Это позволяет достичь более мягкого снижения вентиляции с тем, чтобы содержание двуокиси углерода в альвеолах и артериальной крови увеличивалось. Оба данных метода позволяют несколько увеличить значения содержания углекислоты в легких, крови и тканях головного мозга.
Концепцией, которая наилучшим образом объясняет апноэ при внутривенном введении, считается гипокапнический порог апноэ [12,13]. В течение многих лет физиологи утверждали, что снижение химических стимулов, присутствующих у здорового человека, может привести к развитию апноэ. Однако продемонстрировать это на практике у пациента с сохраненным сознанием удается далеко не всегда (Рисунок 1).
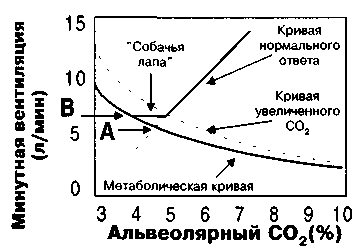
Рисунок 1. Нормальный ответ представлен восходящей прямой, продолжая которую (пунктирная линия) в месте пересечения с метаболической кривой (жирная кривая), получаем точку А, соответствующую продукции двуокиси углерода. При наличии дыхательных стимулов нехимического происхождения, вентиляция устанавливается выше этой точки, и альвеолярное значение двуокиси углерода соответствует точке В. Когда кривая ответа выстроена с учетом увеличенного СO2, вентиляция остается неизменной до тех пор, пока альвеолярный СO2 не становится существенным стимулом (пересечение кривой ответа и увеличенной СO2). Длина этой горизонтальной части, так называемой "собачьей лапы", демонстрирует степень нехимической стимуляции.
Первоначально "пороговым значением" считалась точка, где кривая ответа СО2 предполагала нулевую вентиляцию, т.е. когда ответ на увеличение углекислоты экстраполировался назад, к значениям ниже состояния покоя. ПпК показал, что для того, чтобы вызвать апноэ посредством гипервентиляции, необходимо выключение сознания, и что остановка дыхания наступает, когда уровень углекислоты лишь незначительно уступает значению покоя. В состоянии сна и во время анестезии даже легкая гипервентиляция может вызвать апноэ и торможение инспираторной мышечной активности [14-17].
Данный феномен продемонстрирован на различных анестетиках. Даже эфир, который считается стимулятором дыхания, вызывает апноэ, если в результате гипервентиляции уровень углекислоты становится ниже порогового значения [18].
Остановка дыхания развивается независимо от того, осуществляется дыхание на фоне нормокапнии или угнетения ответа на СО2, если альвеолярная концентрация углекислоты снижается до 0,5%, а пациент находится в состоянии сна или выключения сознания. Как только углекислота превышает пороговое значение, дыхание возобновляется с параметрами, достаточными для поддержания альвеолярной вентиляции. При увеличении дозы анестетика происходит дозозависимое изменение порогового значения.
Как регулируется дыхание в состоянии сознания?
Вероятно, не за счет двуокиси углерода! Обычно при спонтанном дыхании величина CO2 ниже значений, необходимых для включения рефлекторного механизма. Стимулы, действующие в сознании, включают в себя компоненты волевой активности, эмоционального состояния и общего бодрствования.
Дыхательная мускулатура имеет, по крайней мере, два пути регуляции. Волевой контроль коры головного мозга проходит через дорзолатеральные пути спинного мозга к контралатеральным респираторным моторным нейронам. Автоматическая регуляция, осуществляемая продолговатым мозгом, происходит посредством вентролатеральных путей [19].
Сон
Потеря волевой активности наступает одновременно с наступлением сна или утратой сознания [20], т.е. происходит прекращение кортикального воздействия на дыхание [21]. Дыхание становится поверхностным [22], периодически приобретает нерегулярный и атаксичный характер [23]. Реальное состояние сна играет при этом более важную роль, чем стимулы, которые поддерживают состояние бодрствования [24,25]. В состоянии сна бодрствование и вентиляция тесно связаны между собой [26]. Быстрое засыпание может привести к нестабильности дыхания [27].
В не-REM стадии сна пассивная гипервентиляция вызывает апноэ так же, как и во время анестезии [12,28]. Пороговое значение СО2 для восстановления дыхания достаточно невелико, около 3 мм рт.ст., или 0,5 КРа [28,29]. В REM-стадии сна в эксперименте на собаках после гипервентиляциии наступления остановки дыхания не наступало, что соответствует отсутствию центрального апноэ и периодического дыхания у людей во время RЕМ-стадии сна [30].
Бодрствование
Некоторые методики позволяют распознать изменения ответа на СО2, когда пациент находится в состоянии бодрствования и гипокапнии [31], другие находят, что у пациентов со вспомогательной вентиляцией [32] ответ носит скорее постепенный характер, нежели пороговый. Исследования в этой сфере затруднены, поскольку характер ответа в значительной степени зависит от "сознательной" или "послеразрядовой" гипервентиляции [33]. В состоянии бодрствования инспираторная активность может тормозиться поддержкой по давлению [34], но рефлекторный путь не ясен, хотя, вероятно, не через мускулатуру грудной стенки.
Для пациентов с сердечной [35] недостаточностью характерен более низкий порог СО2, что, по-видимому, объясняет, почему при наступлении сна у них отмечается нерегулярное дыхание. Во время сна дыхание у них становится более регулярным при гипероксии и гиперкапнии, однако, это не приводит к углублению сна и вызывает увеличение симпатической стимуляции[36].
Существуют ли условия, при которых в состоянии бодрствования только хемореф-лексы являются стимуляторами дыхания? Вероятно, да, но достаточно редко: "состояние покоя без стимуляции" [37] можно наблюдать в течение короткого промежутка времени перед наступлением сна, или при наличии стимулов, прерывающих его. Даже взгляда на определенный объект или мысли о предстоящей физической нагрузке бывает достаточно, чтобы вызвать стимуляцию дыхания! Конечно, многие факторы оказывают сильное
влияние на дыхание и изменяют порог, в частности, страх и боль. Во время обезболивания летучими анестетиками хирургическая стимуляция снижает порог, когда двуокись углерода начинает стимулировать дыхание, но не влияет на CU2 ответ [38-40]. У пациентов при сохраненном сознании экспериментальная боль стимулирует дыхание и уменьшает угнетающее воздействие опиоидов [41], и во время анестезии наблюдается медленно нарастающая стимуляция дыхания, по крайней мере, в течение минуты после кожного разреза [42].
Что происходит, когда значения концентрации СO2 находятся ниже порога срабатывания? По-видимому, дыхательный водитель ритма при этом останавливается в фазе выдоха. Мускулатура выдоха тонически активна и фазные изменения наступают только тогда, когда увеличивается уровень СО2 и, начинается процесс дыхания [16]. Включение дыхательного цикла происходит с началом движения грудной клетки внутрь, что указывает на наступление тонической активности. Активность хеморецепторов во время апноэ оказывает непосредственное воздействие на эту активность [43].
Седация
Данное состояние достаточно сложно изучать в лабораторных условиях, поскольку оно часто вызывает наступление сна. Здесь наблюдается взаимодействие двух факторов: пробуждение может вызвать у умеренно седатированного пациента состояние полного бодрствования, оставление его в покое может привести к быстрому погружению в глубокий сон. Подобные изменения оказывают воздействие на дыхательную регуляцию и на хеморефлексы. Например, при седации 0,1 MAC изофлюрана дыхательный ответ на гипоксию угнетается на 10%, когда глаза пациента открыты, и на 46%, когда ему позволяют закрыть глаза [44].
Становится понятным, почему столь противоречивы результаты исследований седативных препаратов, в частности бензодиазепинов, относительно их воздействия на дыхание. Многие исследования указывают, что бензодиазепины оказывают угнетающее воздействие на дыхание и могут вызвать апноэ и гипоксемию в условиях клиники [45] и эксперимента [46], причем другие утверждают, что подобное воздействие весьма незначительно. Неинвазивные методы измерения параметров внешнего дыхания [47,48] с меньшей вероятностью могут поддерживать состояние бодрствования и, следовательно, выявить депрессию, при этом трудно определить, чем вызвана депрессия, воздействием препарата, наступлением сна или нарушением проходимости дыхательных путей [49].
Другим фактором, оказывающим воздействие на клинический ответ, является частота и способ введения. В более ранних исследованиях утверждалось, что медленное введение мидазолама также оказывает воздействие на дыхание, исследуемые субъекты ежеминутно вербально тестировались, и у них регистрировалась гиперкапния [50]. В клинической практике очень медленное введение с меньшей вероятностью вызывают чрезмерную седацию и сон.
Комбинации
В одном серьезном исследовании продемонстрировано, что при одновременном введении 3,5 мг мидазолама и 140 мкг фентанила за 1 мин апноэ развивалось в половине случаев в течение 5 минут после введения (несмотря на дыхание через воздуховод и пробуждение при отсутствии дыхания более 15 сек) [51]. Мидазолам, вводимый отдельно, никогда не вызывал угнетения дыхания. Когда мидазолам комбинировали с реми-фентанилом для интраоперационной седации, а инфузию опиоида начинали медленно, апноэ не развивалось. Наблюдалось дозозависимое уменьшение частоты дыхания у пациентов, получающих более высокие дозы мидазолама, которое восстанавливалось в течение 15 минут [52].
Определенную опасность представляют резкие изменения состояния сна, седации и химической чувствительности. При постепенном изменении этих условий регистрировалась медленная депрессия внешнего дыхания и увеличение уровня углекислоты. Это увеличение достигало порога апноэ, достаточного для продолжения спонтанного дыхания. С другой стороны, у пациента, у которого отсутствует выраженное сознательное побуждение к дыханию, вызванное страхом или болью, при быстром введении опиоида, седативных или их комбинации, вслед за выключением сознания наступает апноэ.
Что происходит во время апноэ?
Двуокись углерода обладает способностью к кумуляции [53]. Этот процесс проходит 2 стадии. Прежде всего, содержание альвеолярной углекислоты увеличивается, чтобы уравнять концентрацию со смешанной венозной кровью. Для этого требуется 50 мл двуокиси углерода и время около 10 сек [54]. После этого организм начинает кумулировать СО2- Скорость увеличения концентрации невелика, не более 1 kPa/мин, т.к. способность к накоплению СO2 у организма очень велика [55].
Изменение парциального давления кислорода зависит от содержания газа в альвеолах, состояния верхних дыхательных путей и дыхательной смеси в зоне открытия дыхательных путей (если контур открыт). Эти изменения могут быть предсказаны при использовании компьютерной стимуляции [56] и также достаточно изучены экспериментально [57].
Наиболее неблагоприятная ситуация складывается в случае обструкции дыхательных путей при дыхании окружающим воздухом. По мере всасывания кислорода легочной объем снижается. Степень сокращения объема кислорода зависит от минутного объема сердца [58].
Если дыхательные пути остаются открытыми, воздух поступает в легкие и дополняет поглощенный кислород, поэтому снижение содержания его в крови происходит не так быстро [59].
После преоксигенации скорость десатурации снижается в связи с увеличением запасов кислорода в альвеолярном воздухе. В дополнение к этому, если дыхательные пути открыты и соединены с подачей кислорода, абсорбция кислорода происходит более интенсивно, что позволяет поддержать оксигенацию (но не элиминацию углекислоты).
Сердечно-сосудистый эффект апноэ связан, главным образом, с гипоксемией [60]. Даже когда гиперкапния и гипоксия еще не оказывают повреждающего воздействия, создавая стрессовую ситуацию, они оказывают существенное кардиоваскулярное воздействие [61].
Респираторный эффект. Восстанавливается ли дыхание при апноэ до возникновения серьезных последствий? В большинстве случаев да, в частности, при вводной анестезии при наличии адекватной преоксигенации. Это связано с тем, что порог апноэ находится лишь чуть ниже точки, в которой двуокись углерода может поддерживать дыхание без волевого (сознательного) стимула. Только одной минуты дыхания с повторным вдохом достаточно, чтобы предотвратить развитие "индукционного апноэ".
Однако в отдельных случаях апноэ может быть продленным. Во-первых, после непреднамеренного введения слишком высокой дозы опиоида пациенту, когда устраняется сам "порог". Как кумуляция слишком высокого количества углекислоты, так и уменьшение эффекта опиоида может занять несколько минут.
Во-вторых, вероятно в наиболее серьезной ситуации, "неотложное" введение опиоида или седативного препарата беспокойному или страдающему от боли пациенту в качестве добавления при наличии недостаточной или стихающей периферической блокады нервов. Принцип медленного введения для снижения количества осложнений не должен становиться жертвой стремления получить лучший контроль над ситуацией у пациента, который уже находится в состоянии гипокапнии.
В заключение, чреватая наибольшим риском ситуация, когда опиоид или седативные препараты вводятся при кратковременной, но интенсивной боли: болевой раздражитель, одновременно стимулятор дыхания прекращается до окончания действия препарата, но уже после вывода пациента из палаты пробуждения. Такой пациент, которому уже не проводится мониторинг с помощью пульсоксиметрии, находится в состоянии наибольшего риска [62].
Литература
1. Kay A, Trinder 3, Kim Y. Individual differences in the relationship between upper airway resistance and ventilation during sleep onset JAppI Physio/1995; 79: 411-19
2. Cap/an RA, Ward RJ, Posner K, Cheney FW. Unexpected cardiac arrest during spinal anesthesia: A closed claims analysis of pre-disposing factors Anesthesiol 1988; 68:5-11
3. Blouin RT, Conard PF, Gross Ж Time course of ventilatory depression following induction doses of propofol and thiopental Anesthesiol 1991; 75: 940-944
4. Lahiri S, Mokashi A, Delaney RG, Fishman AP. Arterial PO2 and PCO2 stimulus threshold for carotid chemoreceptors and breathing Respir Physiol 1978; 34:359-75
5. De Goede J, Berkenbosch A, Olievier C, Quanjer PH. Ventilatory response to carbon dioxide and apnoeic thresholds Respir Physiol 1981; 45:185-99
6. Berkenbosch A, Van Beek JHGM, Olievier CN, et at. Central respiratory CO2 sensitivity at extreme hypocapnia Respir Physiol 1984; 55: 95-102
7. Dahan A, Ward OS. Effect of 20% nitrous oxide on the ventilatory response to hypercapnia and sustained isocapnic hypoxia in man BrJAnaesth 1994; 72:17-20
8. Wilkins CJ, Reed PN, Aitkenhead AR. Hypoxaemia after inhalation of 50% nitrous oxide and oxygen Br J Anaesth 1989; 63: 346-47
9. Northwood D, Saps ford DJ, Jones JG, Griffiths D, Wilkins C. Nitrous oxide sedation causes post-hyperventilation apnoea BrJ Anaesth 1991; 67: 7-12
10. Drummond GB, EI-Farhan /VMM. Do anxiety or hypocapnia predispose to apnoea after induction of anaesthesia? BrJAnaesth 1997; 78:153-56
11. Guracha Boru K, Drummond GB. Comparison of breathing methods for inhalation induction of anaesthesia Br J Anaesth 1999; 83: 650-653
12. Fink BR. Influence of cerebral activity in wakefulness on regulation of breathing J Appl Physiol 1961; 16:15-20
13. DempseyJA, SkatrudJB. A sleep-induced apneic threshold and its consequences Am Rev Respir Dis 1986; 133:1163-70
14. Gesell R, Lapides J, Levin M. The interaction of central and peripheral control of breathing Am J Physiol 1940; 130:155-70
15. Eldridge FL Posthyperventilation breathing: different effects of active and passive hyperventilation J Appl Physiol 1973; 34: 422-30
16. Hanks EC, Ngai SH, Fink BR. The respiratory threshold for carbon dioxide in anesthetized man Anesthesiol 1961; 22:393-97
17. Boden AG, Harris MC, Parkes MJ. Apneic threshold for CO2 in the anesthetized rat: fundamental properties under steady-state conditions J Appl Physiol 1998; 85:898-907
18. Hickey RF, Fourcade HE, Eger El eta/. The effects of ether halothane and forane on apneic thresholds in man Anesthesiol 1971; 35:32-37
19. Aminoff MJ, Sears ТА. Spinal integration of segmental, cortical and breathing inputs to thoracic respiratory motoneurons J Physiol (Lond) 1971; 215: 557-75
20. Carskadon, M. A. and Dement, W. C. Normal human sleep: an overview. 1994; 2:16-25
21. Murphy K, Mier A, Adams L, Guz A. Putative cerebral cortical involvement in the ventilatory response to inhaled CO2 in conscious man J Physiol (Lond) 1990; 420:1-18
22. Naifeh KH, Kamiya J. The nature of respiratory changes associated with sleep onset Sleep 1981; 4:49-59
23. Bainton CR, Mitchell RA. Posthyperventilation apnea in awake man J Appl Physiol 1966; 21:411 -15
24. Hunter JD, McLeod JZ, Milsom WK. Cortical activation states in sleep and anesthesia. II: Respiratory reflexes Respir Physiol 1998; 112:83-94
25. Hunter JD, Milsom WK. Cortical activation states in sleep and anesthesia. I Cardiorespiratory effects Respir Physiol 1998; 112: 71-81
26. Trinder J, VanBeveren JA, Smith P, Kleiman J, Kay A. Correlation between ventilation and EEC-defined arousal during sleep onset in young subjects J Appl Physiol 1997; 83:2005-11
27. Khoo MCK, Gottschalk A, Pack AI. Sleep-induced period breathing and apnea: a theoretical study J Appl Physiol 1991; 70: 2014-24
28. Datta AK, Shea SA, Homer RL, Guz A. The influence of induced hypocapnia and sleep on the endogenous respiratory rhythm in humans J Physiol (Lond) 1991; 440:17-33
29. Ingrassia TS III, Nelson SB, Harris CD, Hubmayr RD. Influence of sleep state on CO2 responsiveness Am Rev Respir Dis 1991; 144:1125-29
30. XI L, Smith CA, Saupe KW, Henderson KS, Dempsey JA. Effects of rapid-eye-movement sleep on the apneic threshold in dogs J Appl Physio/1993; 75:1129-39
31. Cummin ARC, Sidhu VS, Те/ford RJ, Saunders KB. Ventilatory responsiveness to carbon dioxide below the normal control point in conscious normoxic humans Eur Respir J1992; 5:512-18
32. Patrick W, Webster K, Puddy A, Sanii R, Younes M. Respiratory response to CO2 in the hypocapnic range in awake humans J Appl Physio/1995; 79:2058-68
33. Meah MS, Gardner WN. Post-hyperventilation apnoea in conscious humans J Physio/ (Lond) 1994; 477:527-38
34. Lofaso F. Does nonchemical inhibition of respiratory output occur during mechanical ventilation? Eur Respir J 1999; 14:487-89
35. Prechter GC, Nelson SB, Hubmayr RD. The .ventilatory recruitment threshold for carbon dioxide Am Rev Respir Dis 1990; 141: 758-64
36. Andreas S, Weidel K, Hagenah G, Heindl S. Treatment of Cheyne-Stokes respiration with nasal oxygen and carbon dioxide Eur Respir 31998; 12: 414-19
37. Mazziotta JC, Phelps ME, Miller J, Kuhl DE. Tomographic mapping of human cerebral metabolism: normal unstimulated state. Neurology 1981; 31:503-16
38. Lam AM, Clement JL, Knill RL Surgical stimulation does not enhance ventilatory chemoreflexes during enflurane anaesthesia in man CanadAnaesth SocJ 1980; 27:22-28
39. Eger El, Do/an WW, Stevens WC, Miller RD, Way WL Surgical stimulation antagonizes the respiratory depression produced . by forane Anesthesiol 1972; 36: 544-49
40. Nishino T, Kochi T. Effects of surgical stimulation on the apnoeic thresholds for carbon dioxide during anaesthesia with sevoflurane BrJAnaesth 1994; 73:583-386
41. Borgbjerg FM, Nielsen K, Franks J. Experimental pain stimulates respiration and attenuates morphine-induced respiratory depression: a controlled study in human volunteers. Pain 1996; 64:123-28
42. Sutherland RW, Drummond GB. Effects of surgical skin incision on respiration in patients anaesthetized with enflurane BrJ Anaesth 1996; 76: 777-79
43. Homer RL, Kozar LF, Phillipson EA. Tonic respiratory drive in the absence of rhythm generation in the conscious dog. J Appl Physiol 1998; 76: 671-80
44. van den Elsen MJU, Dahan A, Berkenbosch A et.al. Does subanaesthetic isoflurane affect the ventilatory response to acute isocapnic hypoxia in healthy volunteers? Anesthesiol 1994; 81: 860-867
45. Bell GD, Reeve PA, Moshiri PM et.al. Intravenous midazolam: a study of the degree of oxygen desaturation occuring during upper gastrointestinal endoscopy BrJ Clin Pharm 1987; 23:703-8
46. Gross JB, Smith L, Smith TC. Time course of ventilatory response to carbon dioxide after intravenous diazepam Anesthesiol 1982; 57:18-21
47. Morel DR, ForsterA, Bachmann M, Suter PM. Effect of intravenous midazolam on breathing pattern and chest wall mechanics in humans J Appl Physiol 1984; 57:1104-10
48. Forster A, Morel D, Bachmann M, Gemperie M. Respiratory depressant effects of different doses of midazolam and lack of reversal with naloxone- a double blind randomized study Anesth Analg 1983; 62:920-924
49. Montravers P, Dureuil B, Desmonts JM. Effects of I. V. midazolam on upper airway resistance BrJAnaesth 1992; 68:27-31
50. Alexander CM, Teller LM, Gross JB. Slow injection does not prevent midazolam-induced ventilatory depression Anesth Analg 1992; 74: 260-264
51. Bailey PL, Pace NL, Ashburn MA et.al. Frequent hypoxemia and apnea after sedation with midazolam and fentanyl Anesthesiol 1990; 73: 826-30
52. Avramov MN, Smith I, White PF. Interactions between midazolam and remifentanil during monitored anesthesia care Anesthesiol 1996; 85:1283-89
53. Martin-Larrauri R, Callol L, Guasch M et.al. The theoretic blood pH evolution secondary to rise of alveolar tension of carbon dioxide during apnoea in anaesthetized humans Respir Med 1995; 89:393-94
54. Stock MC, Downs JB, McDonald JS et.al. The carbon dioxide rate of rise in awake apneic humans Journal of Clinical Anesthesia 1988; 1:96-99
55. Ivanov SD, Nunn JF. Influence of me duration of hyperventilation on rise time of PCO2 after step reduction on ventilation Respir Physiol 1968; 5:243-49
56. VerhoeffF, Sykes MK. Delayed detection of hypoxic events by pulse oximeters: computer simulations Anaesthesia 1990; 45: 103-9
57. Fletcher EC, Costarangos C, Miller T. The rate of fall of arterial oxyhemoglobin saturation in obstructive sleep-apnea Chest 1989; 96: 717-22
58. Fletcher EC, White SG, Munafo D et.al. Effect of cardiac output reduction on rate of desaturation in obstructive apnea Chest 1991; 99: 452-56
59. Fletcher EC, Goodnight-White S, Munafo D et.al. Rate of oxyhemoglobin desaturation in obstructive versus nonobstructive apnea Am Rev Respir Dis 1991; 143: 657-60
60. Chen L, Sica AL, Greenberg H, ScharfSM. Role of hypoxemia and hypercapnia in acute cardiovascular response to periodic apneas in sedated pigs Respir Physiol 1998; 111: 257-69
61. Morgan BJ, Crabtree DC, Palta M, SkatrudJB. Combined hypoxia and hypercapnia evokes long-lasting sympathetic activation in humans J Appl Physiol 1995; 79: 205-13
62. Tiret L, Desmonts JM, Hatton F. Complications associated with anaesthesia - a prospective survey in France Canad Anaesth SocJ 1986; 33:336-44
