
- •Под редакцией профессора э. В. Недашковского
- •Отв. Редактор - проф. Э.Недашковский
- •Оглавление
- •Раздел 1. Вопросы общей анестезиологии
- •Раздел 2. Вопросы частной анестезиологии
- •Раздел 3. Регионарная анестезия, лечение боли
- •Раздел 4. Вопросы интенсивной терапии
- •Раздел 5. Общая информация
- •Раздел 6. Актуальные аспекты респираторной терапии
- •Раздел 1. Вопросы общей анестезиологии
- •Медикаментозное лечение интраоперационной ишемии миокарда
- •Принципы риска и безопасность
- •Раздел 1. Смерть младенца вследствие трудных родов
- •Раздел 2. Проблема оказания помощи
- •Участие ррак в переносе сигнальной информации и апоптозе
- •Ингибиторы ренин-ангиотензиновой системы и анестезия
- •Методы определения глубины анестезии
- •Анализ электроэнцефалограммы
- •Гипертрофическая обструктивная кардиомиопатия
- •Гемодинамические цели при митральной регургитации
- •163061, Архангельск, пр. Троицкий, 51, каб.330.
- •Одиночные или множественные подергивания?
- •Роль послеоперационной анальгезии при амбулаторных хирургических вмешательствах
- •Литература
- •Лечение хронических болевых синдромов детского возраста
- •Лекарства и плацента
- •Физиологические изменения фармакологии при беременности Сердечно-сосудистая система
- •2. Факторы, влияющие на плацентарный транспорт
- •2.1 Маточные факторы
- •2.2 Плацентарные факторы
- •2.3 Факторы плода
- •3. Анестезиологические препараты и трансплацентарный транспорт
- •3.1 Внутривенные препараты
- •3.2 Закись азота и галогенные анестетики
- •3.3 Миорелаксанты
- •3.4 Опиоиды ,
- •3.5 Местные анестетики и регионарная анестезия
- •Применение ларингеальной маски в акушерстве
- •Анестезиологический осмотр в акушерстве
- •24 Часов
- •I. Нужна ли госпитализация?
- •II. Тяжелые ожоги: что должно быть сделано до перевода в ожоговый центр?
- •1) Как поступить: охлаждать ожоги или согревать пациента?
- •2) Подготовка к дальнейшему лечению
- •3) Количество и состав сред инфузионной терапии
- •4) Анальгезия и седация '
- •5) Респираторная поддержка
- •6) Особые случаи
- •1. Мониторный контроль состояния кардио-респираторной системы и жидкостных секторов организма
- •1. Патогенез
- •1.1. Методика дилюционной тромбоцитопении и коагулопатии
- •1.2. Диссеминированное внутрисосудистое свертывание (двс)
- •1.3. Гипотермия
- •2.1. Профилактические компоненты терапии
- •2.2. Можем ли мы полагаться на клинические данные?
- •2.3. Можем ли мы полагаться на данные исследований гемостаза?
- •2.4. Дополнительные подходы
- •Вопрос 1: как пользоваться компасом в лесу информации?
- •Вопрос 3: насколько интересно название статьи? кто авторы? насколько различается профиль ваших лечебных учреждений?
- •Вопрос 4: четко ли изложены выводы работы в тезисах статьи?
- •Вопрос 5: надежда и вера: где гипотеза?
- •Вопрос 6: какие методы используются для сбора данных? насколько подробно они описаны?
- •Вопрос 7: как представлены средние величины?
- •Вопрос 8: были ли представлены наиболее важные клинические параметры и исходы?
- •Вопрос 9: достоверны ли результаты статистически? насколько они важны с клинической точки зрения?
- •Вопрос 10: верю ли я результатам прочитанной работы?
Вопрос 7: как представлены средние величины?
Результаты исследования, как правило, представляют в числовом отображении. Тем не менее, в ряде случаев авторы заходят слишком далеко, когда пытаются представить
14 Зак. 1581
все параметры как М±8 или М±т, предполагая, что все величины следуют нормальному распределению. Помните, что время, возраст, периоды нахождения и температура, как правило, не подлежат нормальному распределению. Представьте себе группу из 100 больных, половине из которых 20 лет, а другой половине - 80 лет. Среднее значение возраста при этом будет 50±20 лет, однако ни у одного из больных возраст не составляет 50, 30 или 70 лет. Эта ошибка наиболее распространена в большинстве научных статей.
Вопрос 8: были ли представлены наиболее важные клинические параметры и исходы?
Насколько важны изучаемые параметры для Ваших больных? Исходя из Вашего клинического опыта, постарайтесь представить, какие параметры Вы стали бы оценивать на месте авторов? Часто результаты исследования не позволяют сделать вывод о снижении летальности, но могут открыть другие важные механизмы. Критическая оценка статьи поможет Вам определить, приносит ли исследуемое вмешательство больше пользы или вреда.
Многие из общепринятых взглядов на целый ряд медицинских проблем сформированы на основе единичных клинических случаев и не подтверждены результатами когорт-ных или рандомизированных исследований. Сообщение о клиническом случае описывает в форме статьи развитие ситуации с применением того или иного вмешательства у одного или нескольких пациентов. Хотя этот вид исследования традиционно обладает малой доказательной силой, он позволяет представить широкий спектр информации о пациенте. Проведение клинического исследования часто заставляет ограничить изучаемые параметры более узким перечнем параметров. Один из наиболее ярких исторических примеров, демонстрирующих важность-описания клинических случаев, включает в себя сообщение McBride (1961 г.), которое показало возможность повреждения плода на фоне приема талидомида.
Вопрос 9: достоверны ли результаты статистически? насколько они важны с клинической точки зрения?
Насколько велики эффекты вмешательства? Клиническая значимость этих эффектов определяется практической важностью различий между контрольной и опытной группами. Если различия статистически достоверны, насколько это значимо с клинической точки зрения? Если различия статистически недостоверны, было ли исследование достаточно большим для того, чтобы выявить потенциально возможные клинические различия?
Если статья не показывает, что исследуемый метод приносит больше пользы, чем вреда и не демонстрирует его влияния на клинический исход, не тратьте своего времени на чтение этой работы.
Вопрос 10: верю ли я результатам прочитанной работы?
Вы можете отнести статью к списку исследований, которые направлены, главным образом, на бесполезный подсчет больных, параметров и тестов, в следующих ситуациях:
Название статьи неинтересно или бесполезно
Авторы не обладают хорошей репутацией
Результаты работы бесполезны
Результаты неприменимы в Вашей клинической практике
Отсутствует независимое слепое сравнение с золотым стандартом диагностики
Не было проведено .проспективного когортного исследования
Методы проведения исследования не отвечают его характеру Распределение больных на группы не является рандомизированным
Всегда помните, что клинические записи не всегда точно отражают реальное состояние пациента.
Литература *
1. Altman DC. The scandal of poor medical research. BMJ1994; 308:283-4.
2. Oxman AD, Sackett DL, Guyatt GH. Users 'Guides to the Medical Literature. I. How to get started. JAMA 1993;270:2093-95.
3. Sackett DL, Haynes RB, Tugwell P. How to read a clinical journal. In: Clinical Epidemiology, Little Brown and Co., Toronto, 1985, pp 285-321.
4. Greenhalgh T. How to read a paper. Getting your bearings (deciding what the paper is about). BMJ 1997; 315:243-6.
5. McBrideWG. Thalidomide and congenital abnormalities. Lancet 1961; ii:1358.
УВАЖАЕМЫЕ ЧИТАТЕЛИ!
А.ЗАШИХИН, Я.СЕЛИМ
ВИСЦЕРАЛЬНАЯ ГЛАДКАЯ
МЫШЕЧНАЯ ТКАНЬ
A.ZASHIKHIN, J.SEHUN
VISCERAL SMOOTH
MUSCLE TISSUE
Издательством Северного государственного медицинского
университета
выпущена в свет книга
«Висцеральная гладкая мышечная ткань»
Авторы: А.Л. Зашихин, Я. Селин
В монографии обобщены результаты исследований авторов и данные литературы, касающиеся проблемы гистогенетического развития и морфофункциональной организации гладкой мышечной ткани различных внутренних органов. На основе обширного фактического материала, полученного с использованием новейших методов исследования, проведен анализ гистогенеза и показана динамика формирования структурно-метаболических параметров гладких ми-оцитов висцеральной гладкой мускулатуры человека и лабораторных животных. Обосновано и сформулировано новое положение о неоднородности популяции гладких мышечных клеток в составе ткани, рассмотрены основные фенотипы гладких миоцитов и дана их развернутая характеристика. Обсуждены цитофизиологические механизмы регуляции функции, а также видовые, межорганные и внут-риорганные особенности организации гладкой мышцы.
Материал, представленный в монографии, может быть полезен широкому кругу специалистов-морфологов, физиологов, биологов, патологов, а также студентам медицинских и биологических вузов.
Издательский центр СГМУ принимает заказы на эту книгу, готов рассмотреть Ваши пожелания и предложения
по адресу:
163061, Архангельск, пр. Троицкий, 51, каб. 330.
Телефоны для справок (8182) 20-61-90,64-03-42
E-mail: pub@asma.ru
ИТРАОПЕРАЦИОННАЯ ГИПОТЕРМИЯ: ПРИЧИНЫ, ПАТОГЕНЕТИЧЕСКОЕ
ЗНАЧЕНИЕ, ПРОФИЛАКТИКА.
Бердикян АС, Марченко АВ.
Интраоперацйонная гипотермия (Г) является серьезной проблемой современной хирургии и на протяжении последних лет привлекает к себе повышенное внимание. Сопровождая от 60 до 90% хирургических вмешательств (13,21), Г задерживает выход из анестезии (30), продлевает период послеоперационного наблюдения в ПИТ (21), сопутствует развитию серьезных послеоперационных осложнений (например, связанных с нарушением функции тромбоцитов (27)). Следствием Г являются: увеличение объема кровопотери (80,81), повышение частоты послеоперационных кардиальных осложнений (27), замедление репаративных процессов, увеличение частоты инфицирования ран и сроков пребывания в стационаре (2,20).
Являясь постоянным спутником длительных хирургических вмешательств, тяжелых травм (66,10) и ситуаций, требующих массивных трансфузий (23), Г. развивается и при коротких (продолжительностью до 1 ч) операциях (4). Наибольший темп снижения температуры отмечается в первый час пребывания пациента в операционной, что связано с температурным режимом помещений (при Т в операционной ниже 21° С гипотермия развивается у 100% оперируемых больных (85,51), вынужденным неподвижным положением, обработкой кожи холодными растворами антисептиков, внутривенной инфузией холодных растворов (23,8), ингаляцией холодной газонаркотической смеси и специфическим действием анестезиологических препаратов, блокирующих защитные рефлексы организма на действие холода.
В большей степени подвержены гипотермии дети и пациенты старшего возраста (4,76,77). Одним из следствий Г является увеличение потребления кислорода вследствие тканевой гипоксии, поэтому Г может быть крайне опасна у пациентов со скомпроменти-рованным миокардом, а также с патологией свертывающей системы (за счет нарушения функции тромбоцитов, активации фибринолитического каскада и торможения активности тромбообразующих ферментов при охлаждении крови (35)).
Имеющиеся в отечественной и зарубежной литературе данные о негативной роли ин-тра- и послеоперационной гипотермии указывают на необходимость углубленного изучения данного явления, способов его предупреждения и устранения. Например, Mahoney СВ, Odom J.(49) установили, что среднее снижение Т всего на 1,5 градуса от нормы (легкая степень гипотермии) является причиной возникновения ряда осложнений послеоперационного периода, увеличивающих стоимость лечения от 2,500 до 7,000 $ США на одного пациента в зависимости от типа хирургического вмешательства. Становится очевидным, что с экономической точки зрения намного выгоднее предотвратить интраопе-рационную гипотермию, чем лечить спровоцированные ей осложнения.
Под Г понимают снижение центральной температуры тела ниже 36° С. Клинически выделяют три степени Г: легкая (34-36° С), умеренная (32-34° С) и тяжелая (<32° С)(53). Известно, что температура тела человека регулируется взаимодействием механизмов теплопродукции, теплоотдачи и теплоизоляции. Терморегуляция представляет собой сложнорефлекторный акт, охватывающий почти все функции организма, и направлена на балансирование процессов теплопродукции и теплоотдачи.
Источником теплопродукции служат процессы обмена веществ и энергии, непрерывно идущие в организме. Теплоотдача осуществляется путем механизмов кондукции (теплоотдача из внутренних частей тела к поверхности кожи), конвекции (перенос теплоты кровью или тепломассоперенос), излучением и испарением с поверхности кожи, дыхательных путей, операционной раны, при этом основную роль играет кондукция.
Количество тепла, образующееся в органах и тканях, различно. 50-60% всего тепла образуется в мышцах. Благодаря антигравитационному (терморегуляционному) тонусу теплообразование в мышцах происходит и в состоянии покоя, и при температуре комфорта. При физической нагрузке теплообразование может увеличиваться в 10 раз. Терморецепторы подразделяются на три группы: экстеротерморецепторы кожи, интратер-морецепторы кровеносных сосудов и внутренних органов и терморецепторы ЦНС. В зависимости от реакции на изменение Т, различают холодовые и тепловые рецепторы. Центром терморегуляции считается гипоталамус. В пределах гипоталамуса выделяют «центр теплоотдачи» (передний отдел гипоталамуса) и центр химической терморегуляции (задний отдел гипоталамуса). Кроме того, в процессах терморегуляции участвуют продолговатый мозг, ретикулярная формация, высшие отделы ЦНС и спинной мозг. В гипоталамусе- число клеток, реагирующих на повышение Т, преобладает над количеством клеток, реагирующих на ее понижение (20-30% и 2-3% соответственно).
В восприятии холодового раздражения участвуют, в основном, рецепторы кожи. Особую роль в терморегуляции играет сосудистый рецепторный аппарат. Доказано, что внутрисосудистое введение холодных растворов вызывает запаздывающую и менее выраженную защитную реакцию, чем охлаждение через кожные покровы (1). Циркулирующая кровь является распределителем тепла в организме за счет собственной теплоемкости и перераспределения кровотока от центра к переферии.
Компенсаторные и патологические реакции при гипотермии протекают в две стадии. 1-я стадия компенсации сопровождается сужением сосудов поверхностных тканей тела, учащением сердцебиения на 18-20% (тахикардия сочетается с увеличением периферического сопротивления сосудов, при этом систолическое АД увеличивается на 18-20%, а диастолическое на 33-35%), увеличением объема легочной вентиляции и активацией симпатадреналовой системы. В результате включаются механизмы химической терморегуляции, направленные на увеличение теплопродукции: появляется мышечная дрожь (71), усиливается обмен веществ, увеличивается распад гликогена в печени и мышцах, повышается содержание глюкозы в крови. В тканях происходит усиление окислительных процессов, в том числе за счет анаэробного окисления.
В условиях длительного охлаждения возможно перенапряжение и истощение механизмов терморегуляции, наступает вторая стадия - декомпенсации (снижение обменных процессов и потребления кислорода, угнетение жизненно важных функций).
В качестве основных причин развития непреднамеренной интраоперационной гипо-гермии можно выделить следующие:
1. Холодная окружающая среда. Установлено, что гипотермия развивается у всех пациентов при Т в операционной < 21° С. При такой температуре возникает пограничное юстояние между теплопродукцией и теплоотдачей. При Т 21-24° С у 67% сохраняется юрмотермия. При Т > 24° С все пациенты остаются нормотермичными, но такая Т дис-юмфортна для персонала и увеличивает риск гнойных осложнений. Максимальный темп ;нижение температуры тела в операционной наблюдается в течение первого часа опе->ации (51).
2. Вид анестезиологического пособия. Анестезиологические препараты блокиру-я естественные механизмы компенсации холодового воздействия. Миорелаксанты бло-ируют мышечный тонус и, соответственно, мышечную теплопродукцию. Нейролептики, англиоблокаторы, препараты с сосудорасширяющим действием блокируют вазоконст-1икцию. Большинство анестетиков и наркотических веществ обладает прямым термо-|локирующим действием на гипоталамус.
Нормальный уровень потребления кислорода бодрствующим человеком составляет 30 мл/мин/кв.м, что соответствует теплопродукции 1ккал/кг/ч или 70 ккал/ч у 70 кг че-овека. Этот показатель существенно ниже у адекватно анестезированного пациента, ри использовании энфлюрана происходит снижение потребления Оа до 85 мл/мин/кв.м
и теплопродукции до 0,6 ккал/кг/ч (на 40% от исходной), галотана и фентанила- от 90 до 100 мл/мин/кв.м в течение операционного периода. Теплопродукция при пропофол-фентанил-векурониевой анестезии снижается на 33% (от 70 до 47 ккал/ч у 70 кг пациента). Потеря 58"ккал тепла соответствует снижению Т на Г С (10,72, 76,77).
Непреднамеренная гипотермия развивается не только при общей, но и при регионарной анестезии (в том числе, проводниковой)(37,39,43). Это обусловлено фармакологической денервацией периферических сосудов, усилением теплоотдачи, действием холодных растворов местных анестетиков на термочувствительные рецепторы спинного мозга, а также увеличением темпа и объма инфузии. Во время регионарной анестезии ограничивается возможность периферической вазоконстрикции за счет симпатического блока и теплопродукции из-за мышечной релаксации. Активность терморегуляторных центров спинного мозга подавляется. Основными факторами, определяющими степень выраженности Г при спинальной и эпидуральной анестезии, являются уровень блока и возраст пациентов (29). Повышение спинального блока на один уровень приводит к снижению центральной Т на 0,15° С, с увеличением возраста на один год центральная Т снижается на 0,3° С.
Теплоотдача через респираторные пути составляет 10-15% от общей теплоотдачи. При ИВЛ воздух поступает в легкие, минуя естественные дыхательные пути (где должно было произойти его согревание, очищение и увлажнение). ИВЛ газами комнатной температуры объемной скоростью 8-10 л\мин уменьшает температурный баланс на 25 ккал/ч, или на 40% от общей теплопродукции (32, 33).
3.Применение холодных инфузионных растворов. Для согревания до нормальной Т тела 4,3 л кристаллоидного раствора, введенного внутривенно, требуется 70 ккал. Негативный температурный баланс составляет 1° С у бодрствующего и 1,5° С у анестезированного пациента (23,41,75). Это эквивалентно одному часу теплопродукции бодрствующего взрослого человека или 1,5 часовой теплопродукции пациента во время анестезии (теплопродукция снижается в среднем на 33%).
Потери тепла при внутривенном переливании растворов кристаллоидов, крови и кро-везамещающих сред можно представить следующим образом: на согревание 1л кристаллоидного раствора комнатной температуры до 37° С организм затрачивает 16 ккал. Во время анестезии инфузия 4-6 мл/кг/ч вызывает теплопотерю 4,5 - 7 ккал/ч у 70 кг пациента, что составляет 11-16% его теплопродукции. В результате инфузии 6-8 л растворов кристаллоидов при Т, равной 18-20° С, температура тела снижается на 2° С. Внутривенное введение холодной (4-8° С) донорской крови в объме 450 мл приводит к холо-довому стрессу, так как на ее согревание до 37° С организм расходует 16 ккал, при этом температура тела снижается на 0,25° С. Быстрая инфузия 5 л холодной крови может привести к остановке сердечной деятельности вследствие гипотермии (23). Холодную консервированную кровь ввиду повышенной вязкости трудно инфузировать. На первом этапе после вливания холодная кровь служит «плазмоэкспандером», так как до момента ее согревания до температуры тела нарушается способность эритроцитов отдавать кислород тканям. При этом сатурация остатся в пределах 100%, не отражая процессов тканевой гипоксии (67). При массивной кровопотере в шоковой ситуации в результате быстрой трансфузии может развиться необратимая гипотермия и гипотермическая коагулопа-тия, если внутрисосудистый объм жидкости поддерживать адекватным объмом донорской крови, не подогретой до температуры тела (56,57,58).
4. Использование холодных растворов для санации полостей тела при эндоскопических операциях (39,69), в урологии (17,18,19,54) (при операциях на мочевом пузыре) также приводит к развитию Г. .,i(
5. Характер оперативного вмешательства. Любая хирургическая процедура, которая сопровождается раскрытием плевральной, перикардиальной, брюшной полостей, сопровождается значительной потерей тепла с испарением (26). В ходе операции на со-
судах, выполняющихся чрезбрюшинным доступом, происходит незаметная потеря жидкости в объме до 500мл/ч. Хирургические манипуляции, предусматривающие полное пережатие сосуда (например, аорто-бедренное протезирование при синдроме Лериша), приводят к опосредованному снижению метаболической теплопродукции в ишемизирован-ной части тела и последующей дополнительной теплопотере за счет расширения сосудов после снятия турникета.
6. Некоторые сопутствующие заболевания могут предрасполагать к развитию непреднамеренной гипотермии. Нарушение целостности кожных покровов лишает организм эффекторного чувства и эфферентных ответных реакций. Пациенты с обширными ожогами и системными поражениями кожи относятся к группе высокого риска в отношении развития интраоперационной Г. В случаях моно- или полинейропатии (параплегия, уремическая, диабетическая нейропатия) риск потери тепла во время операции возрастает в связи с утратой способности к рефлекторной вазоконстрикции. Теплопродукция значительно нарушена при микседеме и надпочечниковой недостаточности. Интраопера-ционная Г может спровоцировать криз холодовой преципитации при серповидноклеточ-ной анемии, Г крайне неблагоприятна при болезни Рейно из-за наличия в крови холодо-вых агглютининов
7. Особую группу риска в отношении развития Г составляют пациенты с острой травмой, доставляемые в стационар по экстренной помощи (35,44, 46,75). Факторы, способствующие развитию Г:
Вид и степень тяжести травмы (особенно при травмах головы, ожоговых и тяжелой степени тяжести травмах), степень кровопотери, болевой шок, иммобилизация, длительное воздействие холодной окружающей среды, эмоциональный стресс, бактериальные токсины, инфузия холодных растворов, действие лекарственных средств (анестетиков, фенотиазинов, антипиретиков) (48).
Пожилой и ранний детский возраст, алкоголь, сопутствующие заболевания: (сердечно-сосудистая патология, заболевания щитовидной железы, гепато-ренальная патология, ожирение, дистрофия и др.)
Таблица!. Патофизиология гипотермии у пациентов,получивших острую __________травму_________________________________________________
Система
Патология
^ердечно-юсудистая
1егочная
Начальное повышение АД за счет выброса катехоламинов Последующее снижение АД и сердечного выброса
Повышение ЧСС с последующим снижением при охлаждении пациента <32° С
Увеличение нагрузки на миокард
Повышение ЦВД за счет периферической вазоконстрикции
ЭКГ-изменения: инверсия зубца Т, удлинение интервалов PR, QRS, QT, предсердная фибрилляция, появление зубца J
Увеличение ЧДД с последующим снижением при К 32° С Снижение вентиляторного ответа на гипоксию
Увеличение мертвого пространства и ухудшение вентиляционно-перфузионных соотношений
Повышение легочного сосудистого сопротивления Снижение эластичности легких Снижение кашлевого и рвотного рефлекса
Кровь
Метаболизм
Нервная
Желудочно-кишечная, мочеполовая
Метаболизм фармпрепаратов
Снижение числа лейкоцитов и тромбоцитов, секвестрация лейкоцитов и тромбоцитов в печени
Морфофункциональные изменения тромбоцитов Высвобождение тромбопластина Усиленный фибринолиз
Повышенная кровоточивость на фоне сниженной активности ферментов свертывающей системы
Снижение плазменной концентрации факторов свертывания за счет ин-фузионной терапии и переливания компонентов крови
'Гипергликемия за счет резистентности к инсулину Выброс катехоламинов
Начальное повышение метаболизма с последующим угнетением при глубокой гипотермии
Смещение кривой диссоциации оксигемоглобина влево, приводящее к клеточной гипоксии
Дыхательный и метаболический ацидоз
Спутанность сознания, тревога, психоз, кратковременная потеря памяти Замедленное восстановление сознания после наркоза
Парез кишечника
Панкреатит
Олигурия
Замедленный клиренс лактата в печени
Метаболический ацидоз за счет нарушения функции почечных буферных систем и экскреции органических кислот
Транслокация бактерий из кишечника в кровоток, что является фактором, предрасполагающим к развитию сепсиса
Увеличение периода полувыведения
Ослабленное действие препаратов на органы-мишени
Резистентность к катехоламинам
Изменение порога чувствительности к изменению температуры тела при травмах показаны Smith С (75) в эксперименте на животных. В контрольной группе рефлекторная мышечная дрожь появляется при Т гипоталамуса 34,8-36,4° С. После травмы порог чувствительности понижается и слабая дрожь появляется только при Т 31 ° С, что может быть связано с уменьшением гипоталамического кровотока под действием эндогенных веществ (например, эпинефрина), выделяемых в ответ на повреждение и снижающих авторегуляцию гипоталамуса. Болевая импульсация вызывает рефлекторный спазм перефе-рических сосудов, которого достаточно для поддержания нормальной центральной Т при травмах легкой и средней степени тяжести (изменяется только Т кожи). При тяжелых травмах снижается и центральная Т, однако дрожь не возникает (одна из причин частого сочетания тяжелых травм с Г средней и тяжелой степени, значительно повышающей количество неблагоприятных исходов и смертность (27)).
8. Возрастные особенности термогенеза. У лиц пожилого и старческого возраста компенсаторные механизмы выражены слабее, что связано с уменьшением мышечной массы, ограниченными резервами сердечно-сосудистой системы, снижением вазоконст-рикторных реакций, повышением соотношения между площадью поверхности и массой тела (59). Величина средней теплопродукции в возрасте 20-30 лет составляет 40 ккал\кв.м.\ч, старше 60 лет - 30 ккал\кв.м.\ч. Соответственно, у пациентов старше 60 лет существенно возрастает риск развития непреднамеренной интраоперационной гипотермии (53).
У детей более высокий уровень метаболизма по отношению к взрослым и больший коэффициент соотношения площади поверхности тела к массе, потому в условиях анестезии теплоотдача у детей выше и Г развивается быстрее (61,70).
Наиболее серьезные осложнения, связанные с Г, появляются в раннем послеоперационном периоде, когда заканчивается центральное действие анестетиков (66). Освобожденный центр теплорегуляции, оценив разницу между должной и имеющей место ин-тракраниальной температурой, активирует механизмы теплопродукции: выброс стресс-гормонов и появление мышечной дрожи. В результате потребность в кислороде возрастает в 3-8 раз (24), кривая диссоциации оксигемоглобина смещается влево, увеличивается артерио-венозная разница по Og.
Большинство осложнений является следствием самостоятельного согревания пациентов (47). Процесс достижения пациентом нормальной температуры в отсутствие активного согревания, длительный по времени, требует больших энергетических затрат, является дискомфортным для пациента и существенно осложняет работу медперсонала.
Интраоперационная Г пролонгирует выход из наркоза за счет потенцирования действия анестетиков, торможения метаболизма препаратов, гемодинамической нестабильности, угнетения интеллектуальных функций (19,53,79), осложняет послеоперационный уход (увеличивает продолжительность ИВЛ, частоту возникновения ишемии миокарда (27,28,67) и нарушений водно-электролитного и кислотно-основного баланса (32)), вызывает дискомфорт у пациентов.
Сердечно-сосудистая патология - основная причина смертности в периоперационном периоде (28,29,44). Тахикардия и увеличение сердечного выброса на фоне периферической вазоконстрикции приводят к гипертензии. Не случайно частота развития миокарди-альных осложнений в раннем послеоперационном периоде среди пациентов с Г в 2-3 раза выше, чем у нормотермичных пациентов (28).
Таблица 2. Влияние интраоперационной Г на ССС на примере больных, перенесших операции некардиологического профиля (Frank sm, 1993г)
|
Интраоперационные осложнения |
Гипотермия п -158 |
Нормотермия п -142 |
|
ЭКГ-изменения: |
15 (10%) |
13 (9%) |
|
Ишемия миокарда |
8 (6%) |
7 (6%) |
|
Желудочковая тахикардия |
7 (5%) |
6 (5%) |
|
Послеоперационные осложнения |
33 (16%) |
11(8%) |
|
ЭКГ-изменения: |
23(16%) |
9 (7%) |
|
Ишемия миокарда |
12(9%) |
6 (5%) |
|
Желудочковая тахикардия |
11 (8%) |
3 (2%) |
|
Патологические исходы: |
10(6%) |
2(1%) |
|
Нестабильная стенокардия |
7 (4%) |
2(1%) |
|
Остановка сердца |
2(1%) |
0 |
|
Инфаркт миокарда |
1 (0,75%) |
0 |
Под прикрытием анестезии Г может быть благоприятной в операционном периоде из-за снижения метаболических потребностей и защиты жизненных органов от ишемическо-го повреждения. В раннем послеоперационном периоде, когда активируются метаболический и адренергический механизмы защиты от холодового стресса, сердечнососудистая система становится наиболее уязвимой (17,9).
«Гипотермичное сердце» менее чувствительно к действию атропина, катехоламинов и электростимуляции. Кардиоваскулярный эффект Г способствует увеличению количества осложнений и повышению смертности у гипотермичных пациентов (75). Снижение метаболических функций отдельных органов и организма в целом, угнетение левожелудочко-вой сократимости (негативный инотропный эффект) встречаются даже при Г средней степени тяжести. Г может провоцировать развитие предсердной и желудочковой аритмии (10,30,87).
Таблица 3 . Частота развития миокардиальной ишемии при Г в зависимости от возраста пациентов и типа анестезиологического пособия (Frank sm, 1997г).
|
|
Гипотермия (<35° С) |
Нормотермия (>35° С) |
|
Возраст: |
|
|
|
Старше 65 лет |
42% |
18% |
|
65 лет и младше |
22% |
10% |
|
Тип анестезии: |
|
|
|
Эпидуралыная |
40% |
14% |
|
Общая |
35% |
13% |
На ЭКГ первичным изменением, связанным с Г, является синусовая тахикардия. Организм пытается обеспечить повышенные метаболические потребности в кислороде за счет увеличения ЧСС, ЧДД, АД. Если возможности ССС ограничены или компенсаторная теплопродукция не покрывает интенсивность холодового воздействия, происходит постепенное истощение защитных механизмов, замедление метаболических процессов, угнетение функций всех органов, усиление спазма периферических сосудов (28).
ЭКГ-признаком этой стадии является прогрессирующая брадикардия. Максимальная манифестация Г - снижение проводимости миокарда (увеличение интервалов PR, QT и расширение комплекса QRS). Отчасти, причиной этого процесса является Г-индуцированная гипокалемия — следствие угнетения активности натрий-калиевой-АТФ-азы (75). Снижение активности натрий-калиевых и кальциевых каналов мембран кардио-миоцитов приводит к нарушению возбудимости, проводимости, сократимости и автоматизма миокарда. Внеклеточная гипокалемия может быть причиной аритмии, сердечной и дыхательной недостаточности. Гипокалемия полностью проходит после согревания пациента (76). Дальнейшее прогрессирование Г приводит к появлению на ЭКГ J-волн и волн фибрилляции предсердий. У пациентов со сниженными резервами миокарда эти изменения могут проявляться на ранних стадиях развития Г.
Вопреки распространенному мнению, ишемические осложнения не имеют прямой связи с явлением мышечной дрожи. Г вызывает изменение резистентности сосудов, усиление интенсивности обмена веществ и метаболических потребностей, что провоцирует развитие ишемических изменений. Очевидно, что этот показатель зависит от продолжительности Г.
Таблица 4. Зависимость частоты развития ишемии миокарда в первые сутки после операции от продолжительности Г (Frank SM, 1997г).
|
|
0-6 часов |
6-12часов |
12-18 часов |
18-24часа |
|
Гипотермия, % (=33) |
15% (5) |
18% (6) |
15% (5) |
21% (7) |
|
Нормотермия,% (=67) |
7% (5) |
6% (4). |
3% (2) |
6% (6) |
На этапе согревания в раннем послеоперационном периоде применение внешних способов согревания ведет к расширению периферических сосудов в местах воздействия тела и перераспределению крови от центра к периферии. В результате, снижается АД, развивается «синдром обкрадывания» (ишемия внутренних органов), крайним проявлением которого является.«rewarming shock»-шок согревания (32, 33, 67).
Дополнительными факторами риска развития миокардиальных осложнений являются: возраст >60 лет, гипотония во время операции, продолжительность операции и гипотермии, кардиологический анамнез (85).'
У пожилых пациентов интраоперационная и послеоперационная Г сочетается с повышенным уровнем катехоламинов в плазме (31, 32). Уровень кортизола и адреналина в крови существенно различается у гипотермичных и нормотермичных пациентов. С понижением температуры тела снижается продукция инсулина и нарастает гипергликемия (утилизация глюкозы тканями уменьшается в связи с угнетением активности ферментных систем под действием Г (75)).
Угнетение метаболических процессов и функций внутренних органов изменяет активность и элиминацию большинства анестезиологических препаратов.
Например, продолжительность действия верокурония увеличивается более чем в два раза при снижении центральной температуры на 2° С, продолжительность действия ат-ракриума увеличивается на 60% при редукции центральной температуры на 3° С.(73).
Г-индуцированное снижение активности ферментативных систем печени увеличивает период выведения лекарств, клиренс которых связан с печеночным метаболизмом (33,44,75). При Г повышается тканевая растворимость ингаляционных анестетиков, что пролонгирует выход из анестезии (72). Одновременно усиливается токсическое действие одних лекарственных средств (например, кардиотоксический эффект бупивакаина (76)), и уменьшается эффективность других (менее выраженный инотропный эффект допами-на, адреналина, норадреналина (24,27)).
Уменьшение почечного кровотока и гломерулярной фильтрации при Г сопровождается снижением ренального клиренса водорастворимых лекарственных средств (пролонгируется действие миорелаксантов и др.). Угнетение реабсорбции воды и электролитов в почечных канальцах ведет к потере жидкости и электролитному дисбалансу (22, 23).
Таким образом, Г вызывает в организме ряд изменений, каждое из которых может спровоцировать ишемические изменения миокарда. Пациенты со скомпроментирован-ным миокардом должны находиться под особым контролем в плане поддержания нормо-термии. Johns Hopkins: «Простой и дешевый путь к значительному снижению риска осложнений со стороны ССС - лидирующей причины послеоперационной смертности -поддержание нормальной температуры тела пациента во время операции» (3).
Гипотермическая коагулопатия - одно из наиболее опасных последствий Г, проявляющееся увеличением интра- и послеоперационной кровопотери. Системная Г нарушает тромбоцитарный и сосудистый звенья гемостаза (23). Активность тромбоцитов имеет линейную зависимость от понижения температуры и восстанавливается при согревании пациента. Этот эффект может ввести в заблуждение медперсонал, так как все коагуля-ционные тесты выполняются при Т 37° С, не отражая реального состояния свертывающей системы крови гипотермичного пациента. Кроме того, большинство факторов свертывания являются эстеразными ферментами и могут нормально функционировать в узких температурных рамках, соответствующих нормотермии. Напротив, активность ферментов
![]()
лизиса усиливается при Г, что проявляется активацией фибринолитического каскада, усилением фибринолиза и повышенной кровоточивостью (22,31,33) Все это происходит на фоне снижения плазменной концентрации факторов свертывания за счет восполнения ОЦК инфузионными средами. Согласно данным Ferrara А. у 85% умерших травматологических пациентов Г сочеталась с тяжелой коагулопатией, неконтролируемым кровотечением и необратимым шоком, развившимся несмотря на восполнение кровопотери адекватным объемом крови, плазмы и тромбоцитарной массы. Кроме того, гипотермичным пациентам для стабилизации гемодинамики необходим больший объем инфузии по сравнению с нормотермичными больными с той же патологией (23).
Г существенно снижает резистентность организма к инфицированию (45,75): экспериментально вызванная Г способствует развитию септических осложнений. При легкой Г происходит угнетение хемотаксиса лейкоцитов и фагоцитов, что способствует развитию бактериальной флоры. Уменьшение тканевого кровотока и тканевой оксигенации также способствует снижению резистентности к инфекции и тормозит заживление ран. Возможно, комбинация Г и травмы изменяет активность медиаторов-цитолейкинов, таких как интерлейкин и фактор некроза опухоли, что повышает заболеваемость и смертность от раневых инфекций и септического синдрома. Например, снижение центральной Т на 2° С утраивает частоту развития раневых инфекций после проктологических операций (45).
Mahjney (49) провел мета-анализ экономических затрат при лечении хирургических больных и сравнил число неблагоприятных исходов у пациентов, перенесших Г, с нормо-термичной группой. Выявилось достоверное различие частоты послеоперационных осложнений между нормо- и гипотермическими группами. В частности, уже при умеренной Г возрастали потребность в проведении гемотрансфузий и риск инфицирования ран .
По данным Gentilello et al. частота смертельных исходов у гипотермичных пациентов значительно выше, чем у нормотермичных при одинаковой степени тяжести травм (32,33,35). У прооперированных пациентов общехирургического профиля, поступивших в ПИТ, Г продолжительностью >2 часов сочетается со смертельным исходом в 24% случаев (4% у нормотермичных пациентов)(67). На исход заболевания оказывают негативное влияние продолжительность (экспозиция) и степень выраженности Г. Количество смертельных исходов, при равенстве остальных факторов риска, составляет 40% при 4 ч и 80% при 8 ч продолжительности Г (75). В сочетании с травмой, Г легкой и средний степени тяжести вызывает смертельный исход у 40-60% взрослых больных, тяжелая Г- у 100% (75,76). Slotman (74) считает продолжительную Г основной причиной смертельного исхода у пациентов в критическом состоянии.
Таким образом, исследования последних лет убедительно доказали, что интраопера-ционная Г, являясь причиной развития серьезных послеоперационных осложнений, существенно продлевает послеоперационный восстановительный период и сроки пребывания в стационаре (45), увеличивая стоимость лечения. Именно поэтому большое внимание уделяется изучению способов предупреждения и коррекции Г.
Для успешного ведения пациентов с высоким риском развития непреднамеренной ин-траоперационной Г необходим мониторинг температуры тела (15,16). Наиболее достоверные данные получаются при одновременном измерении центральной и периферической (кожной) температуры. Центральная Т может определяться прямым способом, например, в легочной артерии при помощи катетера Сван Ганца, или закрытым методом, с помощью термодатчиков в пищеводе, носовых ходах, на тимпанической мембране среднего уха, в прямой кишке или мочевом пузыре. Значение Т кожи в значительной степени зависит от температуры окружающей среды и не является точным показателем температурного статуса пациента. Кроме того, Т поверхности кожи значительно варьирует в различных точках тела (температура (Т) в ротовой полости > Т в подмышечной впадине> Т на поверхности тела), поэтому в отсутствие должного мониторинга ее измеряют в нескольких точках и ориентируются на средний показатель.
' При использовании наружных способов согревания восстановление нормального уровня температуры на поверхности тела происходит значительно раньше, чем температуры ядра. Завершение согревающих мероприятий на этой стадии (ориентируясь на показатель Т кожи) ведет к неполной коррекции и рецидиву Г(10,70).
Таблица 4. Механизмы и • величина теплопотери во время операции ( Smith СЕ, 1996г)
|
Механизм теплоотдачи |
Величина теплопотери |
|
Радиация (инфракрасное излучение) |
50 ккал\ч для раскрытого пациента ЮккалХч для укрытого |
|
Перераспределение тепла |
при общей анестезии: 46ккал/ч в течение первого часа 17ккал/ч в последующие 2 ч |
|
Согревание внутривенно перелитых ифу-зионных растворов |
46 ккал/ч в первый час анестезии 17 ккал/ч в последующие 2 ч |
|
Испарение |
Кожа и респират. система: 12-16 ккал/ч Открытые полости тела и брюшина: до 400 ккал/ч |
Для предупреждения Г основное внимание должно быть направлено на блокирование механизмов ее развития (65). Методы предупреждения и коррекции Г можно разделить на внешние и внутренние, активные и пассивные.
Пассивные методы направлены на предупреждение теплопотери с излучением и включают в себя:
1. Поддержание постоянной температуры в операционной и ПИТ не ниже 21° С.
2. Оптимальный вентиляционный режим, упраздняющий ламинарные потоки воздуха.
3. Укрывание пациента одеялами или термоотражающими металлопластическими пленками (космические одеяла (6) рекомендуется использовать при длительных операциях, укрывая более 60% поверхности тела).
Активные методы:
1 .Использование инфракрасного излучения (24,32) для согревания применяется давно, особенно в неонатологических отделениях ИТ и в предоперационном этапе в детской хирургии. Противопоказания: ожоговая травма, системные заболевания кожи.
Недостатки этого метода:
- пациент должен быть раскрытым во время процедуры, что не корректно в условиях ПИТ.
- действию излучения подвергается поверхность, на которую направлен источник излучения, в результате эффект согревания является неравномерным.
- согревающий эффект не намного превышает теплопотерю во время процедуры.
- возможно появление ожогов на облучаемой поверхности
2. Электро- или водяные матрасы с подогревом (74,75) применимы в условиях операционной и в ОРИТ и до недавнего времени считались «золотым стандартом» согревания пациентов.
Использование ограничено в случаях повышенного риска гипоперфузии тканей (в том числе, при длительных операциях, когда в местах контакта поверхности тела с поверхностью стола возникают участки гипоперфузии тканей под действием силы тяжести тела пациента и возрастает вероятность возникновения тепловых некрозов) из-за высокого риска образования ожогов. Поскольку с теплой поверхностью контактирует всего 15% поверхности тела лежащего навзничь пациента, изолированное применение данного метода не обеспечивает предотвращения интраоперационной Г.
3. Согревающие устройства конвекционного типа предназначены для предупреждения и лечения гипотермии и уменьшения дискомфорта хирургических пациентов во время операции и в послеоперационном периоде.
Комнатный воздух пропускается через согревающее устройство и доставляется через шланг в «одеяло», размещенное на пациенте. Одеяла могут быть изготовлены из нетканого материала или бумаги и предназначены для одного пациента.
Над укрытой поверхностью тела создается эффект воздушной подушки с заданной температурой. Теплый воздух контактирует с большей площадью поверхности тела, имеет постоянную температуру и более равномерный согревающий эффект. Отсутствие контакта кожи с нагретой поверхностью предупреждает образование ожогов (38).
Использование этих приборов в предоперационном и операционном периоде уменьшает риск развития Г и частоту возникновения дрожи в послеоперационном периоде, в том числе при региональной анестезии. Применение этого метода ограничено в случаях выраженной вазоконстрикции и централизации кровообращения (шок, массивная крово-потеря и т.д.) из-за возможности развития шока согревания.
Согревающие устройства конвекционного типа, как правило, снабжены бактериальными фильтрами, очищающими воздух, подаваемый к телу пациента. Исследование, проведенное Kurz (45), демонстрирует уменьшения числа случаев развития хирургического инфицирования на фоне применения согревателей конвекционного типа.
Сочетание конвенционного согревания с инфузией теплых растворов признано наиболее эффективной методикой предупреждения интраоперационной Г (14, 36).
4. Традиционная аппликация контейнеров с теплой водой на поверхность тела пациента в проекции крупных сосудов (подмышечные впадины, паховая область) нерезультативна и опасна. Отсутствие согревающего эффекта объясняется малой площадью соприкосновения контейнера с телом пациента и относительно высокой скоростью кровотока. Локального нагревания тканей в месте аппликации не хватает для согревания потока крови, но вполне достаточно для получения термической травмы (73). Американское общество анестезиологов на основании анализа закрытых судебных исков пришло к выводу, что подобное применение емкостей с теплой водой для согревания пациентов является одной из ведущих причин интраоперационого ожогового поражения пациентов.
5. Согревание и увлажнение инспирируемых газов. Потеря тепла через респираторный тракт составляет 10 -15% общей теплопотери. Согревание и увлажнение газонаркотической смеси позволяет сохранить 10 ккал/ч, а у пациентов в состоянии Г повысить центральную температуру на 0,5-0,6° С/ч (78).
Традиционно для этих целей применяют согревающие увлажнители типа водяной бани. Они насыщают газ парами воды и одновременно согревают его. Однако их использование связано с повышением риска инфицирования пациентов, так как резервуар увлажнителя является благоприятной средой для бактериальной колонизации. Среди неблагоприятных эффектов чрезмерного увлажнения при применении устройств данного типа можно выделить снижение активности сурфактанта, нарушение мукоцилиарного транспорта, механические повреждения легких, гипергидратацию. Применение согревающих увлажнителей позволяет повысить температуру инспирируемого газа до 32° С, однако сложность контроля уровня увлажнения в клинических условиях, а также описанные осложнения в сочетании со сложностью стерилизации и дороговизной оборудования по-
служили причиной поиска альтернативных устройств с гарантированными параметрами действия. К таковым сегодня относят тепловлагообменники и фильтры-тепловлагообменники.
Тепловлагообменники (в литературе встречается термин «искусственный нос») -альтернативный метод кондиционирования вдыхаемого воздуха, основанный на сохранении и возвращении основной (большей) части тепла и влажности выдыхаемого воздуха. Одноразовое устройство размещается между эндотрахеальной трубкой и дыхательным контуром. Пар из выдыхаемого пациентом воздуха конденсируется на мембране с выделением тепла. При вдохе поток газа увлажняется и согревается за счет задержанной жидкости. Весь процесс ограничивается эндотрахеальной трубкой, что позволяет исключить дорогостоящие увлажнители из дыхательного контура и избежать его инфицирования.
Фильтры-тепловлагообменники - новое поколение фильтрующих устройств, сочетающее качества бактерио-вирусного фильтра и тепловлагообменника. Современные ФТВО являются альтернативой согревающим увлажнителям, в частности, в отношении минимизации риска легочной инфекции (88).
Технические характеристики ФТВО являются важным фактором при выборе фильтрующих устройств для ИВЛ в каждом конкретном случае. Более перспективным в настоящее время считается использование в дыхательных контурах бактериально-вирусных фильтров-термовентов (БВФТ). При вентиляции неувлажненными газами теп-лопотеря организма увеличивается на 42,3 кДж/ч (5). Дыхательные фильтры позволяют сэкономить 41,6 кДж/ч, что эквивалентно 0,2° С/ч. Не обладая способностью активно согревать пациентов, фильтры-термовенты эффективно снижают теплоотдачу за счет согревания и увлажнения вдыхаемого воздуха.
Даже единственный фильтр, установленный между дыхательным контуром и эндотрахеальной трубкой, позволяет избежать перекрестного заражения пациента, дает возможность отказаться от стерилизации внутренних поверхностей дыхательных контуров и аппаратуры. Применение фильтров-термовентов снижает частоту развития послеоперационных пневмоний с 16 до 6%. Таким образом, финансовые расходы на приобретение дыхательных фильтров окупаются за счет снижения показателей заболеваемости пациентов, эффективности при длительной ИВЛ, отсутствия потребности в дорогих увлажнителях и создании сложных стерильных условий, сокращения объема работы среднего медицинского персонала (89).
Противопоказания к применению пассивных увлажнителей-фильтров: наличие густой или кровяной мокроты, ранний детский возраст (фильтр увеличивает объем мертвого пространства), искусственная гипотермия, проведение аэрозольной терапии, состояния, когда объем выдоха составляет менее 70% объема вдоха.
6. Использование пищеводных терморегулируемых трубок в качестве метода профилактики и лечения Г рекомендован в ряде стран (1). По пластиковой двухпросвет-ной трубке, проведенной в пищевод, циркулирует согретая до 38-42° С вода. Kristensen G (1) приводит данные об использовании этого метода во время обширных абдоминальных операций (среднее время 3,5ч): в экспериментальной группе к концу операции центральная температура тела составляла в среднем 36,8° С, в контрольной группе -34,9° С. Автор не дает данных о развившихся осложнениях, однако, можно предположить развитие травм и ожогов пищевода при длительной экспозиции согревающей трубки.
7. Согревание в\в вводимых растворов существенно сокращает теплопотерю во время операции (7). По данным Gentillello LM., каждый литр раствора с Т, равной 42° С, обеспечивает гипотермичному пациенту (центральная Т 32° С) 10 ккал теплоты и повышает Т тела на 0,17° С (28,32).
В случаях, когда необходим большой объем инфузии, согревание растворов является одним из основных методов профилактики Г (наружное согревание кожных покровов ве-
дет к снятию периферического сосудистого спазма и перераспределению кровотока от внутренних органов к переферии, что ведет к критической ишемии центральных органов и гемодинамической нестабильности)(23). Smith (75) подчеркивает необходимость использования какого-либо устройства для согревания растворов при массивной трансфузии у пожилых пациентов.
Большинство исследователей подтверждает существенное снижение количества Г-ассоциированных осложнений при применении в операционном периоде теплых инфузи-онных растворов в различных областях хирургии: в гинекологии (79), при трансуретральной резекции аденомы простаты (2,9,19), при транскутанной нефролитотомии (63) и других малых и больших вмешательствах (26). Т согретого раствора должна быть не более 42° С. Превышение этого порога ведет к нарушению резистентное™ и гемолизу эритроцитов.
По принципу действия согревающие устройства можно разделить следующим образом (81,41):
-трубка или контейнер с раствором находятся в контакте с теплообразующей поверхностью и согреваются сухим теплом (Fenwal, DW-1000, FloTemlle)
-трубка с раствором помещена в водную баню (Hematokinetitherm)
-теплообменник представлен трехпросветной трубкой, в центральном канале которой проходит инфузируемый раствор, а два других канала муфтой охватывают первый и содержат воду с Т 42° С, движущуюся из нагревателя в противотоке к центральному каналу (Level 1- 250, 500, 1000 , Hotline).
Большинство исследователей (11,25,32,34), сравнивая эффективность согревающих устройств, отмечают преимущества приборов Level 1 (объемная скорость согретого раствора 6-400 мл/мин - Н 1000, Level 1; 1-60 мл/мин — Hotline, Level 1;).
Hotline обеспечивает согреваемому раствору Т 39-41° С при скорости инфузии до 3 л/ч. Трехпросветная трубка-теплообменник длиной 2 м может соединяться непосредственно с венозным доступом (в\в катетером, канюлей) переходником типа Luer. В результате согретый раствор сохраняет заданную температуру (нет потери тепла на этапе от согревателя к пациенту). Кроме того, температура теплоносителя не может быть выше 42° С. Соответственно, инфузионная среда никогда не перегревается выше данного предела, что имеет огромное значение для сохранения целостности препаратов крови.
Использование этих приборов с Т на выходе >37° С, по данным Smith (77), позволяет избежать «холодового» стресса и дает возможность более эффективного согревания ги-потермичных пациентов, особенно в сочетании с устройствами конвекционного типа и лаважем полостей тела теплыми растворами. Подкупает также удобство применения, малая инвазивность и возможность применения при больших и малых хирургических вмешательствах, особенно в сосудистой и микрохирургии, где ограничено применение наружных согревающих методов, а развитие Г (и, как следствие, дрожь и спазм периферических сосудов в послеоперационном периоде) снижает шансы на успешный исход оперативного вмешательства (34).
Активные центральные (внутренние) способы согревания применяются в случаях тяжелой Г, а также при Г средней степени тяжести у пациентов с сердечнососудистой нестабильностью и/или в критическом состоянии. Активное внутреннее согревание восстанавливает нормотермию быстрее, чем поверхностные методы, способствует нормализации сердечного ритма и сердечного выброса и снижает риск развития шока согревания. Эффективность метода повышается при повторении инфузии.
1. Лаваж полостей тела теплыми ирригационными растворами уменьшает степень Г при эндоскопических (42), урологических (18,19,39) операциях. Теплоемкость воды -1 ккал/кг/град. С. Один литр воды, остывая от 42 до 37° С, освобождает 5 ккал теплоты, повышая Т тела на 0,08° С/л. о
Перитонеальный, медиастиналыный и плевральный лаваж теплыми растворами кристаллоидов объемной скоростью 6 л/мин повышает центральную Т на 2-3° С/ч (77). Противопоказанием являются абдоминальные и торакальные травмы, пневмоторакс, гемото-ракс(67).
Желудочный и толстокишечный лаваж также эффективен, к его недостаткам относятся трудоемкость и значительная продолжительность по времени, он противопоказан при абдоминальных травмах и при перфоративных поражениях ЖКТ.
2. Искусственное кровообращение. (Cardiopulmonary bypass) применяется в критических для жизни пациента ситуациях (тяжелая гипотермия в дооперационном периоде в сочетании с тяжелой политравмой, кардиопатологней, остановкой сердечной деятельности) и является наиболее быстрым и эффективным способом согревания (повышение центральной температуры на 10-12° С\ч). Метод требует канюляции крупных сосудов, системной гепаринизиции (возрастает риск кровотечений в послеоперационном периоде), значительных затрат времени на установку, наличия специально обученного персонала и является весьма дорогим ( 12,22,33,75).
3. Длительное артерио-венозное согревание (Continuous arteriovenous rewarming [CAVR)). Преимущество этого метода заключается в быстрой постановке системы и бо-iee простом уходе (не требуется специализированная бригада трансфузиологов). Воз-ложно повторное применение при возвратной Г. Отсутствует необходимость в гепарини-1ации. Значительно уменьшается ишемизация внутренних органов и потребность в рансфузии компонентов крови, сокращается восстановительный период и пребывание i PO и ПИТ (22,32,67).
Катетеризированные специально подготовленными катетерами 8,5 Fr бедренные со-уды (артерия и вена) соединяются прибором Level 1 (Sims Level 1 Technologies). Функ-ионирование шунта регулируется врачом чередованием открытого и закрытого положе-ий артериального и венозного кранов: через артериальную ветвь наполняется инфузор, эрез 3 мин согретая кровь возвращается пациенту через венозный катетер. При АД вы-е 80 мм рт. ст. поток через шунт составляет 225 -375 мл/мин. Постоянная температура эинфузируемой крови 39° С, что обеспечивает повышение центральной Т на 1,3-2,2° С.
Не рекомендуется использовать CAVR, если:
- у пациента имеется окклюзия бедренной артерии, т. к. катетер дополнительно юньшает просвет сосуда, провоцируя ишемию конечности.
- вес пациента меньше 41 кг (катетер может закрыть просвет сосуда) АД ниже 80 мм.рт.ст.
Возможные осложнения (67):
1. Образование гематомы на месте катетеризации сосудов - как правило, не требует )ургического вмешательства.
2. Ишемия конечности.
3. Развитие аритмии в начале согревания (по данным Schulman GS, аритмические из-1ения были связаны с тяжелой Г, а не с CAVR).
Гребования к контролю состояния пациентов: мониторинг температуры (термодилю-'нный катетер Сван Ганс) и АД, пульсоксиметрия, контроль пульсации сосудов на пах, коагулограмма. Катетер не удаляют до тех пор, пока не будет достигнута ста-ьная нормотермия в течение двух часов и не разрешится коагулопатия.
'уществует несколько модификаций согревания через шунт. Возможной альтернати-является вено-венозный шунт при наличии кровяной помпы.
Таблица 5. Директива по использованию CAVR медицинского центра . Harborview
|
Показания Противопоказания |
Центральная Т ниже 35° С Систолическое давление ниже 80 мм рт ст Вес менее 41 кг Окклюзия бедренной или других артерий Ишемия стоп, вызванная другими синдромами |
|
Доступ |
Бедренная артерия - привилегированный доступ Бедренная вена - привилегированный доступ, яремная вена, подключичная вена. |
|
Предположительное время действия |
Среднее время согревания 45 мин Максимальное время -3 часа |
|
Особенности ухода |
Предупреждение дополнительной теплоотдачи Контроль гемодинамики каждые 15 мин Контроль дистального пульса каждые 30-60 мин Контроль витальных функций и центральной Т каждые 15 мин |
|
Окончание |
Центральная Т -36-37° С |
|
Удаление катетеров |
Центральная Т -36-37° С в течение двух часов Достижение нормокоагуляции |
Эффективность CAVR подтверждена рядом авторов. По данным Gentilello (33), восстановление в послеоперационном периоде происходит более успешно у пациентов, перенесших CAVR , чем в группе, где применялись стандартные методики (контрольная группа). У 43% пациентов контрольной группы (7% при CAVR) не была достигнута нормо-термия и реанимационные мероприятия не имели успеха. Кроме того, в контрольной группе шестикратно выше время пребывания в ПИТ и значительно больший (в среднем, в два раза) объем инфузионной поддержки необходим для стабилизации гемодинамики (33). Учитывая, что частота неблагоприятных исходов связана с продолжительностью Г, быстрое восстановление нормотермии при CAVR значительно уменьшает число послеоперационных осложнений и смертность пациентов в критическом состоянии и пациентов с тяжелыми травмами.
Медикаментозное лечение непреднамеренной интраоперационной гипотермии. Если в операционной не удалось купировать Г, согревание пациента необходимо продолжить в условиях ПИТ с одновременной коррекцией Г-связанных осложнений. Наиболее частым осложнением является дрожь. Купировать ее можно препаратами, обладающими термоблокирующим эффектом (меперидина гидрохлорид (демерол), хлорпро-мазина гидрохлорид (торазин), морфин и т.д.). Однако, почти все эти средства обладают потенциирующим действием по отношению к анестезиологическим препаратам, пролонгируя пробуждение пациента. Для предупреждения осложнений дрожи, связанных с повышением потребности в кислороде, McLaren рекомендует назначение оксигенотерапии в послеоперационном периоде, Rodriuez рекомендует продление нейромышечного блока до окончания периода согревания (74). Отсутствие четких рекомендаций по медикаментозному купированию Г еще раз подтверждает, что более эффективным является предупреждение Г, чем последующее устранение осложнений.
Литература.
1. Радушкевич В.Л., Барташевич Б.И., Караваев Ю.Н. Непреднамеренная интраоперационная гипотермия. // Анест. и реаниматол. -1997. -N.4, - С. 79-83.
2. Allen, Terry. Body Temperature Changes during Prostatic resection as related to the Temperature of the Irrigating Solution. //The Journal of Urology. -1973. -110:433-435.
3. Atkin, L. Loss of Body Heat Following Surgical Intervention. //Nursing Times. - Nov. 1998. - 94(44).
4. Balagna, R., eta/. Accidental Hypothermia in a Child. //Paediatric Anaesthesia. -1999. -9. - 342-344.
5. Bernthal EM. Inadvertent hypothermia prevention: the anaesthetic nurses' role. // BrJNurs. -1999. - Jan 14-27. -8(1): 17-25.
6. Bourke, DL, et a/. Intraoperative heat conservation using a reflective blanket. //Anaesthesiology. -1984. - 60:151-154.
7. Browne, DA, DeBoeck R, Morgan M. An evaluation of the Level 1 blood warmer series. //Anaesthesia. -1990. - 45:960-3.
8. Camus Y, Delva E, Cohen S, Lienhart A. The effects of warming intravenous fluids on intraoperative hypothermia and , postoperative shivering during prolonged abdominal surgery. // Acta Anaesthesiol Scand. -1996. -Aug.- 40(7): 779-82.
9. Carpenter, A. A/den. Hypothermia during transurethral resection of prostate. //Urology. -1984. - 23(2): 122-124.
10. Cheney, Frederick. Should Normothermia be maintained during Major Surgery. //JAMA. -1997. - 277(14): 1165-1166.
11. Courreges, P. et a/. Evaluation of the HOTLINE© Fluid Warmer with children under 10 kg. //Annals ofFr. Anesth. Reanim. -13 (1994). - 904-7.
12. Deakin, CD. Changes in core temperature compartment size on induction of general anesthesia. // British Journal of Anaesthesia. - Dec.-1998:861-864.
13. Defina, J; Lincoln, J. Prevalence of Inadvertent hypothermia during the perioperative period: a quality assurance and performance improvement study. //Journal of Per/Anesthesia. -1998. -13(4): 229-235.
14. Desai, R, Smith, CE, et a/. Convective warming with and without fluids warming: A randomized prospective study. // Metrohealth Research Exposition. -1996. - Aug. - Attachment 6.5.
15. EI-Gamal N, EI-Kassabany N, Frank SM. Age-related thermoregulatory differences in a warm operating room environment (approximately 26degrees C). //Anesth Analg. - 2000. - Mar.- 90 (3): 694-8.
16. Ellis, JE; Busse JR, et al. Postoperative management ofMyocardial Ischemia. //Anes Clin No Amer. -1991. -9:609.
17. Evans, JW, Hugh, et al. Cardiovascular performance and core temperature during transurethral prostatectomy. // The Journal of Urology. -1994. - Dec-152:2025-2029.
18. Evans, JW, Hugh, et al. Haemodynamic and cardiological responses to TURP, standard vs. Isothermic techniques. // Presented to the British Sosiety ofUrological Surgeons. - June 1991.
19. Evans, JW, Hugh, et al. Prevent cardiac stress during TURP; keep the patients warm. // The Journal of Urology. -1993 May.
20. Fanelli G, Berti M, Casati A. Perioperative thermal homeostasis. A duty of the anesthesiologist. // Minerva Anestesiol. -1997 Jun. - 63(6): 193-204.
21. Faries, Glenn, et al. Temperature relationship to distance and Flow Rate of Warmed IV fluids. //Annals of Internal Medicine. - 20. 11(1991). -1198-1200.
22. Feroe, DO; Augustine, AD. Hypothermia in PACU. Pain and Post Anesthesia management. // Critical Care Nursing Ckinics of Nors America. -1991. - Mar; 3(1): 135-44.
23. Ferrara, A, MacArthur JD, et al. Hypothermia and acidosis worsen coagulopathy in the patient requiring massive transfusion. //Am J of surgery. -1990. -Nov. -160:515-18.
24. Flacke JW, Flacke WE. Inadvertent Hypothermia: Frequent, insidious, and often serious. //Seminars in Anesthesia. -1983. -2(3): 183-96.
25. Flancbaum L, Trooskin SZ, et al. Evaluation of Blood-Warming devices with the apparent thermal clearance. //Annals of Emergency Medicine. -1989. - Apr; 18(4): 355-9.
26. Flores-Maldonado A, Guzman-Llanez Y, Castaneda-Zarate S. Risk factors for mild intraoperative hypothermia. // Arch Med Res. -1997. - Winter. 28(4): 587-90.
27. Frank SM, EI-Rahmany HK, Cattaneo CG, Barnes RA. Predictors of hypothermia during spinal anesthesia. // Anesthesiology 2000. - May; 92 (5): 1330-4.
28. Frank SM, et al. Perioperative maintenance of Normothermia reduces the incidence of Morbid Cardiac Events. // JAMA. -277.14(1997). -1127-34.
29. Frank SM; Deattie C; et al. Unintentional hypothermia is associeated with postoperative Myocardial Ischemia. // Anesthesiology. -1993. - 78:468-76.
30. Frank SM, et al. Hypothermia is independent predictor of postoperative Myocardial Ischemia. // Anesthesiology. - 1992. -Sep; 77: No За.
31. Gentilello LM. Advances in the management of hypothermia. // Surg Clin North Am. -1995. - Apr; 75 (2): 243-56.
32. Gentilello LM, et al. Continuous Arteriovenous Rewarming. //Journal of Trauma. -1990. - 30. 12 -1436-49.
33. Gentilello LM, et al. Continuous Arteriovenous Rewarming: rapid reversal of hypothermia in critically ill patients. //Journal of Trauma. -1992. - March. - 32(3): 316-27.
34. Gentilello LM. Level 1 infusion system, USA Experience. // Minerva Anesthesiologica. -1998. - vol. 64, Suppl. -1 al N. 9:293-296.
35. Gentilello LM, et al. Treatment of hypothermia in Trauma Victims: Thermodynamic considerations. //Journal of Intensive Care Medicine. -1995. - vol. 10. No. 1,
36. Giesbrecht, G., et al. Comparison of Forced-air patients warming systems for perioperative Use. //Anesthesiology. -1994. -80:671-679.
37. Glosten,B., et al. Preanesthetic skin-surface warming reduces redistribution hypothermia caused by Epidural Block. //Anesth. Analg. - 1993. - 77: 488-93.
38. Hazard Report: Misusing Forced-air hypothermia units can burn patients. // Health Devices. -1999. - May-June. - 28(5-6): 229-230.
39. Heathcte, PS, Dyer, PM. The effect of warm irrigation on blood loss during transurethral prostatectomy under Spinal Anesthesia.//British Journal of Urology. -1986. - 58:669-671.
40. Heier, T, Caldwell, JE, Sessler, DI, Miller, R. Mild intraoperative hypothermia increases duration of act/on and spontaneous recovery of vercuronium blockade during Nitrous Oxide-Isoflurane Anesthesia in humans. // Anesthesiology. - 74 (1991). -815-19.
41. Henker, Richard, et a/. Evaluation of Four methods of warming intravenous fluids. // Journal of Emerency Nursing. - 21.5 (1995). - 385-90.
42. Hurd, W, eta/. Laparoscopic irrigation using a prewarmed pressurized system.//Journal of Laparoscopic Surgery. -1993. -3(6): 573-575.
43. Hynson, JM, eta/. Thermal balance and tremor patters during Epidural Anesthesia. //Anesthesiology. -1991. - 74:680-690.
44. Jurkovich, G, Greiser, W, et a/. Hypothermia in Trauma victims: an ominous predictor of survival. // Journal of Trauma. -
1987. -Sept. 27(9): 1019-24.
45. Kurz, A, Sessler, D, et a/. Perioperative Normothermia to reduce the incidence of surgical wound infection and shorten hospitalization. // The New England Journal of Medicine. -1996. - May. - 334(19): 1209-1215.
46. Lee, J, Mintz, PD, et a/. A method for estimating the delivery temperature of intravenous fluids. // Anesth. Analg. -1994. -79:155-59m.
47. Lenhardt R, Marker E, Go// V. Mild intraoperative hypothermia prolongs postanesthetic recovery. // Anesthesiology. -1997.
- Dec. - 87(6): 1318-23.
48. Luna, G, Maier R, et al. Incidence and effect of Hypothermia in seriously injured patients. //Journal of Trauma. - 1987. -Sept. - 27(9): 1014-19.
49. Mahoney CB, Odom J. Maintaining intraoperative normothermia: a meta-analysis of outcomes with costs. //AANA J. -1999.
- Apr; 67 (2): 155-63.
50. Math/as, Judith. What's the best method for warming patients?//OR Manager. -1998. - March: 10-12.
51. Mircea N, Angelescu N, Jianu £ Intra-anesthetic hypothermia. // Rev Chir Oncol Radio! О R L Oftalmol Stomatol Chir. -1989. - Nov-Dec. -38(6): 473-80.
52. Morray, Jeffrey P, et al. Oxygen delivery and consumption during Hypothermia and rewarming in the dog. //Anesthesiology.
- 72.5 (1990) 510-16.
53. Morrison, Robert C. Hypothermia in the Elderly. //International Anesthesiology Clinics. - 26.2 (1988). -124-33.
54. Ogura, Keiji, et al. The effect of warm irrigating fluid during and after transurethral prostatectomy. // Clinical Therapeutics. -
1988. -10, Special Issue.
55. Pate/ /V, Smith CE, Pinchak AC, Hagen JF. Prospective, randomized comparison of the Flotem lie and Hotline fluid warmers in anesthetized adults. //J Clin Anesth. -1996. - Jun; 8 (4): 307-16.
56. Pate/ N, Knapke D, et al. Heating capabilities of HOTLINE and Flo Tern He warmers in anaesthetized patients. // Canadian Journal of Anesthesia. -1995. - 42(5): A28 B.
57. Pate/ N, et al. Simulated clinical evaluation of conventional and newer fluid warming devices. // Anesthesia and Analgesia. -82(1996). - 517-524.
58. Pate/ N, Smith CE, et al. Clinical comparison of blood warmer performance at maximum flow rates. // Canadian Journal of Anesthesia. -1994. - 41:A36.
59. Pate/ N, Smith CE, et al. Heat conservation vs conwective warming in adults undergoing elective surgery. //Canadian Journal of Anesthesia. -1997. - 44(6): 669-673.
60. Presson, RG Jr., Haselby KA, Bezruckzko AP, et al. Evaluation of a new fluid warming effective at low to moderate flow rates. //Anesthesiology. -1993 May; 78(5): 974-80
61. Presson, RG Jr., Haselby KA, Bezruckzko AP, et al. Evaluation of a new High- Efficiency blood warmer for children. // Anesthesiology. -1990. -Jul. - 7(1): 17-6.
62. Reed, RL, et al. The disparity between Hypothermia coagulopathy and clotting studies. //Journal of Trauma. - 33(1992). -465-70.
63. Roberts, Steven, et al. Hypothermia associated with percutaneous nephrolithotomy. // Urology. -1994. - 44(6): 832-835.
64. Rodriquez, JL, Weissman C, et al. Physiologic requirements during rewarming: suppression of the shivering response. //Critical Care Medicine. -1983. -11(7): 490-97.
65. Rosenburg H, Frank, SN. New and controversial issues in per/operative termoregulation. // As presented on Dec 15. -1998.
66. Rosenberg J, Sessler D. Mild intraoperative hypothermia. Another risk factor for postoperative complications. // Ugeskr Laeger. -1999. - May 17. -161(20): 2935-8.
67. Schulmaan, C, Pierce, B. Continuous Arteriovenous Rewarming: a bedside technique. // Critical Care Nurse. -1999. - Dec. -19(6) 54-63.
68. Schultz, J, et al. Methods for warming intravenous fluids in small volumes. // Canadian Journal of Anesthesia. -1998. - Nov.
- 45(11): 1110-5.
69. Seitzzinger, M., Dudgeeeon, L Decreasing the degree of Hypothermia during prolonged laparoscopic procedures. //Journal of Reproductive Medicine. -1993. - 38(7): 511-513.
70. Sessler, DI, et al. Optimal duraation and temperature ofprewarming. //Anesthesiology. -1995. - 82: 674-681.
71. Sessler, DI, PonteJ. Shivering during Epidural Anesthesia. //Anesthesiology. -1991. - 74: 680-90.
72. Sessler DL Complication and Treatment of Mild Hypotermia.//Anesthesio/ogy.-2001.- V95:531-543.
73. Simon, MAM. The prevention of intraoperative Hypothermia. // Medisch Spectrum Twente: 3-5.
74. Slotman, GJ, Jed EH, Burchard, KW. Adverse effects of Hypothermia in postoperative patients. // The American Journal of Surgery. -1985. - Apr;(149): 495-501.
75. Smith, CE; Pate/, N. Etiology, prevention and treatment of Hypothermia in the trauma patient. // ITACCS Monograph. -11995. - May.
76. Smith, CE; Pate/, N. Hypothermia in adult trauma patients: Anesthetic considerations, Part 1: Etiology and Pathophisiology. //American Journal of Anesthesiology. -Jan/Feb. -(1997)283-90.
77. Smith, CE; Pate/, N. Hypothermia in adult trauma patients: Anesthetic considerations, Part 2: Prevention and Treatment. // American Journal of Anesthesiology. - Jan/Feb (1997) 283-90.
78. Smith, CE, et al. The failure of negative pressure rewarming (Thermostat TM) to accelerate recovery from mild Hypothermia in postoperative surgical patients. //Anesthesia and Analgesia. -1999. - 89:1541-5.
79. Smith, CE, et al. Warming intravenous fluids reduces perioperative hypothermia in women undergoing ambulatory gynecological surgery. //Anesthesia and Analgesia. -1998. - Jul; 87(1): 37-41.
80. Tollofsrud SG, Gundersen Y, Andersen R. Per/operative hypothermia. //Acta Anaesthesiol Scand. -1984. - Oct; 28 (5): 511-S.
81. Uhl, L, Pacini DG, Kruskall MS. A comparative study of blood warmer performans. //Anesthesiology. - 77 (1992). -1022-8.
82. Uhl, L, Pacini DG, Kruskall MS. The effect of Heat on in Vitro parameters of red cell integrity. //Transfusion. -1993. - Sept. Abstracts Issue.
83. Valeri, CR, Feingold H, et al. Hypothermia-induced reversible platelet dysfunction. //Ann. Surg. -1987. - Feb; 205 (2): 175-81.
84. Valeri, CR, Mac Gregor H, et al. Effect of temperature on bleeding time and clotting time in normal male and female volunteers. // Critical Care Medicine. -1995. - Apr; 23(4): 698-704.
85. Vaughan MS, Vaughan R W, Cork RC. Postoperative hypothermia in adults: relationship of age, anesthesia, and shivering to rewarming. //Anesth Analg. -1981. - Oct. 60 (10): 746-51.
86. Vincens, JJ, Mandak JS, McClellan JF. Ventricular fibrillation after massive blood transfusion. // Choices in Cardiology. -1993. - 7:336-8.
87. Wachter, A. Warmed surgical patients reported to have fewer Cardiac complications. //Anesthesiology News. -1997.
88. Wilkes AR, Benbough JE, Speight SE, Harmer M. The bacterial and viral filtration performance of breathing system filters.//Anaesthesia 2000 May;55(5):458-65.
89. Wilkes AR, Benbough JE, et al. Ability of breathing system filters to prevent liquid contamination of breathing systems.// British Jomal of Anaesthesia. -1998. -80:550p
СОВРЕМЕННАЯ КОНЦЕПЦИЯ ОРГАНИЗАЦИИ ЭКСПРЕСС ДИАГНОСТИКИ НЕОТЛОЖНЫХ СОСТОЯНИЙ
Торшин В. А. , к.м.н., специалист компании «Радиометр»
Организация экспресс диагностики неотложных состояний эволюционировала с развитием новых направлений в клинической практике: кардиохирургии, нейрохирургии, трансплантологии органов, а также с развитием новых методов лечения полиорганной недостаточности, сепсиса и других критических состояний.
Подходы в экспресс диагностике также изменились в силу совершенствования следующих характеристик экспресс анализаторов, в первую очередь, анализаторов КЩС и газов крови [1]:
• портативность
• простота обслуживания
• программное обеспечение/информационные технологии
• малый объем пробы крови
• получение результата измерения в течение 1-2 минут после введения пробы.
Современная концепция экспресс диагностики неотложных состояний основана на таком понятии как РОСТ (Point-of-Care-Testing), то есть на анализе «непосредственно у постели больного» [1]. В интенсивной практике концепция РОСТ подразумевает инсталляцию и работу анализаторов КЩС, газов крови, электролитов, метаболитов (глюкозы, лактата) непосредственно в операционной, отделении реанимации, отделении гемодиализа и т.д. Таким образом, создается парк анализаторов, работающих не традиционно в лаборатории под надзором опытного лабораторного персонала, а в интенсивных клинических отделениях в руках специалистов, ориентированных на решение клинических задач.
Таблица 1. Сравнительная характеристика работы анализаторов в ла-боратории и в режиме РОСТ
|
Тестирование в лаборатории |
Тестирование в режиме РОСТ |
|
Небольшое число анализаторов |
Большое количество портативных анализаторов |
|
Ограниченное число операторов |
Большое число операторов |
|
Персонал, обученный работе в лабораторной практике |
Персонал, ориентированный на решение клинических проблем |
Новый режим работы анализаторов в практике РОСТ стало возможным осуществить с необходимым условием сохранения качества проводимых измерений только с применением информационных технологий. Это означает, что современный анализатор РОСТ должен иметь серийный порт для включения его в лабораторную или больничную сети LIS/HIS, поддерживая стандартные протоколы ASTM/HL7 [2]. Наибольшими коммуникативными возможностями обладают анализаторы газов крови ABL700 серии датской компании «Радиометр» с программным обеспечением на базе Windows 95, поддерживающим TCP/IP протокол с возможностью включения в сеть Internet [2].
Современные информационные технологии в составе анализаторов позволяют:
• создавать и обрабатывать обширную базу данных
• быстро, в режиме on-line, передавать обработанную информацию лечащему врачу (с включением анализаторов в LIS/HIS системы)
• проводить дистанционное обслуживание анализаторов (экономия рабочего времени персонала)
• автоматизировать процесс контроля качества [3].
Подтверждению качества выдаваемых анализатором результатов придается огромное значение, особенно в такой области, как анализ КЩС и газов крови - показателей, непо-
средственно влияющих на результат лечения больного. Учитывая особенности работы анализаторов в режиме РОСТ и недостаточность обучения персонала интенсивных отделений работе с лабораторными приборами, идеальным решением проблемы контроля качества представляется создание системы автоматического контроля качества, встроенного непосредственно в анализатор [3].
Вышеуказанным условиям отвечает система AutoCheck, разработанная для анализаторов ABL700 серии (компания «Радиометр», Дания). Немаловажным в разработке данной системы является то, что раствор контроля качества проходит тот же самый путь, что и проба крови во время измерения.
Благодаря техническим разработкам ряд параметров, получаемых ранее только в режиме работы плановой лаборатории, в настоящее время становится частью показателей РОСТ. Уровень лактата в крови, получаемый на современных газоанализаторах из одной пробы крови наряду с такими традиционными показателями как рН, рО2, рСО2 и др. стал необходимой составной экспресс диагностики в целом ряде областей (лечение полиорганной недостаточности, кардиохирургия и др.). Фракция фетального гемоглобина (FHbF) и концентрация общего билирубина (cBil), измеряемые на современных анализаторах газов крови, становятся составной частью экспресс диагностики в такой области, как не-онатология.
Несмотря на ряд спорных моментов, по мнению одного из признанных в мире экспертов по экспресс диагностике доктора James H. Nichols, РОСТ создает следующий ряд потенциальных преимуществ [1]:
• сокращение времени получения результата
• сокращение времени постановки диагноза
• сокращение времени до начала лечения
• уменьшение времени госпитализации
• снижение стоимости лечения
• снижение ятрогенной крОвопотери (педиатрия, неонатология).
Литература:
1. J.H. Nichols Management of point-of-care testing. Blood Gas News. 1999; vol. 8; 2, pp 4-15.
2. K. £ Blick Information Management for Point-Of-Care/ Critical Care Testing. Blood Gas News. 2000; vol. 9; 1, pp 4-13.
3. J.O. Westgard IT for Automating the QC Process. Blood Gas News. 2000; vol.9; 1, pp 13-18.
ПРИМЕНЕНИЕ БЛОКАТОРА Н2-РЕЦЕПТОРОВ ГИСТАМИНА ФАМОТИДИНА (КВАМАТЕЛА) В СХЕМЕ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ С ИСКУССТВЕННЫМ
КРОВООБРАЩЕНИЕМ
Н. А. Трекова, А. Г. Яворовский, М. М. Шмырин, В. В. Гришин
Осложнения со стороны желудочно-кишечного тракта (ЖКТ) при кардиохирургических вмешательствах с применением искусственного кровообращения (ИК) составляют, по данным разных авторов, 0,8 - 3%, но отличаются высокой летальностью, достигающей 17-63% [9-13]
Наиболее часто встречающиеся осложнения - эрозии слизистой ЖКТ, острые стрес-сорные язвы, желудочно-кишечные кровотечения [11]. Причинами этих осложнений при операциях с ИК являются стресс и ишемия вследствие неадекватной перфузии или змболизации мезентериальных сосудов. Эти факторы увеличивают продукцию адрено-кортикотропного гормона, кортикостероидов, катехоламинов, гистамина, которые в свою очередь повышают активность кислотно-пептического фактора, вызывают сдвиг реакции гастродуоденального содержимого в кислую сторону и снижают защитные свойства слизистой оболочки [6, 7, 14]. Помимо указанных осложнений, сдвиг рН в кислую сторону и избыточная секреция желудочного сока могут быть причиной рвоты, регургитации и ас-пирационной пневмонии [16, 18, 19].
ь В этой связи профилактика повышения секреции желудочного сока и уменьшение
сдвига его рН в кислую сторону до и во время кардиохирургических операций с ИК могут являться патогенетическим фактором, снижающим частоту вышеуказанных осложнений.
Среди лекарственных препаратов, уменьшающих секрецию соляной кислоты, центральное место занимают блокаторы гистаминовых рецепторов [2, 3, 5]. Одним из таких препаратов является синтезированный фирмой "Гедеон-Рихтер" (Венгрия) Н2-блокатор 3-го поколения квамател (фамотидин).
Лишенный в значительной степени недостатков, свойственных его предшественникам, этот препарат нашел широкое применение в гастроэнтерологической практике [1, 4]. В нашей стране практически нет опыта периоперационного применения кваматела для профилактики осложнений со стороны ЖКТ после кардиохирургических операций с ИК.
Целью настоящего исследования являлось определение эффективности и целесообразности периоперационного (до, во время и после операции) использования блокатора гистаминовых Н2-рецепторов кваматела для профилактики осложнений со стороны ЖКТ у кардиохирургических больных.
Задачи исследования включали: а) определение эффективности кваматела в предоперационной подготовке кардиохирургических больных с патологией ЖКТ; б) изучение эффективности кваматела в профилактике и лечении повышенной желудочной секреции и сдвига рН содержимого желудка в кислую сторону в периоперационном периоде; в) определение роли кваматела в профилактике послеоперационных осложнений; г) изучение влияния кваматела на центральную гемодинамику.
Материал и методы. Обшие данные об исследованных больных приведены в табл. 1. Квамател был применен у 68 кардиохирургических больных, страдавших ИБС и перенесших операции аортокоронарного шунтирования (АКШ), в 3 аспектах:
а) до операции - у 28 больных с патологией ЖКТ в дозе 20 мг 2 раза в день в течение 7-19 дней;
б) в премедикации - у 30 пациентов по 20 мг на ночь и утром per os. Контрольную группу составили пациенты с аналогичной премедикацией (промедол, диазепам, атропин), но без включения кваматела;
в) интраоперационно внутривенно - в дозе 20 мг для нормализации рН желудочного содержимого и изучения гемодинамики.
Определение патологии со стороны ЖКТ и эффективности применения кваматела для лечения проводили на основании клинических исследований и гастродуоденоскопии.
Рис. 1. Профиль рН желудочного содержимого у больных 1-й и 2-й групп во время операции
Для определения периоперацион-
ного рН - профиля желудочного содержимого проводили рН-мониторинг. Для этого был использован ацидогастрометр "Гастроскан-5" ("Исток-Система" Россия) и 3-канальные зонды-электроды, которые устанавливали в теле желудка (ТЖ) и его антральном отделе (АО). Перед установкой зонды тестировали на стандартных рН-растворах. Зондирование желудка проводили сразу после вводной анестезии и интубации трахеи и определяли рН ТЖ и АО (исход), а также количество желудочного содержимого. В дальнейшем рН измеряли на стабильном этапе после вводной анестезии, перед ИК, во время ИК перед началом согревания, во время гемостаза после окончания ИК и в конце операции. Объем выделившегося желудочного сока определяли после вводной анестезии, в конце операции и через 6 - 8 ч после операции.
Таблица 1 Клиническая характеристика кардиохирургичаских больных
|
Клиническая характеристика |
1-я групла (п = 35) (с квамателом) |
2-я группа (л - 33) (без кваматела) |
|
Возраст, годы |
63 ±4 |
61+6 |
|
Основной диагноз |
ИБС |
ИБС |
|
Вид операции |
АКШ |
АКШ |
|
Без патологии ЖКТ |
21 |
19 |
|
Эрозивный гастрит |
10 |
11 |
|
Язвенная болезнь желудка |
2 |
2 |
|
Язвенная болезнь двенадца- |
|
|
|
типерстной кишки |
2 |
1 |
|
Уровень гипотермии, ' С |
28-30 |
28-30 |
|
Время ИК, мин |
79 ±7 |
78 ±9 |
При регистрации рН желудочного содержимого ниже 4,5 больным вводили 20 мг кваматела и определяли время ответа.
Центральную гемодинамику: ЧСС, АД, ЦВД, ДЛА, СВ, СИ, ОПС исследовали с помощью мониторно-компьютерной системы МХ-04 и катетера Свана - Ганса после введения 20 мг кваматела внутривенно.
В раннем послеоперационном периоде оценивали частоту возникновения осложнений со стороны ЖКТ (тошнота, рвота, эрозии, язвы, панкреатит и т. д.).

Результаты исследований и их обсуждение. В настоящее время значительно
Рис. 2. Динамика рН желудочного содержимого после внутривенного введения кваматела (20 мг) во время операции
увеличилось количество кардиохирургических больных с сопутствующими заболеваниями ЖКТ. Этому способствует длительное применение ряда лекарственных средств (в частности, больные ИБС постоянно принимают аспирин, больные с ревматическими пороками - нестероидные противовоспалительные средства). По данным нашего клинического „д.* анализа, из 68 кардиохирургических больных, включенных в настоящее исследование, у 28 выявлена патология со стороны ЖКТ (44%), подтвержденная эндоскопически (см. табл. 1), требующая проведения терапии в предоперационном периоде. Как известно, в настоящее время основной тактикой лечения как язвенной болезни, так и кислотозави-симых заболеваний является ингибирование продукции соляной кислоты и уменьшение желудочной секреции. В связи с этим пациентам с патологией ЖКТ в схему комплексной терапии был включен квамател в принятых дозах. Из табл. 2 видно, что в результате проведенного лечения ликвидация явлений воспалительного процесса и исчезновение эрозий по данным контрольной эндоскопии были достигнуты у всех больных к 7 - 9-му дню после начала лечения. Из 9 пациентов с язвенной болезнью желудка у 8 улучшение наступило к 14 - 16-му дню, 1 пациент с язвенной болезнью был выписан домой для долечивания. Таким образом, 27 пациентов из 28 с язвенной патологией ЖКТ были подготовлены к операции АКШ и успешно оперированы. Более того, на фоне продолженной терапии квамателом ни у одного из этих пациентов в послеоперационном периоде не выявлено клинически значимых осложнений со стороны ЖКТ. Ни у одного из пациентов, принимавших квамател в терапевтических дозах, не было отмечено побочных эффектов препарата.
Приступая к анализу влияния кваматела, включенного в премедикацию, на секрецию желудочного содержимого и его рН, следует подчеркнуть, что, согласно сравнительным клиническим данным, больные основной и контрольной групп оказались идентичными (см. табл. 1).
Анализ данных рН-мониторинга желудочного содержимого в 1-й (с квамателом в пре-медикации) и 2-й группе показал (рис. 1), что по исходным средним значениям рН больные двух групп между собой не различались.
Однако сравнение индивидуального рН по группам больных показало некоторое различие между ними. Уже в стабильном периоде у 7 из 30 больных контрольной группы значения рН желудочного сока составляли 4,5 - 2,5, в то время как в основной группе лишь у 1 больного рН желудочного сока был 4,4. Следует подчеркнуть, что резко кислая реакция желудочного содержимого, достигающая 2,5 и меньше, имела место только в контрольной группе и отмечена у больных с патологией ЖКТ в анамнезе, что позволяет
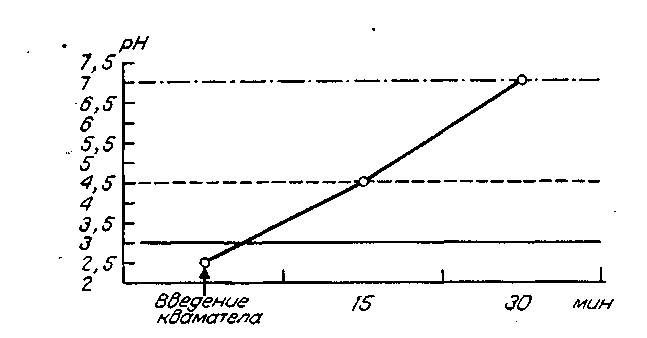
обоснованно рекомендовать применение кваматела у этой категории больных. Более того, у больных 1-й группы (с квамателом) в течение всей операции величина рН желудочного сока оставалась исключительно стабильной и имела нейтральное значение. У больных 2-й группы на этапе начала согревания во время'ИК было отмечено резкое отклонение значения рН в кислую сторону, которое достигало 4,1 ± 0,2 и достоверно отличалось от рН больных 1-й группы в этот период (р <0,05). На следующих этапах (после ИК) значения рН желудочного сока у больных 2-й группы были в зоне нейтральных величин, поскольку в случае резкого отклонения рН в кислую сторону таким больным внутривенно вводили квамател.
Таблица 2
Эффективность кваматела в лечении заболеваний ЖКТ до операции
|
|
|
Длительность |
|
Осложнения со |
|
Диагноз по данным |
Число |
лечения квама- |
Результаты |
стороны ЖКТ в |
|
эндоскопии |
больных |
телом, дни |
|
послеоперацион- |
|
|
|
|
|
ном периоде |
|
Эрозивный гастрит |
20 |
7-9 |
Все больные |
Нет |
|
Язвенная болезнь |
: • '-. |
|
оперированы |
|
|
двенадцатиперст- |
|
|
7 больных опе- |
|
|
ной кишки |
|
|
рировано, 1 вы- |
|
|
|
8 |
14-16 |
писан для доле- |
|
|
|
|
|
чивания |
|
Включение кваматела в премедикацию показало также существенную разницу в количестве желудочного содержимого (табл. 3) на всех изучаемых этапах. Из 30 больных контрольной группы после премедикации у 9 объем желудочного содержимого превышал 25 мл, в группе с квамателом таких больных было только двое. Как видно из таблицы, значительное (в 4 - 5 раз) уменьшение количества желудочного содержимого с высоким рН на всех исследуемых этапах у пациентов 1 -и группы в сравнении с контрольной доказывает высокую эффективность кваматела для уменьшения желудочной секреции.
Наконец, значительный научный и практический интерес представляют полученные данные о влиянии внутривенного введения кваматела на рН желудочного содержимого во время операции больным с резким сдвигом рН в кислую сторону. На рис. 2 представлена динамика рН желудочного содержимого, которая свидетельствует о том, что в течение 29 + 5 мин после внутривенного введения происходит нормализация рН.
Таблица 3 ,
Влияние кваматела иа количество желудочного содержимого у кардиохирурги-
ческих больных 1 -и и 2-й групп в периоперационном периоде (М ± т)
|
Группа |
Количество желудочного содержимого в исходе, мл |
Количество желудочного содержимого за время операции, мл |
Количество желудочного содержимого в послеоперационном периоде, мл |
|
1 -я группа (с квамателом в премедикации) 2-я группа (премедикация без кваматела) |
20 ± 11 75 ±10* |
85 ± 10 270 ± 15* |
70 ± 15 410 ±20* |
* р <0,05 при сравнении с основной группой.
Наши данные подтверждают результаты аналогичных исследований других авторов о том, что время ответа рН на введение кваматела составляет в среднем около 30 мин и
колеблется от 14 до 81 мин (6). Авторы также подчеркивают, что при внутривенном введении квамател вызывает более быстрое и выраженное торможение желудочной секреции. Это свойство кваматела позволяет рекомендовать его в премедикацию во всех случаях экстренных вмешательств для профилактики регургитации и связанных с ней осложнений. С этой целью квамател успешно был использован у 4 пациентов при экстренных анестезиях по поводу кровотечения, возникшего у кардиохирургических больных после операции. Безусловно, это стало возможным благодаря ампульной форме выпуска кваматела.
Как известно, при оценке любого нового препарата необходимо учитывать его побочные действия и влияние на сердечно-сосудистую систему, что особенно важно у больных с компрометированным кровообращением. Мы не выявили никаких изменений центральной гемодинамики (МОС, ОПС, ЯСС и др.) и изменений АД, ЧСС на введение 20 мг кваматела. На рис. 3 представлен фрагмент автоматизированной анестезиологической карты больного М., иллюстрирующий отсутствие изменений показателей гемодинамики на введение кваматела.
Наши данные совпадают с результатами, полученными В. С. Голочевской [1), также не отмечавшей отрицательного влияния кваматела на гемодинамику у больных ИБС и ревматическими пороками сердца. Полученные результаты выгодно отличают квамател от других блокаторов Н2-рецепторов гистамина, которые оказывают хороший терапевтический эффект, но могут вызывать побочные реакции со стороны ЦНС и др. [1, 20).
Таким образом, проведенное исследование показало высокую эффективность и хорошую переносимость кваматела при подготовке к операции кардиохирургических больных с сопутствующей патологией ЖКТ. Оно подтвердило, что квамател стимулирует пролиферативные процессы слизистой желудка. Применение кваматела в премедикации, особенно у пациентов с патологией ЖКТ в анамнезе, позволяет стабилизировать рН желудочного сока и уменьшить гиперсекрецию желудка в течение всего интраоперационного и раннего послеоперационного периода, что способствует профилактике осложнений со стороны ЖКТ. Блокаторы На-рецепторов гистамина не только дают мощный антисекреторный эффект, но и оказывают цитопротективное действие [4, 8]. У обследованных больных, получавших квамател до и во время операции, мы не встретили клинически значимых нарушений со стороны ЖКТ в послеоперационном периоде. Кроме того, возможность внутривенного введения кваматела до анестезии повышает возможности анестезиолога в предупреждении и уменьшении опасности возникновения рвоты и регургитации при экстренных вмешательствах. Возможность парентерального введения важна также при кровотечениях из ЖКТ, когда прием препарата затруднен или невозможен.

Рис. 3. Влияние кваматела на центральную гемодинамику. Фрагмент анестезиологической карты.
Полученные результаты свидетельствуют о целесообразности включения кваматела в
выводы
1. При кардиохирургических вмешательствах в условиях искусственного кровообра-шения наблюдаются значительный сдвиг рН желудочного содержимого в кислую сторону и желудочная гиперсекреция.
2. Внутривенное введение кваматела кардиохирургическим больным с резким снижением рН желудочного содержимого эффективно обеспечивает нормализацию рН желудочного содержимого.
3. Применение кваматела в премедикации позволяет достичь стабилизации рН желудочного содержимого и в 3 - 4 раза снизить его объем в течение периоперационного периода при операциях на сердце в условиях искусственного кровообращения.
Литература
1. Голочевская В. С. //Клин. мед. -1996. -№!.- С. 45-47
2. Григорьев П. Я. Диагностика и лечение болезней органов пищеварения. - СПб., 1997.
3. Комаров Ф. И. //Руководство по гастроэнтерологии. - М., 1995. - Т.1. - С. 514 - 515.
4. Мягкова Л. П., Гребнев А. X, Кхоршед А. М. //Клин. мед. -1991 -№3-С. 27-34.
5. Ногаллер А. М., Бутов М. А., Луняков А. С. // Там же. -1996 - № 9. - С. 55 - 58.
6. Шептулин А. А., Охлобыстин А. В. // Там же. -1998. - № 8. - С. 38 - 40.
7. Arancha J., Rikleman J., Riffani R. eta/. //Ann. Surg. -1984. - Vol. 50. - P. 301.
8. Geis G., Stead H., Wallemarh C. eta/. //J. Reumato/. -1999. - Vol. 18, Suppl. 28. -P. 11-14.
9. Hanhis 1, Curtis S., Hanhis B. eta/. //Surgery. -1982. - Vol. 92. - P. 394 - 397.
10. Huddy S., Joyce W., Pepper J. //'Br. J. Surg. -1991. - Vol. 78. - P. 293 - 296.
11. Kaplan J. Cardiac Anesthesia. -New York, 1993.
12. Krasna.M., Flanchbaum L, Trooshin Z. //Surgery. -1988. - Vol. 104. - P. 733 - 737.
13. Leitman 1, Paul D., Barie P. eta/. //Surg. Gynecol. Obstet -1987. - Vol. 165. - P. 251 - 253.
14. Malinak K., Vakil A. // Anesth. Analg. -1979. - Vol. 58. - P. 309 - 313.
15. Marone G., Stellate C., Mastronarchi P. // Anasth. Intensive. Notfallmed. Schmerzther. -1998. - Bd 3, Suppl. 33. - S. 314.
16. Mendelson C. L. // Am. J. Obstet. Gynecol. -1946. Vol. 53. - P. 196 - 205.
17. Ring J, // Anasth. Intensive. Notfallmed. Schmerzther. 1998. - Bd 3, Suppl. 33. - S. 314.
18. Roberts R. В., Shirley M A. //Anesth. and Analg. -1974. - Vol. 53. - P. 859 - 868.
19. Teabeaut 3.R.//Am. J. Pathol. -1952. - Vol. 28. -P. 51-62.
20. Vincon G., Badit C., Cousigou P. eta/. //Eur. J. Clin. Pharmacol. -1992. - Vol. 43. - P. 559 - 562.
протокол анестезиологического обеспечения для профилактики осложнений со стороны ЖКТ у кардиохирургических больных, оперируемых с ИК.
Высокая терапевтическая эффективность кваматела и его хорошая переносимость позволяют рекомендовать его не только кардиохирургическим больным, но и другим категориям хирургических пациентов для профилактики стрессорных язв и других осложнений со стороны ЖКТ. Эта профилактика особенно показана больным с сопутствующими заболеваниями ЖКТ или больным, имевшим их в анамнезе.
Можно подчеркнуть, что этим не исчерпываются положительные факторы использования кваматела. Известно, что в настоящее время блокада гистаминовых hi- и И2-рецепторов находит применение в профилактике и лечении анафилактических реакций [15, 17]. Появление Н2-блокатора, имеющего ампульную форму, без какого-либо негативного воздействия на гемодинамику открывает перспективы использования его и в этом аспекте.
НЕИНВАЗИВНАЯ ИВЛ В ОТДЕЛЕНИЯХ ИНТЕНСИВНОЙ ТЕРАПИИ
Дж. Конти, М. Антонелли, С. Арзано (Рим, Италия)
Введение
Проводимая через интубационную трубку механическая вентиляция легких является общепринятой и спасающей жизни методикой, к которой обращаются при неэффективности консервативных мер, включающих кислородотерапию и медикаментозное воздействие. Однако, интубация трахеи влияет на защитные механизмы дыхательных путей по отношению к инфекции, повышая риск возникновения таких осложнений, как пневмония и синуситы.
Наряду с этим, интубация, сама по себе являясь инвазивной процедурой, может быть сопряжена с рядом осложнений, вызывать ухудшение состояния находящихся в критическом состоянии пациентов и служить прямой причиной смертельного исхода. Могут быть необходимы седация или анестезия, которые являются источником дополнительных нежелательных явлений. Например, интубация трахеи может оказывать повреждающее воздействие на слизистую оболочку дыхательных путей, приводя к ее изъязвлению, воспалению или отеку, возникновению подслизистых кровоизлияний, что, в конечном счете, может привести к таким жизнеопасным состояниям как стеноз дыхательных путей (1, 2).
Неинвазивная вентиляция легких (НИВ) через носовую или простую лицевую маску представляется методом выбора, поскольку позволяет снизить частоту осложнений и повреждений, связанных с интубацией трахеи, а, кроме того, более легко переносится пациентом.
* Данная методика ИВЛ может быть методом ранней терапии обострений заболеваний дыхательной системы, при этом ее применение не сопровождается нарушениями речи и глотания и механизмов естественной защиты дыхательных путей
Применение НИВ у пациентов с обострениями ХОБЛ
Главным патогенетическим механизмов развития дыхательной недостаточности у пациентов с ХОБЛ является динамическая гиперинфляция, возникающая на фоне повышенного сопротивления дыхательных путей, когда выдох не успевает полностью произойти до начала последующего вдоха.
Динамическая гиперинфляция изменяет форму диафрагмы, снижает силу ее сокращений и вызывает постепенное снижение резерва выносливости дыхательных мышц. Вскоре незначительное увеличение сопротивления потоку вдыхаемого газа (за счет повышения секреции в дыхательных путях или бронхоспазма) или рост вентиляторного запроса (на фоне лихорадки или инфекционного процесса) может привести к истощению дыхательной мускулатуры. При этом дыхание учащается и становится поверхностным, возникает дыхательная недостаточность, гиперкапния и респираторный ацидоз. Работа дыхания продолжает нарастать, чтобы преодолеть пороговую нагрузку вдоха, представленную внутренним ПДКВ (auto-PEEP), а также достичь увеличения дыхательного объема, необходимость чего диктуется выраженным ростом сопротивления дыхательных путей.
Ранее лечение обострений ХОБЛ ограничивалось применением лекарственных препаратов (бронходилятаторы, стероиды, антибиотики и инотропы) и низкопоточной кислоро-дотерапией. При неэффективности консервативной терапии выполнялись интубация трахеи и переход на ИВЛ.
НИВ позволяет преодолеть причины, ведущие к нарастанию работы дыхания: сочетание ПДКВ и ИВЛ или вспомогательной вентиляции с поддержкой давлением может нивелировать уровень внутреннего ПДКВ (за счет чего устраняется связанная с ним дополнительная нагрузка на дыхание) и снижает работу, которую дыхательные мышцы затрачи-
зают на увеличение дыхательного объема. При использовании должных параметров ИВЛ происходит нарастание дыхательного объема и снижение частоты дыхания. В подобных /словиях применение НИВ может быстро снижать РаСОа и возвращать к нормальным значениям рН крови (3). Brochard и сотр. показали, что НИВ может редуцировать элек-громиографическую активность диафрагмы (3).
Во время проведения НИВ важно осознавать недопустимость превышения внешним "ЩКВ уровня auto-PEEP, что позволяет избежать ятрогенного нарастания гиперинфля-дии. При условии, что во время вентиляции через лицевую маску внешнее ПДКВ состав-пяет 80-90% от значения внутреннего, не отмечено изменений конечно экспираторного эбъема (4).
Методы
У пациентов с ХОБЛ НИВ может проводиться как через лицевую, так и носовую (назальную) маску. Носовая маска, как правило, хорошо переносится больными, реже вызы-зает клаустрофобию и причиняет меньше неудобств. Возможно самостоятельное упот-эебление пищи и жидкости, а также откашливание. С другой стороны, метод теряет преимущества у пациентов с тяжелой острой дыхательной недостаточностью, развившейся на фоне сохранения свободного дыхания через рот и снижения контакта с персоналом.
Лицевые (анфасные маски) увеличивают объем мертвого пространства (данная про-Злема может быть частично разрешена с помощью специальных приспособлений для заполнения неиспользуемого объема маски) и не так хорошо переносятся больными, в го же время им свойственна меньшая утечка дыхательной смеси. Применение лицевых иасок показано при тяжелой декомпенсации дыхательной недостаточности или при неэффективности назальных.
Для достижения герметичного и длительного прилегания к лицу пациента маски обычно крепятся при помощи эластических ремешков-стяжек. Чрезвычайно важно избежать ггечек воздуха и соответственно проблем с триггерными режимами вспомогательной юнтиляции, хотя значительная компрессия может привести к некрозу прилегающих участков кожи лица. По нашему опыту, на фоне НИВ, превышающей по длительности 72 часа, некроз кожи отмечается у больных с ХОБЛ в 15% случаев. Тем не менее, по прекра-цению респираторной терапии кожным поражениям свойственно быстрое заживление, )бычно происходящее за 7-10 дней. Риск возникновения подобных повреждений может 5ыть снижен путем применения клейких накладок, помещаемых в местах наибольшего ;авления (обычно в области переносицы). Эти приспособления увеличивают площадь, на юторую производится давление и, таким образом, уменьшают глубину кожных некрозов.
Раздутие желудка не является типичным осложнением НИВ. При использовании лице-юй маски воздух попадает в желудок только при превышении давления раскрытия верх-юго пищеводного сфинктера, которое обычно не менее 25-30 см Н2О (5). Данные значе-шя давления на вдохе редко достигаются у пациентов с ХОБЛ, особенно при проведе-ши неинвазивной вспомогательной вентиляции с поддержкой давлением (NIPSV). В не-юторых моделях масок конструктивно предусмотрена возможность введения назогаст->альных зондов, предупреждающих аэрофагию даже при повышении давления в дыха-•ельных путях более 25 см Н2О.
Вспомогательная вентиляция легких у больных с ХОБЛ может быть с легкостью осу-цествлена через лицевую маску. Однако в настоящее время все шире прослеживается •енденция к использованию вентиляции с поддержкой давлением, которая лучше пере-юсится больными и вызывает меньше осложнений (6). В случае применения НИВ уро-!ень ПДКВ обычно устанавливается на значения 3-5 см Н2О, что позволяет, по крайней /iepe, частично нивелировать внутреннее ПДКВ. Начальный уровень давления поддерж-:и, как правило, составляет 10-12 см Н2О. Маска должна быть удобно расположена на шце больного. После проведения нескольких вдохов ее крепления налаживаются таким )бразом, чтобы избежать избыточного давления на кожу лица и одновременно не допус-
тить утечек дыхательной смеси. Далее проводят повышение уровня давления поддержки до достижения частоты дыханий менее 30/мин и дыхательного объема не менее 7 мл/кг. Уровень FiO2 должен обеспечивать поддержание SaC>2 более 90%, чувствительность триггера вдоха устанавливается на значение -1 см Н^О, при этом пиковое давление на вдохе не должно превышать 25 см Н^О.
Критерии прекращения НИВ зависят от тяжести заболевания: в случае, если респираторная поддержка начата на ранней стадии дыхательной недостаточности, как правило, возможно проводить периодическое прекращение НИВ на 10-20 минут после начального длительного периода вентиляции (по нашему опыту, 3-6 часов). В более тяжелых случаях начальный период проведения НИВ составляет 12-24 часа с последующими короткими перерывами, которые допустимы только при клиническом улучшении состояния. Клинически, ответ на.терапию оценивается по показателям газообмена, рН, частоты дыхания, учитывается психическое состояние больного. При наличии стойкого улучшения состояния периоды перевода на спонтанное дыхание могут прогрессивно увеличиваться. В течение периодов прекращения НИВ ключевое значение приобретает активная физиотерапия. Не приходится говорить о необходимости постоянного наличия под рукой оборудования для выполнения экстренной интубации трахеи.
Клинические результаты
В одном из первых отчетов, посвященных использованию НИВ в отделениях интенсивной терапии (7), хорошие результаты были получены лишь у небольшого числа больных с ХОБЛ, в случае которых было предложено обойтись без интубации трахеи. В исследовании методом случай-контроль, проведенном Brochard и сотр. (3) было предположено, что данная методика может снижать как необходимость в интубации трахеи, так и сроки госпитализации, что ведет к экономическим преимуществам.
В первом рандомизированном проспективном исследовании Bott и сотр. сравнили НИВ и традиционную терапию у 60 пациентов ХОБЛ, осложненной развитием острой дыхательной недостаточности. Неинвазивная вентиляция проводилась посредством назальной маски, при этом в основной группе наблюдалось значительное снижение РаС02 и явлений диспноэ. Выживаемость в группе НИВ оказалась значительно выше (90% против 70% в контрольной группе, р < 0.01).
Недавно эффективность НИВ у пациентов с острым обострением ХОБЛ была исследована в Европейском проспективном мультицентровом рандомизированном исследовании под координацией Brochard (9). В данной работе было оценено 85 пациентов с ХОБЛ, при этом были исключены больные с кардиогенным отеком легких, пневмонией и послеоперационной ОДН. Произведено рандомизированное разделение пациентов на контрольную (общепринятое лечение, т. е. медикаментозное и кислородотерапия) и основную (традиционная терапия + НИВ с начальным значением давления на вдохе 20 см Н2<Э и отсутствием ПДКВ). По истечении 1 часа терапии НИВ существенно улучшала показатели газообмена. У больных основной группы значительно реже приходилось переходить на интубацию трахеи, чем в контрольной группе (26% и 74%, соответственно, р < 0.001), была ниже частота осложнений (14% и 45%, соответственно, р < 0.01), короче сроки госпитализации (23+17 и 35±33 дня, соответственно, р < 0.02) и ниже смертность (9% и 29%, соответственно, р < 0.02). Средняя продолжительность проведения НИВ составила 4±2 дня. Интересно, что частота летальных исходов была примерно одинакова у пациентов обеих групп, в случае которых пришлось выполнить интубацию трахеи (27% и 32%).
Kramer и сотр. оценили эффект НИВ посредством назальной маски у 26 пациентов с ХОБЛ, рандомизированно разделенных на группы НИВ и общепринятой терапии. Несмотря на незначительное и мало отличающееся в обеих группах снижение РаС02, авторы отмечают значительное снижение частоты интубации трахеи, а также существенное и стабильное улучшение значений РаО2, ЧСС и частоты дыхания в группе НИВ (10).
Lofaso и сотр. (11) показали, что на фоне вентиляции в режиме BIPAP без использования ПДКВ или слишком коротком времени выдоха может происходить повторное вдыхание СО2- Данный факт может отчасти объяснять ограниченные изменения РаСОз, отмеченные Kramer (10).
Противопоказания
Несмотря на то, что в условиях отделений интенсивной терапии НИВ является полезной альтернативой традиционной ИВЛ, метод не лишен недостатков.
В частности, необходимо избегать использования метода у пациентов с нестабильной гемодинамикой, например, при гипотензии и/или наличии угрожающих жизни аритмий, а также в случае тяжелых психических нарушений. НИВ не может использоваться, когда для защиты дыхательных путей от аспирации требуется выполнение интубации трахеи (например, кома, отсутствие кашлевого рефлекса, острое заболевание органов брюшной полости с явлениями септической энцефалопатии и вздутия живота, нарушение глотательных рефлексов или расстройства респираторного драйва). Следует также избегать неинвазивной вентиляции у больных с деформациями лицевого скелета или недавно выполненными хирургическими вмешательствами в области головы и шеи.
Пневмония или недавно перенесенный ОИМ не должны расцениваться в качестве формальных противопоказаний к НИВ. В то же время данная группа не так хорошо переносит данный метод вентиляции и требует использования более высоких уровней давления (t2, 13).
Основываясь на нашем опыте, терапия с использованием НИВ не противопоказана у больных с отсутствием зубов и наличием усов или бороды, хотя корректное наложение лицевой маски в этих случаях может быть затруднено. В подобных обстоятельствах следует прежде всего планировать проведение НИВ посредством назальной маски.
НИВ у больных с острой дыхательной недостаточностью
В связи с хорошими результатами, полученными при использовании НИВ у пациентов с острой декомпенсацией ХОБЛ, в настоящее время проводиться оценка метода в качестве альтернативы интубации трахеи у больных с острой дыхательной недостаточностью. Также была проведена оценка НИВ у больных, которые отказывались от интубации трахеи, при этом наиболее часто приходилось сталкиваться с проблемами у пациентов с потенциально обратимой дыхательной недостаточностью, возникшей на фоне терминальной стадии заболеваний (14).
У пациентов с развитием гипоксии на фоне дыхательной недостаточности назначение НИВ преследует следующие цели:
ПДКВ не должно обычно превышать 10 см Н2<Э
снижение работы спонтанного дыхания с целью достижения физиологических значений дыхательного объема и устранение поверхностного тахипное, характеризующего ОДН
Потенциальное достижение этих целей с помощью НИВ предупреждает развитие усталости дыхательной мускулатуры и необходимость в выполнении интубации трахеи.
Возможно проведение НИВ посредством назальной или лицевой маски с теми же критериями исключения и общими принципами, что были описаны в разделе, посвященном применению метода при ХОБЛ.
На основании работ других исследователей и нашего собственного опыта можно считать, что у пациентов с тяжелой гипоксемией предпочтительнее использование лицевой маски, поскольку они обычно отличаются частым дыханием через рот (5).
16 Зак. 1581
Клинические результаты
Одна из первых попыток использования НИВ у больных с ОДН отражена в сообщении Meduri и сотр. в 1989г (7). В работе авторы использовали вентиляцию с поддержкой давлением (PSV) и вентиляцию, контролируемую по давлению (PCV), проводимые посредством лицевой маски у четырех пациентов, двое из которых имели некардиогенный и двое - кардиогенный отек легких, при этом у 3 больных были получены прекрасные результаты.
В последствии Pennock сообщил об успешном в 50% случаев лечении больных с ОДН различного генеза, при этом были получены обнадеживающие результаты у пациентов с послеоперационной острой дыхательной недостаточностью (15).
Недавно опубликовано первое проспективное рандомизированное исследование, вы-
- полненное Wysocki и сотр.(16): систематическое применение НИВ при несвязанной с ХОБЛ ОДН не дало преимуществ по сравнению с общепринятой схемой лечения. Примечательно, что исследование было разработано с целью оценки возможностей НИВ предупредить интубацию трахеи, а не выступить в качестве альтернативного метода лечения ОДН в целом.
Мы выполнили проспективное рандомизированное сравнительное исследование НИВ и традиционной терапии у пациентов отделений интенсивной терапии с гипоксемической ОДН, требующих в связи с этим перевода на ИВЛ. Применение НИВ сокращало время „ пребывания в отделении, а также частоту связанных с интубацией инфекционных осложнений (17).
* Кроме того, интересные результаты были получены в двух пилотных исследованиях, выполненных Tognet (18) и нашей группой (19) при лечении пациентов с онкозаболеваниями, осложненными ОДН. Исследователи (20) придавали особое значение неблагоприятному исходу заболевания у больных с гранулоцитопенией, которым в связи с ОДН проводилась ИВЛ. В то же время ОДН представляет типичное состояние у больных с гематологическими заболеваниями, что вызвано сочетанием крайне высокой восприимчивости к оппортунистическим инфекциям и прямым пневмотоксическим действием химио-терапевтических средств.
В подобных обстоятельствах НИВ может иметь ряд преимуществ, поскольку метод прост и может быть применен на раннем этапе заболевания и сопровождается меньшим числом осложнений. Наряду с этим НИВ обладает важными этическими преимуществами у пациентов с гематологическими заболеваниями, которые отказываются от проведения интубации трахеи, но согласны на вентиляторную поддержку. Таким образом, достигаются обе цели: продолжение интенсивной терапии и уважение к волеизъявлению пациента.
Выполнение бронхоскопии у пациентов с тяжелой гипоксемией на фоне вспомогательной НИВ
Сопровождающаяся тяжелой гипоксемией пневмония является типичным осложнением у иммунокомпроментированных пациентов (гематологические заболевания, трансплантация органов и др. состояния) (21). В данной группе больных жизненно необходимым является незамедлительная и точная идентификация микроорганизма-возбудителя. К сожалению, имеющаяся у неинтубированных пациентов тяжелая гипоксемия является главным противопоказанием к проведению фиброоптической бронхоскопии (ФОБ) и/или бронхоальвеолярного лаважа (БАЛ) (22), в связи с чем терапия нередко начинается эмпирически.
Мы предположили, что использование вспомогательной НИВ через лицевую маску может обеспечить безопасное выполнение ФОБ и БАЛ у неинтубированных пациентов с тяжелой гипоксемией (23). НИВ проводилась в течение 10 минут до и 90 минут после проведения бронхоскопии. У всех пациентов был идентифицирован возбудитель пневмо-
нии, что позволило начать раннее и прицельное лечение. Ни у одного из больных не потребовалось выполнение интубации, напротив, отмечалось значительное повышение Pa02/FiOa и SaOa, кроме того, данные показатели оставались высокими в течение всего времени исследования.
Выполнение ФОБ в условиях НИВ оказалась выполнимым, безопасным и эффективным методом ранней и точной диагностики у неинтубированных пациентов с тяжелой ги-поксемией. Несмотря на необходимость постоянного взаимодействия с больным и скрупулезного мониторинга, данный способ представляется многообещающим при использовании у больных с нарушениями иммунного статуса.
Выводы
Несмотря на сравнительно недавнее введение метода неинвазивной вентиляции легких в терапию больных с ОДН, удалось достичь определенных тактических соглашений. В частности, у больных ХОБЛ НИВ является полезным методом терапии, позволяющим избежать интубации (что снижает связанную с ней дополнительную смертность и частоту осложнений) и в то же время проводить вентиляторную поддержку (8, 9). Необходимо всегда рассматривать возможность испытательного использования НИВ (при отсутствии формальных противопоказаний), особенно на ранних стадиях декомпенсации ХОБЛ.
Несмотря на ободряющие предварительные результаты, полученные у пациентов с ОДН другого генеза, некоторые аспекты данного метода терапии все еще вызывают дискуссии. Для достижения единодушия относительно применения НИВ у больных с различными формами ОДН необходимо дальнейшее проведение крупных проспективных, рандомизированных и мультицентровых исследований.
Литература
1. Torres A, Aznar R, GatellJM et al. Am. Rev. Respir. Dis. 1990,142:523-528.
2. Burns HP, Dayal VS, Scott A, Van Nostran ANP, Bryce DP. Laryngoscope 1979, 89:1316-1325.
3. Brochard L, Isabey D, Piquet J et al. J. Med. 1990, 323:1523-1530.
4. Appendini L, Patessio A, Zanaboni S et al. Am. J. Respir. Crit. Care Med. 1994,149:1069-1076.
5. Meduri GU. Current Opinion in Critical Care 1996, 2:35-46.
6. Vitacca M, Rubin/ F, Foglio К et al. Intens. Care Med. 1993,19: 456-461.
7. Meduri GU, Conoscenti CC, Menashe P, Nair S. Chest 1989, 95: 865-870.
8. Bott J, Carroll MP, Conway JH et al. Randomized controlled trial of nasal ventilation in acute ventilator/ failure due to chronic obstructive airways disease. Lancet 1993, 341:1555-1558.
9. Brochard L, Mancebo J, Wysocki M et al. Efficacy of non-invasive ventilation for treatment of acute exacerbations of chronic obstructive pulmonary disease. N. Engl. J. Med. 1995, 333:817-822.
10. Kramer N, Meyer TJ, Meharg J, Cece RD, Hill N5. Randomized, prospective trial of noninvasive positive pressure ventilation in acute respiratory failure. Am J Respir Crit Care Med 1995,151:1799-1806.
11. Lofaso R, Brochard L, Touchard D et al. Evaluation of carbon dioxide rebreathing during pressure support ventilation with airway management system (BiPAP) devices. Chest 1995,108: 772-778.
12. Meduri GU, Turner RE, Aboul-Shala N, Wunderink RG, Tolley E. Non invasive positive pressure ventilation via face mask: first-line intervention in patients with acute hypercapnic and hypoxemic respiratory failure. Chest 1996,109:179-193.
13. Pennock BE, Kaplan PD, Car/in BW et al. Chest 1991,100:1371-1376.
14. Meduri GU, Fox RC, Abo-Shala et al. Irit. Care Med. 1994, 22:1584-1590.
15. Pennock BE, Crawshan L., Kaplan PD: Non invasive nasal mask ventilation for acute respiratory failure. Chest 1994, 105: 441-444.
16. Wysocki M, TricL, Wolff MA eta/. Chest 1995,107:761-768.
17. Antonelli M, Conti G, Rocco M, Bufi M et al. N. Engl. J. Med. 1998; 339: 429-435
18. Tognet E, Mercatello A, Coronet В et al. Intens. Care Med. 1992; 18, Suppl. 2: S-121.
19. Conti G, Marino P, Cogliati A, Dell'Utri D, et al. Intens. Care Med. 1998 (in press).
20. Lloyd-Thomas AR, Dhaliwal HS, Lister ТА, Hinds CJ. Intensive therapy for life-threatening medical complications of haematological malignancy. Intens. Care Med. 1986,12:317-324.
21. Gentile G, Micozzi A, Girmenia C, lori AP et al. Pneumonia in allogenic and autologous bone marrow recipients. Chest 1993; 104:371-375.
22. American Thoracic Society. Am. Rev. Respir. Dis. 1990; 142: 481-486.
23. Antonelli M, Conti G, Riccioni L, Meduri GU. Non-invasive positive pressure ventilation via face mask during bronchoscopy with bronchoalveolar lavage in high risk hypoxemic patients. Chest 1996; 110: 724-728.
шчшсто,
НАДЕЖНОСТЬ*
ДОЛГОВЕЧНОСТЬ!
RADIOMETER COPENHAGEN

Анализаторы газов крови АБЛ 700 серии - новый стандарт в экспресс диагностике критических состояний: точные измерения билирубина . фетального гемоглобина и лактата в пробах цельной крови
Измеряемые параметры:
рН,рО2,/>СО2,Ю2,
O2Hb, ctO2,, tHb, СОНЬ,
MetHb, HHb, HbF, K+,
Ca^, Na+, СГ, ctBili, cGIu, cLactate
+ 45 рассчитываемых
параметра в 95 |ол крови

</ Гибкая конфигурация параметров, программное обеспечение на базе Windows®95, -/цветной сенсорный экран, /возможность обучения в процессе работы с помощью видеопрограмм, ^/автоматический контроль качества, Vхавтоматический контроль количества промывочных растворов и калибровочного газа.
Представительство компании «Радиометр Интернешнл А/С» (Дания) 119048, Москва, ул. Усачева, дом 33, стр. 1, этаж 3. Тел/факс: (095) 93721 17 Телефон: (095) 937 21 18 E-mail: radiom@msk.tsi.ru
Официальный дистрибьютор: ПЕТРОЛАБ
195248 г. Санкт-Петербург, пр. Энергетиков, 37
тел/факс: (812) 303 83 43,118 63 69, 227 49 34
103031 г. Москва, ул. Петровка, 27
тел/факс(095) 937 45 05
E-mail: petrolab@infopro.spb.su Web-site:www.petrolab.ru
СОВРЕМЕННЫЕ ДОСТИЖЕНИЯ В ТЕРАПИИ ОСТРОГО РЕСПИРАТОРНОГО
ДИСТРЕСС-СИНДРОМА
Кл. Левандовски, X. Лобрюннер (Берлин, Германия)
Определение, эпидемиология и летальность
В основе диагноза острого респираторного дистресс-синдрома легких (ОРДС) лежит увеличение внутрилегочного левостороннего шунта, снижение податливости (комплайн-са) легких и рентгенологическое подтверждение двухсторонней инфильтрации легочной ткани, при этом левосторонняя сердечная недостаточность не должна являться преобладающей причиной патологических изменений [1]. В связи с решающим значением унификации лабораторных и клинических понятий, эпидемиологии и лечебных алгоритмов Американо-Европейская Согласительная Конференция по ОРДС недавно рекомендовала к использованию следующие критерии:
острое начало процесса
соотношение напряжения кислорода в артериальной крови к фракции вдыхаемого кислорода (PaO2/FiO2 - «индекс оксигенации») менее 200 mmHg независимо от уровня ПДКВ
билатеральная инфильтрация легочной ткани при фронтальной рентгенографии
давление заклинивания легочных капилляров (ДЗЛК) 18 mmHg (при выполнении исследования) или отсутствие клинических признаков повышения давления в левом предсердии [2]
ОРДС развивается вторично и является следствием разнообразных поражений, заболеваний и факторов риска. Некоторыми из часто приводящих к развитию ОРДС внеле-гочных патологических состояний являются шок, сепсис, внелегочная травма, передозировка лекарственных препаратов, панкреатит, эклампсия, заболевания ЦНС, эмболии, ожоги и массивная гемотрансфузия. К легочным причинам патологии относятся аспирация, ушиб легких, пневмония и прочие инфекционные процессы, воздействие радиации, токсических газов и ложное утопление.
Согласно последним эпидемиологическим исследованиям частота развития ОРДС варьирует от 1,5 до 9,3 случаев на 100.000 населения в год [3]. Проводимые в Европе и США мультицентровые исследования и работы отдельных проблемных групп продолжают констатировать, что смертность при данной патологии превышает 50%. Однако, в последние десятилетия отмечается рост выживаемости среди данной категории пациентов при условии лечения в специализированных центрах [4, 5].
Патофизиология
С патофизиологической точки зрения ОРДС характеризуется опосредованным повреждением альвеолярно-капиллярной мембраны отеком, повышением давления в легочной артерии и тяжелой гипоксемией, не устраняемой обычными, используемыми при ОДН методами респираторной поддержки. Гипоксемия связана с персистирующей перфузией I невентилируемых альвеол. К прочим нарушениям, характеризующим процесс, относится ! низкая податливость легких, а также высокая сопротивляемость дыхательных путей и паренхимы. При компьютерном томографическом исследовании выявляется негомогенное распределение пораженных участков, часто расположенных в зависимых зонах легких. При ОРДС легочная ткань может быть представлена как смесь из трех различных зон: непораженные участки, потенциально включаемые в вентиляцию (с возможностью рек-j рутмента, резервные зоны) и пораженные участки. Газообмен возможен лишь в зонах 1 непораженной и резервной легочной ткани. С учетом данной модели, легкие у взрослых пациентов с ОРДС напоминают легкое здорового младенца («младенческое легкое»), при
этом оставшиеся от нормального объема 20-30% ткани легкого должны обеспечить адекватный существующим потребностям организма газообмен [6].
Цели терапии
На протяжении многих лет основой лечения больных ОРДС оставалась ИВЛ с использованием ПДКВ и высокого дыхательного объема (10-15 мл/кг массы тела). В основе данных параметров респираторной поддержки лежали исследования интраоперационной ИВЛ с низкими дыхательными объемами. В этой категории пациентов отмечалось улучшение газообмена на фоне перемежающейся вентиляции легких с большим ДО, приводящей к раскрытию ателектазированных участков легких. Сочетание высокого дыхательного объема и низкой частоты дыхания являлось рутинной практикой у больных с дыхательной недостаточностью, когда необходимо было достичь снижения РаСО2- Подобный подход часто использовался в качестве обоснования высокого пикового давления в дыхательных путях. В течение последних 10 лет на основе клинических и лабораторных исследований получены неопровержимые доказательства, что вышеуказанный подход к вентиляторной поддержке может обуславливать прогрессирование заболевания, а в худших случаях вызывать острое поражение легких. ИВЛ может индуцировать такие биохимические процессы, как активация нейтрофильных гранулоцитов и инфильтрацию ими легочной ткани и высвобождение цитокинов, приводящих к локальным или общим воспалительным реакциям [7]. Более того, в нескольких исследованиях было показано, что высокие значения FiO2 являются причиной клинического поражения легких с патологическими изменениями, которые весьма близки к таковым при ОРДС.
Несколько позже была сформирована группа старых и новых методов вентиляции и прочие терапевтические подходы, которые были способны улучшить газообмен и минимизировать повреждение легких, возникающее под влиянием ИВЛ. Целью современного подхода к лечению ОРДС является достижение максимального защитного эффекта. Он основан на сочетании мер респираторной поддержки и протекции легких. Далее в общих чертах описаны и обсуждаются наиболее важные компоненты современной терапии ОРДС.
Вентиляция, контролируемая по давлению
При контролируемой по давлению ИВЛ (ВКД) на фоне приближенных к «квадратным» волнам давления устанавливается частота и специфический интервал постоянного давления. Данный принцип лежит в основе нескольких, недавно введенных в терапию ОРДС режимов ИВЛ: ВКД с инверсированным отношением вдох: выдох, вентиляция со сбросом давления в дыхательных путях, вентиляция с двухфазным положительным давлением (BIPAP) и вентиляция с перемежающимся принудительным сбросом давления.
ВКД с инверсированным соотношением вдох: выдох представляет собой режим респираторной поддержки, обеспечивающий удлинение времени вдоха. Таким образом, достигается стабилизация функциональных единиц легочной ткани и равномерная диффузия газов. За счет укороченной экспираторной фазы количество воздуха, покидающего легкие (дыхательный объем) не превышает объем закрытия альвеол, что, соответственно, предупреждает их спадение. В связи с ранним и «подпирающим» характером раздутия легких инверсированная ВКД обеспечивает прогрессивное вовлечение (рекрут-мент) спавшихся альвеол и стабилизацию зон легких с дефицитом сурфактанта.
Использование инверсированной ВКД на фоне спонтанного дыхания пациента может приводить к десинхронизации с аппаратом ИВЛ. Для наиболее полной реализации свойственных режиму преимуществ, таких как перераспределение газа и наполнение альвеол, нередко требуется глубокая седация пациентов, а иногда и миорелаксация. Современные сведения о механических свойствах легких предполагают, что инверсированная ВКД приводит к возникновению увеличенных сил раскрытия (сдвига), что может обуславливать повреждение легочной ткани, особенно при ОРДС, когда комплайнс значительно
снижен. В клинических условиях применение ВКД часто сопровождается развитием баротравмы. Однако дальнейших исследований, посвященных связям между частотой баротравмы и использованием данного режима у больных ОРДС не проводилось. Также не имеется доказательств того, что баротравма более часто встречается при ВКД с инверсией, чем при традиционных режимах вентиляции.
Положительное давление в конце выдоха (ПДКВ)
В конце 60-х годов американские исследовательские группы описали положительное влияние ПДКВ на функциональную остаточную емкость легких и оксигенацию артериальной крови у больных с ОДН. Наиболее распространенным объяснением данного явления считается вовлечение в газообмен (рекрутирование) ранее коллабированных альвеолярных единиц [8] и снижение сердечного выброса (СВ). Наличие при ОРДС как тяжело, так и умеренно пораженных зон легких может приводить к дальнейшему ухудшению респираторной функции на фоне ИВЛ с использованием ПДКВ. Распределение принудительно поступающего при механической вентиляции газа происходит преимущественно в области наиболее податливых, не пострадавших альвеолярных единиц, в то время как вентиляция пораженных зон страдает в связи с закрытием дыхательных путей и коллапсом альвеол. С другой стороны, перфузия определяется силами тяжести и главным образом направлена в зависимые зоны легких. ПДКВ увеличивает альвеолярное давление, что ведет к снижению перфузии в участках непострадавшей легочной ткани. Gattinoni и колл. показали положительный эффект ПДКВ, используя РКТ-исследование легких [9]. Повышение ПДКВ у пациентов с тяжелым ОРДС приводило к прогрессирующему просветлению рентгенологических уплотнений легочной ткани и увеличивало объем нормально вентилируемой ткани, при этом отмечалось уменьшение объема венозного примешивания.
Определение уровня ПДКВ, обеспечивающего максимальное улучшение вентиляции и наносящего минимальное повреждение, является весьма сложной задачей, при этом эффект данного метода трудно клинически отслеживать. Начиная с 5 см Н20 необходимо мониторировать влияние повышения ПДКВ на состояние гемодинамики, газообмен и податливость легких. В настоящее время принято устанавливать значение ПДКВ на уровне, соответствующем или превышающем нижнюю точку изгиба на кривой графического соотношения давление-объем (P-V кривая) [10]. На ранних стадиях ОРДС уровень ПДКВ с учетом вышесказанного лежит в пределах от 8 до 15 см НзО. Однако, последующие работы Gattioni и сотр. показали, что у пациентов с ОРДС различной этиологии, то есть при патологии «легочного» и «внелегочного» происхождения, в респираторной механике имеются определенные различия, что требует индивидуализированного подхода к подбору уровня ПДКВ [11]. Данных, обоснованно доказывающих тот факт, что под угрозой баротравмы следует воздерживаться от применения клинически обоснованных значений ПДКВ, нет. В данное время применение ПДКВ остается стандартной процедурой при ИВЛ у больных с ОРДС.
Тактика допустимой гиперкапнии при ИВЛ
Больные ОРДС имеют повышенный риск поражения легких на фоне их перерастяжения. Для избежания этого серьезного осложнения принудительной вентиляции было внесено предложение мониторировать кривые P-V, что позволило бы индивидуально подбирать значения дыхательного объема и ПДКВ. Данный подход поясняет приведенный ниже рисунок.
Рисунок 1. Кривая давление-объем имеет нижнюю (небольшой объем) и верхнюю точки (большой объем) перегиба. Нижняя точка может быть использована для титрования уровня ПДКВ, верхняя указывает на достижение дыхательного объема, при котором начинается перерастяжение легких. При высоком дыхательном объеме или ПДКВ и повышении давления в дыхательных путях выше уровня верхней точки происходит уменьшение доставляемого объема и перерастяжение, по , крайней мере, части альвеолярных структур. С целью максимальной защиты легких при ОРДС следует предупреждать их перерастяжение путем установки значения дыхательного объема в области значений, проецирующихся на линейную часть кривой, расположенную между ее перегибами.
Концепция защиты легкого при тяжелом ОРДС предусматривает использование небольших дыхательных объемов (5-8 мл/кг массы тела), что позволяет поддерживать пиковое давление в дыхательных путях ниже уровня верхней точки перегиба P-V кривой и установку уровня ПДКВ выше нижней точки, что предупреждает раннее экспираторное закрытие дыхательных путей и спадение альвеол. Подобный подход к ИВЛ нередко приводит к повышению уровня РаСO2 и снижению рН: пределы толерантности к данным изменениям получили название «допустимой гиперкапнии» ДГК - РНС, англ.) [12]. В то время, как острая гиперкапния потенциально приводит к внутриклеточному ацидозу, легочной гипертензии, повышению мозгового кровотока и активации симпатоадреналовой системы, постепенное повышение РаСO2 создает условия для компенсации этих нарушений. У больных с тяжелым ОРДС даже весьма значимая гиперкапния при условии постепенного развития в течение нескольких дней хорошо переносится [12]. Использование контролируемой по давлению вентиляции в сочетании с ДГК может снижать летальность при тяжелом ОРДС. При ретроспективном анализе 50 случаев тяжелого ОРДС госпитальная летальность оказалась значимо ниже, чем можно было ожидать на основе прогностического расчета по шкале АРАСНЕ-Н (16% и 39,6%, соответственно) [12]. Эти результаты были подтверждены в проспективном исследовании, включавшем 53 больных [13]. Недавно Amato и сотр. на основе рандомизированного и контролируемого исследования показали, что при использовании концепции ДГК отмечается улучшение оксигена-ции, требуются более низкие уровни давления в дыхательных путях и достигается снижение летальности [14]. •
Действие ДГК на физиологические процессы организма весьма многогранно, при этом ряд аспектов данного влияния изучен очень плохо. В частности, у пациентов с черепно-мозговыми травмами, гипоксическим повреждением мозга или кардиопатией следует тщательно взвесить возможные преимущества и недостатки от использования данного метода.
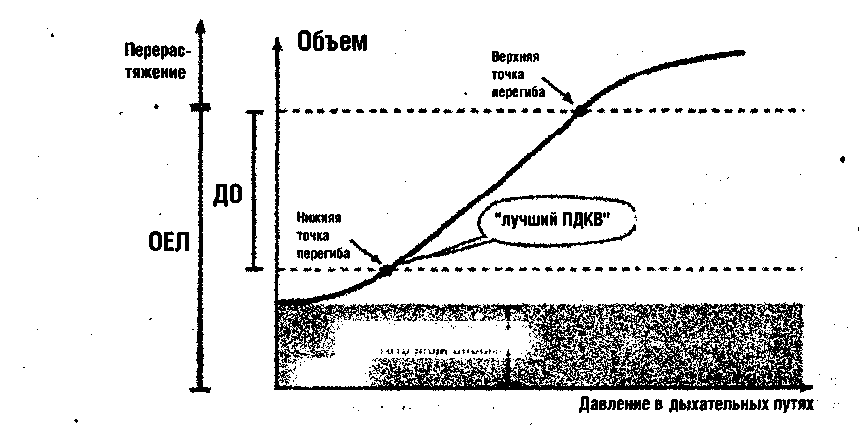
ИВЛ в положении на животе (ничком)
Более 30 исследований (в том числе многие из работ Chate и сотр. [15]) сообщают об улучшении оксигенации на фоне проведения ИВЛ в положении на животе. На основании имеющихся литературных данных могут быть сделаны следующие выводы:
Перевод пациента в положение на животе часто улучшает показатели РаС>2, PaC>2/FiC>2 и SaO2
Выраженность улучшения оксигенации значительно варьирует, газообмен может не изменяться, а у некоторых больных даже ухудшаться
У. разных больных время наступления изменений в газообмене может значительно отличаться
При обратном повороте пациента возможно дальнейшее улучшение газообмена, его ухудшение или отсутствие в течение большего или меньшего периода времени каких-либо изменений
При улучшении газообмена и оксигенации во время первого перевода в положение на живот, реакция на смену позиции в последующем может измениться. В настоящее время мы не в состоянии с уверенностью предсказать индивидуальную реакцию пациента, в связи с чем рекомендуются повторные тестирующие повороты.
Томографические исследования легких при ОРДС показали, что уплотнения легочной ткани первично возникают в пораженных (зависимых) зонах, в то время как не вовлеченные участки преимущественно сохраняют нормальную плотность [9]. При использовании позиции на животе на фоне разрешения уплотнений в задне-базальных отделах легочной ткани отмечается появление изменений в передних зонах. Несмотря на прослеживающееся изменение локализации уплотнений средняя суммарная плотность легочной ткани оставалась неизменной. Перераспределение участков повышенной плотности главным образом может быть связано с коллапсом или уменьшением размеров альвеол в зависимых зонах легких и их раскрытием в непораженных регионах в ответ на изменение градиента гравитационного давления. Наблюдаемое у некоторых больных улучшение оксигенации может быть объяснено перераспределением кровотока в области с лучшими показателями вентиляции. Кроме того, положение на животе может стимулировать дренаж трахеобронхиального секрета и посредством этого препятствовать развитию консолидации и суперинфекции.
Снижение отека легких
Накопление воды в легких у больных с ОДН может быть вызвано следующими факторами:
• повышение давления в легочных капиллярах
• изменение проницаемости мембраны легочных капилляров
• снижение онкотического давления плазмы
• дисфункция лимфатической системы легких
• повышение отрицательного интерстициального давления
Максимальное снижение отека легочной ткани является краеугольным камнем в лечение ОРДС. К рутинным клиническим мероприятиям относится ограничение под контролем ДЗЛК давления в левом предсердии и как можно более осторожное проведение внутривенной инфузионной терапии на фоне применения диуретиков или заместительной почечной терапии.
Несколько лет тому назад в мониторинге эффективности лечения отека легких применялось измерение давления в верхней полой вене (ДВПВ). Было высказано предположение, что повышение данного показателя может быть ассоциировано с нарушением оттока лимфы от легких, так как лимфатические сосуды должны развивать давление, противостоящее таковому в полой вене. Замедленное выведение интерстициальной жидкости, в свою очередь, может обуславливать развитие или прогрессирование отека [16].
У больных с ОРДС внутривенное введение кристаллоидных растворов может приводить к увеличению показателей внесосудистой воды легких (ВСВЛ, EVLW - extravascular lung water, англ.): данный феномен весьма распространен при состояниях, сопровождающихся поражением эндотелия. Назначение коллоидов также несет в себе потенциальную угрозу в связи с возможностью повышения фильтрации воды и протеинов в ин-терстициальную ткань, что, по сути, крайне нежелательно при ОРДС. Однако, на фоне применения диуретиков, применение коллоидных растворов может приводить к улучшению альвеолярно-артериального градиента по кислороду (DAaO2) [17].
Применение фуросемида может помочь в достижении отрицательного гидробаланса, что в свою очередь приводит к улучшению оксигенации и повышению статической податливости легких [18]. Несмотря на широкое применение препарата, мы не обнаружили исследований, указывающих на регрессию отека легких и, одновременно, улучшение газообмена на фоне развивающегося при введение препарата дефицита жидкости. Если данный метод дегидратации не привел к желаемым результатам, следует без промедления использовать гемофильтрацию или диализ [19]. Поскольку все вышеприведенные
. методы неразрывно сопряжены с риском ухудшения деятельности почек и прочих органов и систем, следует продолжать их использование только при условии очевидного
с снижения интерстициального отека легких. Регулярное измерение внесосудистой жидкости легких (EVLW), а также частый рентгенологический контроль должны являться непре-
- ложными методами контроля эффективности терапии. Для избежания гиповолемии и поддержания адекватной органной перфузии жизненно необходима сбалансированная заместительная инфузионная терапия. Мы предпочитаем превентивное переливание эритроцитарной массы до достижения значений гемоглобина в 140-150 г/л с последующим дополнением эмпирической комбинацией небольших объемов кристаллоидных и коллоидных растворов.
Экстракорпоральная респираторная поддержка (ЭКРП)
ЭКРП логически основана на создании покоя поврежденным легким до восстановления их функции. Два рандомизированных контролируемых исследования не доказали преимуществ данного подхода по сравнению с «общепринятым лечением» ОРДС [20, 21]. В то же время некоторые центры с успехом дополняют традиционные методы лечения ЭКРП, добиваясь при этом высокого уровня выживаемости в группе больных с тяжелым ОРДС (> 50%) [22].
Основным осложнением данной группы методов является кровотечение. С 1983 г. стала возможна гепаринизация всех контактирующих с кровью устройств для экстракорпорального газообмена. В настоящее время во всех центрах, где проводится ЭКРП, используются оксигенаторы с гепариновым покрытием трубок и мембран, но влияние подобного подхода на частоту развития кровотечений до конца не выяснено.
В итоге, риск кровотечения и субоптимальная производительность доступных в настоящее время мембранных оксигенаторов ограничивают показания к применению ЭКРП критическими ситуациями с высоким риском смерти пациента на фоне гипоксемии. Подобные вмешательства должны выполняться только в специализированных центрах.
Ингаляция оксида азота (NO)
Повышение проницаемости сосудистого русла легких при ОРДС часто сопровождается развитием легочной артериальной гипертензии. К росту давления приводят три основных фактора: обструкция сосудов, их облитерация и вазоконстрикция. Основное направление изменений реактивности легочных сосудов может быть представлено вазо-констрикцией. На фоне острого повреждения легких, даже при отсутствии легочной гипертензии развивается нарушение механизма гипоксической легочной вазоконстрикции, что может приводить к нежелательному сдвигу вентиляционно-перфузионных соотношений и, соответственно, ухудшению оксигенации.
В опытах на животных показано, что ингаляция NO в течение 3 минут способна устранить острую легочную вазоконстрикцию. Вдыхание газа не оказывает влияния на легочное и системное сосудистое сопротивление, сердечный выброс, давление в левом предсердии и ЦВД, также не отмечено и серьезных побочных эффектов. Оксид азота избирательно улучшает перфузию вентилируемых зон легких, что ведет к улучшению оксигенации и позволяет снизить давление на вдохе и фракцию вдыхаемого кислорода до менее опасного уровня. Проведенные в нашем институте исследования показали, что ингаляция NO в концентрации 18 ррт (частей на миллион) приводит к значительному снижению среднего давления в легочной артерии (с 37 mmHg до 30 mmHg) и уменьшению соотношения шунтирования (Qs/Qt) с 36% до 31% [23]. Ингаляция проводилась пациентам с тяжелым ОРДС и длилась 40 минут, использованы две разные концентрации NO. Среднее артериальное давление и сердечный выброс не изменялись. В последующих исследованиях эффективности данного метода у больных с ОРДС получены схожие результаты
Токсическое действие NO продолжает сохранять свое значение. В связи с этим следует использовать минимально возможную концентрацию газа, позволяющую получить желаемый результат. Gerlach и колл. показали, что необходимые для улучшения оксигенации у больных с ОРДС дозы NO могут быть значительно ниже, в частности ED50 (эффективная у 50% больных доза) газа составляет около 100 ppb (частей на миллиард, т.е. 0,1 ррт - прим, перев.) [24]. Средняя эффективная доза (ED50), необходимая для снижения среднего давления в легочной артерии, составила от 2 до 3 ррт. В определении необходимых для улучшения оксигенации и снижения давления в легочной артерии дозировок NO полезным является использование кривых индивидуального ответа на ингаляцию газа.
Выводы
ОРДС характеризуется острым прямым или непрямым повреждением легких, приводящим через 24-72 часа к артериальной гипоксемии, снижению податливости легких и появлению на рентгенограммах диффузной двухсторонней инфильтрации. Частота развития данной патологии не высока и составляет от 3 до 10 случаев на 10000 населения в год, однако, синдром характеризуется высокой летальностью, превышающей 50%. В течение последних лет удалось, проводя лечение в специализированных центрах, добиться снижения уровня летальности. ИВЛ и прочие вспомогательные методы лечения ОРДС прошли путь от традиционного подхода, направленного на нормализацию параметров вентиляции, до концепции защиты легкого во время ИВЛ. Приобрели значение предупреждение токсического влияния высоких концентраций кислорода, вовлечение в вентиляцию инфильтрированных, ателектазированных и уплотненных зон легких, снижение анатомического и альвеолярного мертвого пространства. Новая тактика включает использование различных режимов ИВЛ с контролем по давлению, применение ПДКВ и допустимой гиперкапнии, изменение положения тела, снижение отека легких и ингаляцию оксида азота. При неэффективности вышеперечисленных компонентов терапии возможно дополнительное применение экстракорпоральной респираторной поддержки.
Литература
1. Ashbaugh DC, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet 1967; 2:319-323.
2. Bernard GR, Art/gas A, Brigham KL, Carlet J, Falke K, Hudson L, Lamy M, LeGal/ JR, Morris A, Spragg R, and the Consensus Committee. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial co-ordination. Am J Respir Crit Care Med 1994; 149:818-824.
3. Lewandowski K, Metz J, Deutschmann C, PreiB H, Kuhlen R, Art/gas A, Falke Ю. Incidence, severity, and mortality of acute respiratory failure in Berlin, Germany. Am J Respir Crit Care Med 1995; 151:1121-1125.
4. Milberg JA, Davis DR, Steinberg KP, Hudson LD. Improved survival of patients with acute respiratory distress syndrome (ARDS): 1983-1993. JAMA 1995; 273:306-309.
5. Abel SJC, FinneySJ, Brett SJ, Keogh BF, Morgan CJ, Evans TW. Reduced mortality in association with the acute respiratory distress syndrome (ARDS). Thorax 1998; 53:292-294.
6. Gattinoni L, Pesenti A, Marco/in R, Mascheroni D, Fumagalli R, Rossi F, Avalli L, Giuffrida A, Bag//on/ S, Coffano B. Extracorporeal support in acute respiratory failure. In: Art/gas A, Lemaire F, Suter PM & Zapol WM (eds) Adult Respiratory Distress Syndrome, 1992; pp 469-475. Edinburgh: Churchill Livingstone.
7. Tremblay LN, Valenza F, Ribeiro SP, Li J, Slutsky AS. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest 1997; 99:944-952.
8. Falke Ю, Pontoppidan H, Kumar K, Leith DE, Geffin B, Laver MB. Ventilation with endexpiratory pressure in acute lung disease. J Clin Invest 1972; 51:2315-2323.
9. Gattinoni L, Pesenti A, Bombino M, Baglioni S, Rivolta M, Rossi F, Rossi G, Fumagalli R, Marco/in R, Mascheroni D, Torresin A. Relationships between lung computed tomographic density, gas exchange, and PEEP in acute respiratory failure. Anesthesiology 1988; 69:824-832.
10. Ben/to S, Lemaire F. Pulmonary pressure-volume relationship in acute respiratory distress syndrome in adults: role of positive end-expiratory pressure. J Crit Care 1990; 5:27-34.
11. Gattinoni L, Pelosi P, Suter PM, Pedoto A, Vercesi P, Lissoni A. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am J Respir Crit Care Med 1998; 158:3-11.
12. Hickling KG, Henderson SJ, Jackson R. Low mortality associated with low volume pressure limited ventilation with permissive hypercapnia in severe adult respiratory distress syndrome. Intensive Care Med 1990; 16:372-377.
13. Hickling KG, Walsh J, Henderson S, Jackson R. Low mortality rate in adult respiratory distress syndrome using low-volume, pressure-limited ventilation with permissive hypercapnia: a prospective study. Crit Care Med 1994; 22:1568-1578.
14. Amato MBP, Barbas CSV, Medeiros DM, Magaldi RB, De Paula Pinto Schettino G, Lorenzi-Filho G, Ka/ralla RA, Deheinzelin D, Munoz С Oliveira R, Takagaki TY, Carvalho CRR. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N EnglJ Med 1998; 338:347-354.
15. Chatte G, Sab JM, Dubois JM, Sirodot M, Gaussorgues P, Robert D. Prone position in mechanically ventilated patients with severe acute respiratory failure. Am J Respir Crit Care Med 1997; 155:473-478.
16. Laine GA, Allen SJ, Katz J et a/. Effect of systemic venous pressure elevation on lymph flow and lung edema formation. J ApplPhysio/1986, 61:1634-1638.
17. Skillman JJ, Parikh BM, Tanenbaum BJ. Pulmonary arteriovenous admixture. Improvement with albumin and diuresis. Am J Surg 1970; 119:440-447.
18. Bone RC. Treatment of adult respiratory distress syndrome with diuretics, dialysis, and positive end-expiratory pressure. Crit Care Med 1978; 6:136-139.
19. DiCarlo JV, Dudley ТЕ, Sherbotie JR, Kaplan BS, Costarino AT. Continuous arteriovenous hemofiltration / dialysis improves pulmonary gas exchange in children with multiple organ system failure. Crit Care Med 1990; 18:822-826.
20. Zapol WM, Snider MT, Hill JD, Fallat RJ, Bartlett RH, Edmunds LH, Morris AH, Peirce EC, Thomas AN, Proctor HJ, Drinker PA, Pratt PC, Bagniewski A, Miller KG. Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA 1979; 242:2193-2196.
21. Morris AH, Wallace CJ, Menlove RL, Clemmer TP, Orme JF, Weaver LK, Dean NC, Thomas F, East TD, Pace NL, Suchyta MR, Beck E, Bombino M, Sittich DF, Bohm S, Hoffmann B, Becks H, Butler S, Pearl J, Rasmusson B. Randomized clinical trial of pressure-controlled inverse ratio ventilation and extracorporeal CO2 removal for adult respiratory distress syndrome. Am J Respir Crit Care Med 1994; 149:295-305.
22. Lewandowski K, Rossaint R, Pappert D, Gerlach H, Slama KJ, Weidemann H, Frey DJM, Hoffmann O, Keske U, Falke KJ. High survival rate in 122 ARDS patients managed according to a clinical algorithm including extracorporeal membrane oxygenation. Intensive Care Med 1997; 23:819-835.
23. Rossaint R, Falke KJ, Lopez F, Slama K, Pison U, Zapol WM. Inhaled nitric oxide for the adult respiratory distress syndrome. N Engl J Med 1993; 328:399-405.
24. Gerlach H, Rossaint R, Pappert D, Falke KJ. Time-course and dose-response of nitric oxide inhalation for systemic oxygenation and pulmonary- hypertension in patients with adult respiratory distress syndrome. Eur J Clin Invest 1993; 23:499-502.
КРИВЫЕ ДАВЛЕНИЕ/ОБЪЕМ ПРИ РДСВ: СТАРЫЕ И НОВЫЕ АСПЕКТЫ
С.Карасон, О.Стенквист (Гетеборг, Швеция)
Почему-столько проблем с механикой дыхания?
С момента первого описания РДСВ летальность при этом состоянии колеблется в пределах от 40 до 60% и не меняется независимо от изучения самых различных методов терапии (1). В скандинавских странах цифра летальности при РДСВ составляет 41%, а при остром поражении легких (ОПЛ) - 42% (2). Однако в последней группе пациентов не изучалась взаимосвязь между оксигенацией, методиками вентиляции и летальностью (3).
Снижение цифр летальности с 40 до 31%, полученное при эмпирическом подборе малых дыхательных объемов с 12 до 6 мл/кг массы тела, не имеет статистической достоверности (4). При использовании профилактических режимов ИВЛ (5) количество маркеров воспаления в промывных водах из дыхательных путей и системного кровотока снижается, уменьшая риск развития органной недостаточности (6).
Взаимосвязь межу механической вентиляцией и показателями заболеваемости и летальности четко установлена в многочисленных экспериментальных моделях на животных. В результате этой взаимосвязи сформировалась концепция вентилятор-ассоциированного поражения легких (ВАПЛ) и выдвинута гипотеза, что поражение легких является причиной системной воспалительной реакции, приводящей к развитию полиорганной недостаточности (7), которая и становится основной причиной смерти пациентов с РДСВ (1). Однако, подобную взаимосвязь нельзя однозначно трансполировать на клинические исследования.
Как мониторируется механика вентиляции?
Интенсивные исследования механики вентиляции проводятся более 30 лет, однако измерительные методики не развивались, поэтому в клинической практике не существует способов точной оценки механики вентиляции пациентов на ИВЛ.
Статические/полустатические методы
Было установлено, что истинное значение соотношения давление/объем (Д/О) в альвеолах может быть измерено только при отсутствии или очень малом дыхательном потоке, так как падение давления в основном происходит за счет эндотрахеальной трубки и динамического сопротивления дыхательных путей.
Метод Супер Шприца - рекомендуемый способ измерения показателей механики вентиляции. Он основан на раздувании легких в общем объеме 1000-2000 мл воздуха с примесью 100 мл газа. Статические параметры измеряют путем прерывания на несколько секунд после каждого впрыскивание газа, а давление в дыхательных путях измеряется на всем протяжении от носа до альвеол. Отражением давления на определенном этапе впрыскивания по отношению к объему является кривая статического вдоха Д/О, которая часто имеет сигмовидную форму. Точка наибольшего прогиба соответствует моменту начала раскрытия спавшихся альвеол, а точка наибольшего изгиба кривой соответствует моменту перерастяжения альвеол. Подобным образом получают кривую статического выдоха Д/О при действиях в обратном порядке (8).
При тяжелом ОПЛ или РДСВ получаемые кривые статического вдоха и выдоха Д/О дают гистерезис. Обычно выдыхаемый объем значительно меньше вдуваемого. Причиной этого является нарушенный газообмен. Изменения температуры и влажности, а также давления впрыскивания также являются источниками артефактов. Предлагаются методы коррекции этих факторов (9), но они не точны (10). Больший гистерезис у пациентов с
РДСВ при меньшей остаточной функциональной емкости легких (ФОЕЛ) и при повышенном потреблении кислорода, сочетание которых приводит к более быстрой смене газа из ФОЕЛ при выполнении этого метода измерения.
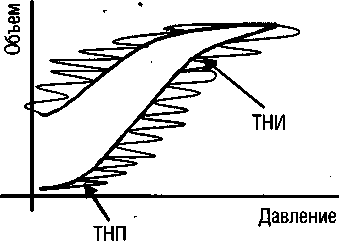
Рисунок 1. Схематическое изображение кривой Д/О, получаемой при использовании метода Супер Шприца. Процедура занимает от 30 до 60 секунд и является потенциально опасной для пациентов с тяжелым поражением легких. Изменения гистерезиса и объема на вдохе и на выдохе являются следствием газообмена во время проведения методики. ТНП - точка наибольшего прогиба, ТНИ - точка наибольшего изгиба.
Методика многочисленной окклюзии использует большое число прерываний вдоха при различном уровне дыхательного объема; это позволяет получить кривую статического соотношения Д/О. На выдохе, прерывая поток, невозможно получить гистерезис, вероятно за счет того, что на состояние Д/О в момент прерываний не влияет состояние газообмена, как это происходит в методике Супер Шприца. Эта методика статического измерения спустя много лет была уточнена и компьютеризирована (11).
Методика низкопоточного раздувания использует очень низкий по величине поток вдуваемого воздуха, чтобы минимизировать сопротивление эндотрахеальной трубки и дыхательных путей. При этом получают несколько смещенную вправо полустатическую кривую Д/О (12). Преимущество этой методики заключается в том, что анализируются показания только одного вдоха, но при длительном и более медленном раздувании по сравнению с нормальным вдохом могут появиться серьезные погрешности.
Все статические/полустатические методы требуют прерывания потока вентиляционной поддержки, дополнительного оборудования, времени на проведение измерений и анализа, а также специальных условий потока (отсутствие или очень низкий поток), которые при нормальном дыхании или ИВЛ не подсчитать. Давление в дыхательных путях колеблется от 0 до 40 см Н2О и может повредить состоянию легких (вовлечение и освобождение от нагрузки), поэтому измерение дает в разных ситуациях различные показатели. Они перемежающиеся и требуют стандартной настройки параметров вентиляции как до, так и после завершения измерений. Приведенные примеры статических/полустатических методов говорят о целесообразности их использования в плане профилактики динамических состояний системы дыхания.
Система дыхания, тем не менее, является динамической: и комплайнс, и сопротивление дыхательных путей зависят от объема, скорости потока и частоты дыхания (13-16). Поэтому механику вентиляции следует оценивать в динамике ее состояний.
Динамические методы
В отделениях интенсивной терапии (ОИТ) механика вентиляции обычно оценивается во время динамических состояний (статические/полустатические методы никогда не пользовались популярностью), но выполняется это очень примитивными и упрощенными способами. Давление в дыхательных путях измеряется либо вентилятором или в Y-образном тройнике, не принимая во внимание то, что значительное сопротивление эн-
дотрахеалы-юй трубки влияет на результаты динамических измерений. При измерении во время вдоха значительная часть сопротивления приходится на эндотрахеальную трубку, а во время выдоха небольшое сопротивление оказывает клапан выдоха вентилятора. Измерение комплайнса выполняется только в промежуток времени между началом и/или окончанием вдоха и/или выдоха, то есть в инспираторную или экспираторную паузы.
Чтобы повысить качество динамических измерений были предложены различные варианты с использованием показателя давления в Y-образном тройнике, подсчета трахе-ального давления или прямого измерения давления в трахее.
Методика стрессового индекса была разработана Ranieri и соавт. (17,18). В ней проводится анализ профиля кривой давления в дыхательных путях, которое измеряется в Y-образном тройнике при постоянном вдуваемом потоке (то есть при вентиляции, контролируемой по объему). Прогрессивное снижение пологой части кривой отражает момент вовлечения альвеол вентиляцией, а прогрессивное повышение кривой - момент их перерастяжения. В методике подразумевается практически постоянное сопротивление системы дыхания во время вдоха, но в действительности же объем является зависимым, поэтому сопротивление изменяется при дыхании.
Guttmann и соавт. предложили метод постоянного подсчета сопротивления эндотрахе-альной трубки, при котором измерения выполняются выше трубки, а алгоритм методики разработан на модели легких (19). Эта техника использует так называемый метод СРЕЗОВ при мониторинге механики вентиляции, основанный на множественной линейной регрессии (20). Однако сопротивление эндотрахеальной трубки непредсказуемо больше in vitro, чем in vivo из-за имеющихся ее изгибов и деформаций. Этот показатель также изменяется при использовании различных коннекторов, увлажнителей и т.д. И наконец, сопротивление трубки может изменяться во времени (21).
Рисунок 2. В правой колонке показано прямое измерение давления в трахее (жирная черная линия) и трахеальное давление, которое подсчитано (серая линия) из давления (тонкая черная линия) и показателей измеряемого потока в Y-образном тройнике по Guttmann и соавт. (19) в эндотрахеальной трубке с внутренним диаметром 7 мм без и с использованием 1 мл геля, введенного в трубку. При введении 1 мл геля в трубку калькулируемое трахеальное давление отражается с выраженным ложным повышением во время вдоха и ложным снижением на выдохе (21).
Мы разработали диностатический метод (22), который анализирует петли Д/О в трахее при прямом измерении трахеального давления. Мы впервые обсуждаем осложнения этой методики.

Зачем измеряется давление в трахее?
Точность динамических измерений механики вентиляции может быть повышена за счет мониторинга давления в трахее, так как эндотрахеальная трубка создает 2/3 всего сопротивления дыхательных путей от Y-образного тройника до альвеол. Измерения давления в трахее выполняется в течение вдоха и исключает сопротивление эндотрахеаль-ной трубки. Это позволяет легко идентифицировать конечную точку вдоха независимо от параметров вентиляции, в том числе от параметров потока (21,23).
При ИВЛ, контролируемой по объему (постоянный поток), инспираторная часть петли, измеренная в Y-образном тройнике, будет относительно параллельна инспираторной части петли Д/О, измеренной в трахее, но смещена вправо. При ИВЛ, контролируемой по давлению (замедляющийся поток), инспираторные части петель Д/О в тройнике и в трахее будут совершенно независимыми друг от друга. Форма экспираторной части петли, измеренной в Y-образном тройнике, также не будет совпадать с параметрами вентиляции и будет смещена влево по сравнению с экспираторной частью петли, измеренной в трахее.. Последняя отражает взаимосвязь между эластическими силами легочной ткани и грудной клетки и сопротивлением эндотрахеальной трубки (23).
Рисунок 3. Петли Д/О, полученные при измерении этих показателей в Y-образном тройнике и в трахее у разных пациентов при использовании различных режимов ИВЛ. В левой колонке: повышение дыхательного объема во время ИВЛ, контролируемой по объему, В средней колонке: повышение ПДКВ при ИВЛ, контролируемой по давлению. В правой колонке: увеличение времени вдоха при ИВЛ контролируемой по объему. При оценке петли, измеренной в трахее, четко видны конечная точка вдоха и выдоха (у всех пациентов), развитие перерастяжения альвеол (у всех пациентов) и формирование внутреннего ПДКВ (у пациентов в правой колонке). Такого феномена не обнаруживается при оценке петли Д/О, измеренной в Y-образном тройнике (23).
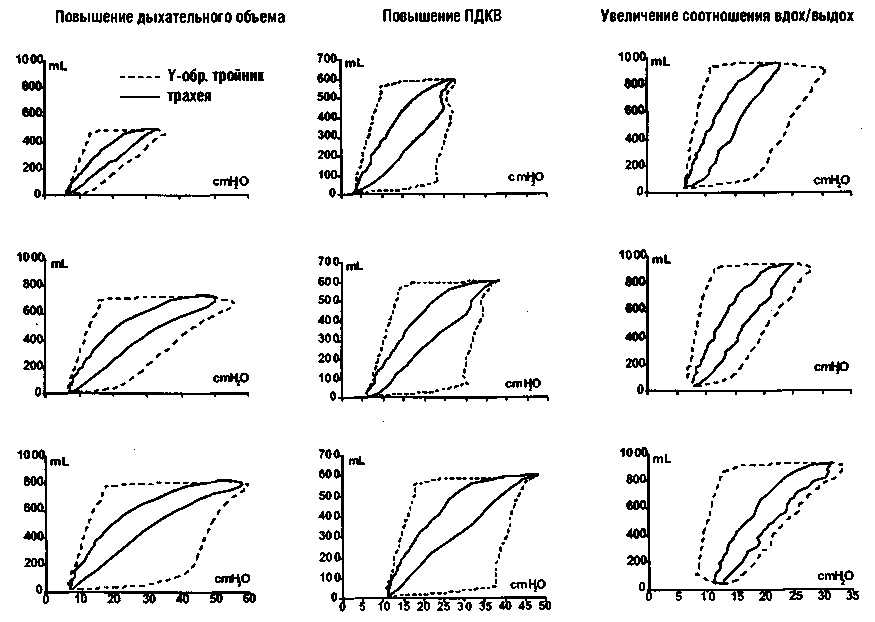
Измерение трахеального давления требует проведения через просвет эндотрахеаль-ной трубки датчика, который крепится на окончании трубки. Теоретически удобнее использовать катетер с боковым отверстием, что позволяет в любых условиях измерять статическое давление. Однако и катетер должен быть закреплен так, чтобы его отверстие находилось на 2 см ниже просвета трубки. Мы установили, что катетер с концевым отверстием имеет точность в пределах 1,5 см Н2О, он менее чувствителен к изменению положения его окончания в пределах расстояния от 2 см ниже до 2 см выше уровня просвета трубки. Когда поток проходит центральное сужение, как и во время выдоха (трахея-трубка), статическая энергия переходит в кинетическую (средняя скорость будет более, чем в 10 раз больше, при прохождении через эндотрахеальную трубку с внутренним диаметром 7 мм, чем через просвет трахеи с внутренним диаметром 22 мм). Таким образом, катетер с боковым отверстием, измеряющий только статическое давление, на выдохе будет выдавать заниженные показатели давления в дыхательных путях, при установке катетера внутри эндотрахеальной трубки. Катетер с концевым отверстием позволит измерить статическое давление минус кинетическое во время вдоха, но не сумму этих показателей во время выдоха (21).
Несмотря на то, что за счет прямого измерения давления в трахее повышается качество мониторинга механики вентиляции, это выполняется лишь во время исследований и недоступно в обычной практике. Выход находят в том, что пациентам выполняют катетеризацию крупных сосудов для измерения показателей гемодинамики. Так как прогнозируемая летальность таких пациентов около 40%, а использование ИВЛ в комплексной терапии может ее еще ухудшить, то не следует тратить слишком много усилий на повышение точности и эффективности методов мониторинга механики вентиляции.
*д-«-
Рисунок 4. Катетер для измерения трахеального давления, установленный через боковой порт Y-образного тройника.
Зачем измерять давление в пищеводе?
Комплайнс всей системы дыхания может мониторироваться при измерении только давления в дыхательных путях. Чтобы разделить общий комплайнс на составляющие (легких и грудной стенки), необходимо измерить давление в пищеводе, которое подобно давлению в плевральной полости. В ОИТ это выполняется редко несмотря то, что показательную информацию о механике вентиляции можно получить лишь разделяя биомеханику легких и грудной стенки. Мы оценили использование двухпросветного, заполненного жидкостью желудочного зонда (SalemTM) в качестве датчика и простой альтернативы пищеводного балонного катетера, применение которого в ОИТ не получило широкого распространения (24).
Из-за спиродинамики!
Диностатический метод анализирует петлю Д/О, измеренных в трахее, используя тот факт, что альвеолярное давление должно «лежать» в пределах петли между ее составляющими кривыми вдоха и выдоха. Оценивая давление и поток на вдохе, давление и по-
17 Зак. 1581
ток на выдохе при одинаковом легочном объеме на вдохе и на выдохе, а также учитывая, что сопротивление на вдохе и на выдохе при этом одинаковы, «альвеолярное давление» может быть высчитано по алгоритму диностатического метода:
Рдиностатическое = (Рвд х выд - Рвыд х вд) /(выд - вд),
где Рвд - давление на вдохе выд - поток на выдохе Рвыд - давление на выдохе вд - поток на вдохе
Таким образом, диностатический метод не допускает, что сопротивление является постоянным в течение всего акта дыхания и не зависит от постоянного потока. Поэтому он может быть использован как во время ИВЛ, контролируемой по объему, так при ИВЛ, контролируемой по давлению. Нет необходимости ни в инспираторной, ни в экспираторной паузах для подсчета альвеолярного давления (22).
tnsp
Рисунок 5. Математические основы диностатической кривой Д/О. Анализируется вся петля показателей Д/О, измеренных в трахее. Давление (Р), поток () и объем (V) регистрируются в одинаковых точках. Идентифицированы составляющие петлю кривые вдоха и выдоха. Каждой паре точек, кривой вдоха (вд) и кривой выдоха (выд), при одинаковом объеме (Vxjso) соответствует промежуточная, высчитываемая с помощью компьютерной программы. Это и есть альвеоляр-ное/диностатическое давление (Pxdyn) (22).
Рисунок 6. Отличие анализа механики вентиляции диностатическим методом от простого подсчета комплайнса между конечными точками вдоха и выдоха. У этого пациента дыхательный объем повышался на фоне ИВЛ, контролируемой по объему, с параметрами времени вдоха 25% и экспираторной паузы 10%. Различная форма кривых Д/О обусловлена повышением скорости потока и отражает значительно большее усилие для перерастяжения альвеол, чем при полустатическом методе, использующем экспираторные паузы. При этом смещение комплайнса при повышающемся объеме составляет всего 2 мл/см Н£> (от 20 до 18 мл/см Нф) (22).

Возможность допущения равных показателей сопротивления на вдохе и на выдохе при одинаковом дыхательном объеме было оценена на модели легких, где соотношение вдох/выдох составляло от 2,3/1 до 1/2,3. Именно в этих пределах получена наилучшая корреляция между измеренным альвеолярным давлением и высчитанным (22). В клиническом отношении при среднем дыхательном объеме оптимальным соотношением вдох/выдох у интубированных пациентов с нормальными легкими является 1/1,1, у пациентов с РДСВ - 1/0,9", а при ХОЗЛ - 1/2,5 (25,26).
Комбинируя методы диностатического алгоритма с измерением давления в трахее и пищеводе, можно мониторировать механику вентиляции пациентов на ИВЛ вдох за вдохом при любых параметрах и режимах вентиляции. Такая концепция мониторинга называется спиродинамикой и обеспечивает:
а) анализ петли Д/О, измеренных в трахее, высчитанную кривую Д/О по диностатиче-скому алгоритму, что отражает состояние всей системы дыхания
б) анализ петли Д/О, измеренных в пищеводе и кривую Д/О, отражающую состояние стенки грудной клетки
в) высчитанную петлю Д/О в легких, как разницу показателей двух кривых Д/О, высчитанных по диностатическому алгоритму
г) постоянное мониторирование альвеолярного давления.
Для оценки всей системы дыхания, используя кривые Д/О в легких, может быть высчитан комплайнс в зависимости от объема, то есть в течение всего акта дыхания.
Рисунок 7. Пример начального (INI), среднего (MID) и конечного (FIN) комплайнса в зависимости от объема (КЗО) в течение всего акта дыхания для всей системы дыхания (ТОТ) и для легких (LUNG). Отмечены соответствующие показатели комплайнса (мл/см Н^О). Комплайнс стенки грудной клетки (СГК) высчитан как наилучшее в плане линейной формы кривой Д/О стенки грудной клетки с использованием метода наименьших квадратов, так как из-за артефактов сердечных осцилляции невозможно подсчитать КЗО стенки грудной клетки.
В исследовании у 10 пациентов с ОПЛ и РДСВ мы обнаружили прогрессивное снижение комплайнса в пределах каждого дыхательного цикла при увеличении ПДКВ и дыхательного объема. У этих же пациентов при частоте дыхания 20 в минуту с нормальным дыхательным объемом точка максимального прогиба кривой Д/О была не ниже, но при низкопоточной вентиляции у 3 из 4 пациентов это было отмечено.
Заключение
Показатели измерений отражают состояние системы дыхания при ИВЛ. Это требует простого мониторного оборудования с дополнительными простыми и недорогими методиками прямого мониторинга трахеального и пищеводного давления, а также с четким
алгоритмом анализа данных. Это позволяет оценивать кривую альвеолярного Д/О как в режиме «on-line», так и фракционно, включая состояние всей системы дыхания и стенки грудной клетки в частности. Индивидуальная настройка вентиляции возможна и она позволяет снизит!? риск развития ВАПЛ.
Литература
1. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med 2000; 342:1334-1349.
2. Luhr OR, Antonsen K, Karlsson M, Aardal S, Thorste/nsson A, Frostell CG, Bonde J. Incidence and mortality after acute respiratory failure and acute respiratory distress syndrome in Sweden, Denmark, and Iceland. The ARF Study Group. Am J Respir Crit Care Med 1999; 159:1849-1861.
3. Luhr O, Karlsson M, Thorste/nsson A, Rylander C, Frostell C. The impact of respiratory variables on mortality in non-ARDS and ARDS patients requiring mechanical ventilation. Intensive Care Med 2000; 26:508-517.
4. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N EnglJ Med 2000; 342:1301-1308.
5. Ranieri VM, SuterPM, Tortorella C, De TullioR, DayerJM, Brienza A, Bruno F, SlutskyAS. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA 1999; 282: 54-61.
6. Ranieri VM, Giunta F, Suter PM, Slutsky AS. Mechanical ventilation as a mediator of multisystem organ failure in acute respiratory distress syndrome. JAMA 2000; 284:43-44.
7. Slutsky AS, Tremblay LN. Multiple system organ failure. Is mechanical ventilation a contributing factor? Am J Respir Crit Care Med 1998; 157:1721-1725.
8. Brochard L: Respiratory pressure-volume curves, Principles and practice of intensive care monitoring. Edited by Tobin M. New York, McGrawHill, 1998, pp 597-616
9. Gattinoni L, Mascheroni D, Basilico E, Foti G, Pesenti A, Avalli L. Volume/pressure curve of total respiratory system in paralysed patients: artefacts and correction factors. Intensive Care Med 1987; 13:19-25.
10. Sydow M, Burchardi H, Zinserling J, Ische H, Crozier ТА, Weyland W. Improved determination of static compliance by automated single volume steps in ventilated patients. Intensive Care Med 1991; 17:108-114.
11. Servillo G, De Robertis E, Coppola M, Bias! F, Rossano F, Tufano R. Application of a computerised method to measure static pressure volume curve in acute respiratory distress syndrome. Intensive Care Med 2000; 26:11-14.
12. Servillo G, Svantesson C, Beydon L, Roupie E, Brochard L, Lemaire F, Jonson B. Pressure-volume curves in acute respiratory failure: automated low flow inflation versus occlusion. Am J Respir Crit Care Med 1997; 155:1629-1636.
13. D'Angelo E, Calderini E, Tom'G, RobattoFM, Bono D, Milic-Emili J. Respiratory mechanics in anesthetized paralyzed humans: effects of flow, volume, and time. JAppI Physiol 1989; 67:2556-2564.
14. Similowski T, Levy P, Corbeil C, Albala M, Pariente R, Derenne JP, Bates JH, Jonson B, Milic-Emili J. Viscoelastic behavior of lung and chest wall in dogs determined by flow interruption. J Appl Physiol 1989; 67:2219-2229.
15. Eissa NT, Ranieri VM, Corbeil C, Chasse M, Robatto FM, BraidyJ, Milic-Emili J. Analysis of behavior of the respiratory system in ARDS patients: effects of flow, volume, and time. J Appl Physiol 1991; 70:2719-2729.
16. Barnas GM, Mills PJ, Mackenzie CF, Ashby M, Sexton WL, Imle PC, Wilson PD. Dependencies of respiratory system resistance and elastance on amplitude and frequency in the normal range of breathing. Am Rev Respir Dis 1991; 143:240-244.
17. Ranieri VM, Giuliani R, Fiore T, Dambrosio M, Milic-Emili J. Volume-pressure curve of the respiratory system predicts effects of PEEP in ARDS: "occlusion" versus "constant flow" technique. Am J Respir Crit Care Med 1994; 149:19-27.
18. Grasso S, Mascia L, Trotta T, Di Fonzo M, Ribezzo M, et a. Dynamic airway pressure/time curve analysis to realizr lung protective ventilatory strategy in ARDS patients. Intensive Care Med 2000; 26: S329.
19. Guttmann J, Eberhard L, Fabry B, Bertschmann W, Wolff G. Continuous calculation of intratracheal pressure in trachea/// intubated patients. Anesthesiology 1993; 79:503-513.
20. MolsG, Brandes I, Kessler V, Lichtwarck-Aschoff M, Loop T, Geiger K, Guttmann J. Volume-dependent compliance in ARDS: proposal of a new diagnostic concept. Intensive Care Med 1999; 25:1084-1091.
21. Karason S, Sondergaard S, Lundin S, Wiklund J, Stenqvist O. Direct trachea! airway pressure measurements, essential for accurate and safe monitoring of trachea! pressures. A laboratory study. Acta Anaesthesiol Scand 2000; In Press
22. Karason S, Sondergaard S, Lundin S, Wiklund J, Stenqvist O. A new method for non-invasive, manoeuvre-free determination of "static" pressure-volume curves during dynamic/therapeutic mechanical ventilation. Acta Anaesthesiol Scand 2000; 44: 578-585.
23. Karason S, Sondergaard S, Lundin S, Wiklund J, Stenqvist O. Evaluation of pressure/volume loops based on intratracheal pressure measurements during dynamic conditions. Acta Anaesthesiol Scand 2000; 44:571-577.
24. Karason S, Karlsen KL, Lundin S, Stenqvist O. A simplified method for separate measurements of lung and chest wall mechanics in ventilator-treated patients. Acta Anaesthesiol Scand 1999; 43:308-315.
25. Jonson B, Beydon L, Brauer K, Mansson C, Valind S, Grytzell H. Mechanics of respiratory system in healthy anesthetized humans with emphasis on viscoelastic properties. J Appl Physiol 1993; 75:132-140.
26. Beydon L, Svantesson C, Brauer K, Lemaire F, Jonson B. Respiratory mechanics in patients ventilated for critical lung disease. Eur Respir J1996; 9:262-273.
ИНФУЗИОННАЯ ТЕРАПИЯ ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ
Жан-Луи Винсен (Брюссель, Бельгия)
Введение
Острая дыхательная недостаточность является распространенной и типичной причиной летального исхода у пациентов отделений интенсивной терапии. ОДН представляет собой состояние, при котором легкие не в состоянии поддерживать надлежащую потребностям организма оксигенацию артериальной крови и элиминацию углекислого газа. Превалирующими причинными факторами данного состояния служат острый респираторный дистресс-синдром (ОРДС) и менее тяжелые формы дыхательной патологии, именуемые синдромом острого повреждения легких (СОПЛ, ALI - англ.). Впервые описанный более 30 лет назад, ОРДС характеризуется некардиогенным отеком легких и рефрактерной гипоксемией. По достигнутому к настоящему моменту соглашению ОРДС определяется как состояние, сопровождающееся двухсторонней инфильтрацией легких (рентгенологически) и снижением соотношения PaO2/FiO2 < 200 mmHg (если данный показатель находится на уровне от 200 до 300 mmHg, можно констатировать СОПЛ). ОРДС является полиэтиологичным состоянием, причем одним из важнейших механизмом его развития служит высвобождение медиаторов воспаления. Происходящие при синдроме ранние патологические изменения включают секвестрацию нейтрофилов в легких и внутрисосу-дистое" накопление повреждающих альвеолярно-капиллярный барьер фибрин-тромбоцитарных агрегатов. Данные процессы ведут к повышению проницаемости сосудистого русла легких, прогрессирующему легочному воспалению и отеку [1]. Именно развитие типичного отека легких легло в основу распространенного мнения о необходимости ограничения введения жидкости больным с подобной патологией.
В то же время ОРДС часто является компонентом септических состояний и полиорганной недостаточности, в случае которых интенсивная инфузионная терапия является одним из важнейших лечебных подходов и направлена на оптимизацию доставки кислорода тканям. Подобные обстоятельства, соответственно, послужили причиной дебатов вокруг подхода к инфузионной терапии у больных с ОРДС и прочими сопровождающимися некардиогенным отеком легких формами ОДН [2, 6]. В предложенной вниманию читателя статье мы обсуждаем теоретические основы накопления жидкости в легких на фоне ОРДС и резюмируем современные представления о данной проблеме.
Ток жидкости
Накопление жидкости в интерстициальном секторе происходит в соответствии с уравнением Старлинга:
Of = Kf [(Pmv - Ppmv) - (m v - pm v)]
В приведенном равенстве:
Of - результирующее (итоговое) поступление жидкости через мембрану микрососудов (т.е. поступление в пространство между капиллярным и перикапиллярным секторами)
- Kf - коэффициент фильтрации капилляров, отражающий площадь русла, на которой возможен перенос жидкости
- Pmv - гидростатическое давление в легочных капиллярах (клинически измеряемое как давление заклинивания легочных капилляров, ДЗЛК)
- Ppmv - гидростатическое давление в перикапиллярном (т.е. интерстициальном) секторе
- hiv и pmv - онкотическое давление жидкостей в капиллярном и интерстициальном пространстве легких соответственно.
Движение жидкости через стенку капилляра зависит от размера имеющихся в ней пор и результирующей движущей силы фильтрации. Существующий в нормальных условиях положительный градиент гидростатических давлений (Pmv - Ppmv) ведет к появлению тока жидкости из зоны циркуляции в интерстиций. Данной тенденции противостоит онко-тический градиент (mv - pmv), направляющий движение жидкости в зону сосудистого русла. В итоге подобного противостояния возникает неустойчивая тенденция к поступлению жидкости в направлении интерстиция, возникающий при этом ее избыток выводится лимфатической системой легких. На фоне ОРДС гидростатические давления остаются низкими, но в то же время нарастание проницаемости мембран ( стремится к нулю, a Kf повышается) приводит к снижению защитного эффекта онкотического градиента, противостоящего поступлению жидкости из сосудистого сектора в интерстиций. Таким образом, результирующий ток жидкости ориентируется в направлении интерстиция, дренажные резервы лимфатического аппарата легких истощены, воздухонесущие зоны заполняются жидкостью и развивается отек легких [7].
Ограничение инфузионной терапии?
Отек легких нарушает газообмен. При кардиогенном варианте подобной патологии первопричиной формирования отека является повышение гидростатического давления в сосудистом русле легких. Снижение этого давления путем ограничения поступления жидкостей или увеличением диуреза приводит к снижению содержания жидкости в ткани легких. Однако в случае ОРДС накопление жидкости в легочной ткани происходит в связи с повышением проницаемости капилляров, не имеющей на сегодняшний день какого-либо специфического метода коррекции. В то же время развивающееся при ограничении инфузионной терапии снижение преднагрузки представляет собой обоснованный подход к предупреждению прогрессирования отека на фоне рациональной терапии ведущей причины ОРДС и ожидания нормализации капиллярной проницаемости. При нарушении проницаемости легочного микрососудистого русла скорость нарастания отека при любом данном изменении ДЗЛК выше по сравнению с нормальными условиями. Таким образом, теоретически преимущества от снижения гидростатического давления в сосудах легких налицо. В исследованиях на животных снижение ДЗЛК снижает скорость развития отека, нормализует оксигенацию и улучшает исход [8, 9].
Возникло предположение, что ограничение поступления жидкости может иметь определенные преимущества у пациентов с ОРДС. При ретроспективном анализе 40 больных с данной патологией Humphrey и сотр. [10] показали, что при по крайней мере 25%-ном снижении ДЗЛК путем ограничения инфузионной терапии, назначением диуретиков, кровопусканием, проведением диализа или ультрафильтрации, уровень летальности среди пациентов значительно снижался. Eisenberg и сотр. [11] сообщили о снижении летальности среди больных ОПТ (преимущественно с сепсисом или ОРДС) при снижении содержания внесосудистой воды легких на фоне ограничения поступления жидкости или диуретической терапии. Другие исследователи [12-14] также констатировали повышение выживаемости и снижение сроков пребывания в ОИТ у больных с ОРДС при регулируемой потере жидкости. Однако проведенные исследования не являются рандомизированными и контролируемыми, т.е. фактически их результаты являются логическими выводами; у более тяжелых пациентов требуется введение больших объемов инфузионных сред, у выздоравливающих необходимо выведение избытка жидкости.
Инфузионная терапия?
ОРДС нередко имеет место при сепсисе и прочих критических шоковых состояниях, протекающих с развитием полиорганной недостаточности. В действительности причиной смерти большинства больных с ОРДС является не взятый отдельно респираторный дистресс, а развитие ПОН [15]. Ограничение поступления жидкости в этих случаях может привести к снижению сердечного выброса и ухудшению доставки кислорода (DO2), что вызывает снижение и без того нарушенной тканевой оксигенации. Гиповолемия является важным этиологическим фактором развития ОРДС и ее раннее устранение может ограничить высвобождение медиаторов и соответственно нарушение проницаемости мембран [16]. В самом деле, Bishop и сотр. [17] показали, что относительная или протекающая субклинически гиповолемия может увеличивать частоту ОРДС, а ранняя инфузион-ная терапия у больных группы риска предупреждает его развитие. Согласно исследованиям Meade и др. [18] ОРДС чаще развивался у пациентов с травматическими поражениями, имевшими более низкие значения показателей сердечного выброса и доставки кислорода. Shoemaker и Appel [19] также отметили подобные изменения гемодинамики и транспорта кислорода у больных с неблагоприятным исходом. Напротив, Russel и сотр. [20] в своей работе показали, что более высокие уровни доставки (DO2) и потребления (VO2) кислорода были характерны в группе выживших больных.
Для больных с ОРДС характерно патологическое состояние, когда потребление кислорода остается зависимым от его доставки даже при более высоких уровнях DO2, чем это имеет место в норме [21, 22], особенно на фоне наличия признаков острой недостаточности кровообращения [23]. В связи с этим имели место споры о необходимости более агрессивной инфузионной терапии и применения инотропов с целью достижения превышающих нормальные значения показателей DO2 [24-26]. Однако этот подход к терапии не был отдельно исследован при ОРДС, хотя и может иметь преимущества у отдельных категорий таких больных. Эмпирическое применение данного подхода у всех пациентов «группы риска» оказалось неэффективным и более того - способным приводить к повышению летальности.
На пути к соглашению?
Одна из проблем, связанных с понятием «сухого» и «влажного» легкого, заключается в точном определении, что подразумевается под «сухим» и «влажным». Насколько сухим является «сухое» и насколько влажным «влажное» легкое? [2]. Измерение содержания легочной воды и определение альвеолярно-капиллярной проницаемости не относятся к методам рутинной диагностики и не подвергались обстоятельной оценке у больных отделений интенсивной терапии [28]. У этой категории пациентов невозможно рекомендовать какое-либо определенное значение ПДКВ, которого следует строго придерживаться, поскольку все пациенты имеют отличия и требуют индивидуального подхода к лечению. У некоторых больных с ОДН ограничение поступления жидкости может улучшать оксигена-цию, но в случае снижения сердечного выброса подобный подход в итоге может привести к ухудшению доставки кислорода к тканям. Единственным выходом из данной ситуации представляется индивидуализированный, контролируемый по эффекту подход к терапии, в основу которого должны быть заложены повторный клинический контроль, регулярная оценка состояния гемодинамики и определение маркеров оксигенации тканей, таких как содержание лактата в крови или РСО2 слизистой желудка [29]. Лечение должно проводиться с учетом ответа на него и подбираться таким образом, чтобы обеспечить поддержание адекватной перфузии тканей.
Не существует данных, подтверждающих, что выбор средств инфузионной терапии оказывает какое-либо влияние на исход ОРДС, хотя данный вопрос продолжает оставаться противоречивым [30]. В целом, использование с заместительной целью коллоидных растворов требует применения меньших их объемов по сравнению с кристаллоида-
ми [31], что потенциально ограничивает риск развития отека легких. Было подтверждено, что некоторые коллоидные растворы могут улучшать функцию поврежденной альвеоляр-но-капиллярной мембраны путем ограничения капиллярной утечки [32]. В то же время вызывал противоречия тот факт, что в связи с нарушением целости капиллярной мембраны коллоиды могут увеличивать отек легких по причине их утечки в интерстиций и повышения интерстициального онкотического давления.
На фоне углубления наших представлений о причинах ОДН и, как частного примера, ОРДС развиваются новые методы лечения (использование сурфактанта [33], ингаляция -адреномиметиков [34] или аэрозольное применение эпидермального фактора роста [35]). Они могут улучшить клиренс внутрилегочной воды путем воздействия на эпителиальный барьер, не влияя при этом на сердечный выброс и системную перфузию.
Выводы
На фоне большого числа противоречий, которые возникают при обсуждении инфузи-онной терапии у больных с ОРДС, наиболее благоразумным представляется достижение определенного компромисса. Ограничение введения жидкости определенно может наносить вред состоянию пациентов с уже поставленной под удар тканевой перфузией, но и инфузионная перегрузка может вести к ухудшению обмена кислорода. У больных с ОРДС не может быть строго определенного и универсального правила расчета гидробаланса: в каждом отдельном случае лечение должно проводиться под контролем гемодинамиче-ского профиля, параметров газообмена и клинического состояния. Приоритетной целью является достижение гемодинамической стабильности и адекватной тканевой перфузии при одновременном избежании потребности в вазопрессорных агентах. Как только этот рубеж взят, необходимо поддерживать ДЗЛК на минимально допустимом уровне, какой только возможен при одновременном сохранении гемодинамической стабильности. Введение новых, прицельно направленных на улучшение клиренса легочной воды и оказывающих меньшее влияние на системный баланс жидкостей, методов лечения может ускорить путь к окончательному решению представленной проблемы.
Литература
1. Ashbaugh DC, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet 1967; 2:319-323.
2. Bernard GR, Art/gas A, Brigham KL, Carlet J, Falke K, Hudson L, Lamy M, LeGall JK, Morris A, Spragg R, and the Consensus Committee. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial co-ordination. Am J Respir Crit Care Med 1994; 149:818-824.
3. Lewandowski K, Metz J, Deutschmann C, PreiB H, Kuhlen R, Art/gas A, Falke Ю. Incidence, severity, and mortality of acute respiratory failure in Berlin, Germany. Am J Respir Crit Care Med 1995; 151:1121-1125.
4. Milberg JA, Davis DR, Steinberg KP, Hudson LD. Improved survival of patients with acute respiratory distress syndrome (ARDS): 1983-1993. JAMA 1995; 273:306-309.
5. Abel SJC, Finney SJ, Brett SJ, Keogh BF, Morgan CJ, Evans TW. Reduced mortality in association with the acute respiratory distress syndrome (ARDS). Thorax 1998; 53:292-294.
6. Gattinon/ L, Pesenti A, Marco/in R, Mascheroni D, Fumaga/li R, Rossi F, Avalli L, Giuffrida A, Baglioni S, Coffano B. Extracorporeal support in acute respiratory failure. In: Artigas A, Lemaire F, Suter PM & Zapol WM (eds) Adult Respiratory Distress Syndrome, 1992; pp 469-475. Edinburgh: Churchill Livingstone.
7. Tremblay LN, Valenza F, Ribe/ro SP, Li J, Slutsky AS. Injurious ventilator/ strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest 1997; 99:944-952.
8. Falke Ю, Pontoppidan H, Kumar K, Leith DE, Geffm B, Laver MB. Ventilation with endexpiratory pressure in acute lung disease. J Clin Invest 1972; 51:2315-2323.
9. Gattinon/ L, Pesenti A, BombinoM, Baglioni S, Rivolta M, Rossi F, Rossi G, Fumagalli R, Marco/in R, Mascheroni D, TorresinA. Relationships between lung computed tomographic density, gas exchange, and PEEP in acute respiratory failure. Anesthesiology 1988; 69:824-832.
10. Ben/to S, Lemaire F. Pulmonary pressure-volume relationship in acute respiratory distress syndrome in adults: role of positive end-expiratory pressure. J Crit Care 1990; 5:27-34.
11. Gattinoni L, Pelosi P, Suter PM, Pedoto A, Vercesi P, Lissoni A. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am J Respir Crit Care Med 1998; 158:3-11.
12. Hickling KG, Henderson SJ, Jackson R. Low mortality associated with low volume pressure limited ventilation with permissive hypercapnia in severe adult respiratory distress syndrome. Intensive Care Med 1990; 16:372-377.
13. Hickling KG, Walsh J, Henderson S, Jackson R. Low mortality rate in adult respiratory distress syndrome using low-volume, pressure-limited ventilation with permissive hypercapnia: a prospective study. Crit Care Med 1994; 22:1568-1578.
14. Amato MBP, Barbas CSV, Medeiros DM, Magaldi RB, De Paula Pinto Schettino G, Lorenzi-Filho G, Kairalla RA, Deheinzelin D, Munoz C, Oliveira R, Takagaki TY, Carvalho CRR. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N EnglJ Med 1998; 338:347-354.
15. Chatte G, Sab JM, Dubois JM, Sirodot M, Gaussorgues P, Robert D. Prone position in mechanically ventilated patients with severe acute respiratory failure. Am J Respir Crit Care Med 1997; 155:473-478.
16. Laine GA, Allen SJ, Katz J et at. Effect of systemic venous pressure elevation on lymph flow and lung edema formation. J Appl Physio/1986, 61:1634-1638.
17. Skillman JJ, Parikh BM, Tanenbaum BJ. Pulmonary arteriovenous admixture. Improvement with albumin and diuresis. Am J Surg 1970; 119:440-447.
18. Bone RC. Treatment of adult respiratory distress syndrome with diuretics, dialysis, and positive end-expiratory pressure. Crit Care Med 1978; 6:136-139.
19. DiCarlo JV, Dudley ТЕ, Sherbotie JR, Kaplan BS, Costarino AT. Continuous arteriovenous hemofi/tration / dialysis improves pulmonary gas exchange in children with multiple organ system failure. Crit Care Med 1990; 18:822-826.
20. Zapol WM, Snider MT, Hill 3D, FallatRJ, BartlettRH, Edmunds LH, Morris AH, Peirce EC, Thomas AN, Proctor HJ, Drinker PA, Pratt PC, Bagniewski A, Miller KG. Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA 1979; 242:2193-2196.
21. Morris AH, Wallace CJ, Menlove RL, Clemmer TP, Orme JF, Weaver LK, Dean NC, Thomas F, East TD, Pace NL, Suchyta MR, Beck E, Bomb/no M, Sittich DF, Bohm S, Hoffmann B, Becks H, Butler S, Pearl J, Rasmusson B. Randomized clinical trial of pressure-controlled inverse ratio ventilation and extracorporeal CO2 removal for adult respiratory distress syndrome. Am J Respir Crit Care Med 1994; 149:295-305.
22. Lewandowski K, Rossaint R, Pappert D, Gerlach H, Slama Ю, Weidemann H, Frey DJM, Hoffmann O, Keske U, Falke Ю. High survival rate in 122 ARDS patients managed according to a clinical algorithm including extracorporeal membrane oxygenation. Intensive Care Med 1997; 23:819-835.
23. Rossaint R, Falke Ю, Lopez F, Slama K, Pison U, Zapol WM. Inhaled nitric oxide for the adult respiratory distress syndrome. N EnglJ Med 1993; 328:399-405.
24. Gerlach H, Rossaint R, Pappert D, Falke KJ. Time-course and dose-response of nitric oxide inhalation for systemic oxygenation and pulmonary hypertension in patients with adult respiratory distress syndrome. Eur J Clin Invest 1993; 23:499-502. .
БРОНХИАЛЬНАЯ АСТМА: КРАЙНЕ ТЯЖЕЛОЕ ТЕЧЕНИЕ
Артур Слутцки (Торонто, Канада)
Введение
Несмотря на интенсивное исследование причин, триггерных факторов астмы и препаратов для ее лечения, частота осложнений и летальность при данном заболевании продолжают оставаться высокими. Изучение случаев с летальным исходом сопряжено с определенными трудностями, поскольку многие больные умирают на догоспитальном этапе, в связи с чем бывает сложно определиться с непосредственными причинами смерти. Одним из путей изучения таких состояний является исследование больных, перенесших приступы астмы, протекавшие с прямой угрозой для жизни [1, 2]. При этом можно показать, какие процессы при подобных состояниях вовлечены и помочь в их предупреждении. В нашей статье освещены аспекты угрожающего для жизни течения бронхиальной астмы.
Определение
Были предложены разнообразные определения угрожающей жизни астмы. Turner-Warwick [3] использовал термин «нестабильная астма» для описания группы пациентов с частыми эпизодами угрожающих жизни приступов заболевания. У этих больных при пик-флоуметрии часто выявляются значительные нарушения легочной функции. Sears и Ruffin с сотр. определили «угрожающую жизни» астму как острый приступ заболевания с повышением уровня РаСО2 более 50 mmHg (6,5 kPa) и/или изменением психического состояния или остановкой дыхания. Термин «гибнущий астматик» был введен Crompton [6] с целью описания группы больных, у которых несмотря на получаемую во всем остальном адекватную терапию развивались крайне тяжелые и внезапные по своему характеру приступы заболевания.
Некоторые характерные признаки указывают, что у пациента может иметь место представляющий непосредственную угрозу для жизни эпизод астмы. Последние представлены и рассмотрены в таблице 1 [7].
Таблица 1. Распознавание угрожающего жизни приступа астмы (из [7]) Признаки потенциальной угрозы для жизни (любой из них указывает на тяжелый астматический эпизод) Нарастающие хрипы и одышка
Пациент не в состоянии произнести короткую фразу на одном вдохе или встать с кровати или стула
Частота дыхания > 25 мин~1
Частота сердечных сокращений устойчиво держится на уровне > 110 уд/мин
Пиковая скорость потока выдоха < 40% от должного или лучшее из полученных значений показателя < 200 л/мин
Парадоксальный пульс > 10 mmHg
Признаки непосредственной угрозы для жизни
(любой из нижеприведенных указывает на крайне тяжелый приступ астмы)____________________ \
«Немое легкое» при аускультации
Цианоз
Признаки истощения, возбуждения или потеря сознания
К сожалению, у некоторых пациентов крайне тяжелые приступы астмы могут развиваться и в отсутствии вышеперечисленных предвестников. В частности, Hetzel [8] исследовал более 1000 последовательных случаев госпитализации по поводу астмы и обнаружил, что на момент поступления многие в последствии тяжелейшие случаи заболевания выглядели вполне безобидно.
Wasserfallen [9] обнаружил, что группа пациентов с развившейся в последствии внезапной асфиксии имеет некоторые отличия от больных с постепенным ухудшением течения заболевания. Это позволяет предположить, что лежащие в основе представляющего угрозу для жизни ухудшения заболевания лежат различные механизмы. К основным критериям, которые могут помочь распознать больных из группы высокого риска летального исхода, относятся возраст, этническая принадлежность, наличие угрожающих жизни обострений астмы в прошлом, наличие госпитализаций в течение последнего года, неадекватная базовая терапия и отсутствие квалифицированной медицинской помощи.
Определенные физиологические данные подтверждают право на жизнь концепции, говорящей о наличии двух различных групп больных с угрожающими жизни приступами астмы. К первой группе относятся больные, отличающиеся нарушением физиологического ответа на тяжелое ограничение скорости дыхательного потока. Первая подгруппа этих больных имеет «притупление» гипоксического респираторного драйва и не отвечает гипервентиляцией на сужение просвета бронхиального дерева и/или гипоксию [11], в связи с чем могут иметь гиперкапнию даже при умеренной обструкции дыхательных путей. Вторая подгруппа пациентов отличается нарушениями восприятия (перцепции) расстройств дыхательного ритма. При этом отсутствует ощущение нарастающего ухудшения проходимости дыхательных путей, в связи с чем больные могут не принимать лекарств или не обращаться за медицинской помощью [12]. Кроме того, существует группа больных, отличающихся значительной суточной вариабельностью скорости пикового потока. Даже при повторном исследовании показатели могут быть нормальными. У этих пациентов могут развиваться внезапные смертельные приступы астмы.
Провоцирующие факторы
Больных с опасными для жизни эпизодами отличает великое множество пусковых факторов приступа. И вновь представляется возможным выделить две отдельные группы таких пациентов. В одной из них симптомы появляются более, чем за 24 часа до развертывания приступа, в то время как приблизительно в 10-15% случаев эпизод имеет острое начало и развивается менее, чем за 1 час [13].
Больные молодого возраста отличаются большей склонностью к развитию опасных для жизни эпизодов заболевания, хотя последние могут иметь место в любом возрасте и видимо не имеют какой либо зависимости от половой принадлежности. К провоцирующим факторам относят воздействие аллергенов, инфекционные процессы, дыхание загрязненным воздухом, изменения погоды, эмоциональные расстройства и прием лекарственных средств. Wasserfallen [9] обнаружил, что у большинства пациентов, потребовавших проведения ИВЛ после постепенного ухудшения респираторной функции, в качестве причинного фактора приступа выступают инфекционные процессы. В то же время, внезапная асфиксия провоцируется эмоциональными переживаниями (у 4 больных из 10) или массивной экспозицией аллергена (3 из 10). Важность аллергенного воздействия была подтверждена на основании работ O'Hollaren и сотр. [14], показавших, что все случаи остановки дыхания, происходящие на фоне ухудшения функции дыхания, возникают во время периода цветения Альтернарии. Было продемонстрировано, что прием различных лекарственных средств, включающих бета-блокаторы, аспирин и/или НСПВП, способен также провоцировать угрожающие жизни или смертельные приступы заболевания. В проведенном нами исследовании у 8% пациентов, чье состояние потребовало проведения ИВЛ, имел место прием аспирина, послуживший провоцирующим фактором тяжелого приступа [15].
Значение гиперреактивности бронхов как прогностического фактора угрожающих жизни или смертельных приступов астмы является противоречивым. В последствии у пациентов, перенесших остановку дыхания, мы обнаружили увеличение реактивности дыхательных путей, хотя подобные изменения отмечались не у всех больных. В частности, Puffin и сотр. получили противоположные результаты в группе пациентов, у которых РС20 возрастал на почти 2 двойные дозы после проведения адекватной терапии [5].
Спорно, является ли постоянное использование (32-миметиков потенциальной причиной увеличения летальности [18, 19]. Механизмы, посредством которых данные препараты вызывают ухудшение течения астмы, остаются невыясненными, но на основании анализа литературы могут быть сделаны некоторые заключения. Во-первых, большинство пациентов с опасными приступами заболевания не получают надлежащей противовоспалительной терапии. Во-вторых, (32-агонисты следует использовать по потребности, но, по-видимому, не постоянно. В-третьих, подтверждено, что ингаляционные препараты pV миметиков являются важным компонентом острых тяжелых приступов астмы.
Патофизиология
Полагают, что наиболее важными среди нарушений, лежащих в основе летальных исходов при астме, являются аритмии и/или асфиксия. Molfino и сотр. изучили механизмы, лежащие в основе тяжелых приступов астмы на примере 10 пациентов, доставленных в состоянии остановки дыхания. Больные имели глубокую гиперкапнию с РаСО2 97±31 mmHg (12,9±4,1 kPa) и тяжелый ацидоз со средним рН на уровне 7,01±0,11. У четырех пациентов выявлена гипокалиемия, но среднее содержание калия соответствовало нижней границе нормы (3,4±0,3 ммоль/л). Важно то, что несмотря на тяжелый респираторный ацидоз ни у одного из больных не отмечено значимых нарушений сердечного ритма. Следовательно, как оказалось, возникновение угрожающих жизни обстоятельств на фоне тяжелого обострения астмы у этих больных было обусловлено развитием тяжелой асфиксии, но не нарушениями сердечного ритма. Несомненно, данная группа пациентов не обладает репрезентативностью по отношению ко всем погибающим на фоне обострения астмы, однако, с учетом крайне выраженных нарушений газообмена многие из них могли умереть, если бы не были госпитализированы. В случае больных с легкими или умеренными приступами астмы обычно обнаруживаются гипоксемия и респираторный алкалоз [20]. По мере утяжеления приступа развиваются гиперкапния и респираторный ацидоз, которым может иногда сопутствовать и метаболический ацидоз. Респираторный ацидоз указывает на развитие угрожающего жизни приступа, что требует от врача немедленных действий.
У некоторых астматиков внезапная декомпенсация заболевания может быть связана с выраженным сокращением бронхиальной мускулатуры. Эта та группа больных, у которых в случае смерти не удается обнаружить слизистых пробок или отека дыхательных путей [21]. У умерших на фоне подобных осложнений больных было обнаружено возрастание максимального ответа на стимуляторы мышечного сокращения [22]. В противоположность этому, у многих пациентов на фоне status asthmaticus отмечается обильное наполнение дыхательных путей слизистыми пробками, при этом именно выраженный воспалительный процесс может служить причиной тяжелого сужения дыхательных путей. Sur и сотр. обнаружили, что у больных с продолжительностью приступа менее одного часа в дыхательных путях и подслизистом их слое больше нейтрофилов и меньше эозинофилов, чем у пациентов, умерших на фоне обострения, продолжавшегося более двух часов.
Острый приступ астмы практически всегда сопровождается гиперинфляцией легких, присутствие которой у вентилируемых пациентов может привести к возникновению внутреннего ПДКВ (auto-PEEP) [24]. Ключевыми факторами развития данного феномена являются значения минутной вентиляции, временной константы дыхательной системы и времени выдоха. Данные показатели важны у находящихся на ИВЛ больных, поскольку отсутствие адекватного контроля над ними может привести к баротравме и гемодинами-
ческим нарушениям. Даже при сохранения спонтанного дыхания перечисленные факторы могут привести к истощению и повреждению дыхательной мускулатуры.
Терапия
Предложенные в различных странах схемы начального этапа терапии различаются [7, 10, 25], однако, единогласно принято, что по возможности следует избегать ИВЛ. Следует использовать внутривенное введение высоких дозы Р^-агонистов и стероидов. Остается спорной необходимость внутривенного введения теофиллина. Если препарат все-таки применяется, необходимо принимать в расчет возможность постоянного приема препарата. Другие методы лечения включают ингаляционное применение Р2"агонистов и ипратропиума и обсуждены в других статьях [7, 10, 25]. Показаниями к ИВЛ могут служить истинная остановка дыхания, нарушения сознания, выраженное гипоксическое возбуждение или истощение. Наиболее важным моментом при этом представляется минимизация динамической гиперинфляции легких, что позволяет избежать баротравмы и ге-модинамических нарушений. Лучшим решением проблемы задержки газа в легких является использование малых дыхательных объемов, низкой частоты дыхания и высокой скорости инспираторного потока, даже если подобные параметры ИВЛ приводят к развитию гиперкапнии [26, 27]. При ИВЛ может возникать потребность в седации и применении миорелаксантов, при этом целями респираторной поддержки являются поддержание пикового давления на вдохе на уровне ниже 35 см НзО и РаО2 > 80 mmHg (10,6 kPa). Использование подобной стратегии может объяснять явное снижение летальности, наблюдаемое у больных с тяжелой астмой [16, 26]. Необходимо тщательное наблюдение за перенесшими угрожающее жизни обострение астмы пациентами после их выписки. Программы, направленные на быструю госпитализацию подобных больных в специализированные блоки интенсивной терапии [28], по-видимому, также снижают летальность. После выписки пациенты должны быть обеспечены достаточным количеством средств ингаляционной терапии, регулярно мониторировать свое состояние с помощью пикфлоумет-рии и иметь возможность постоянного контакта с медицинским персоналом.
Заключение
Ключевым моментом является распознавание пациентов, склонных к развитию приступов астмы, представляющих опасность для жизни. Преобладающая патофизиологическая причина тяжелых обострений является тяжелая обструкция дыхательных путей, ведущая к остановке дыхания и коматозному состоянию. Неспособность пациента и/или лечащего врача распознать тяжесть обострения астмы является главной причиной развития угрожающих жизни ситуаций и даже летального исхода. Врачи должны знать провоцирующие факторы заболевания, уметь выявлять пациентов группы риска и надлежащим образом владеть методами интенсивной терапии.
Литература
1. Molfino NA, SlutskyAS. Near-fatal asthma. Eur. Respir. J1994; 7(5): 981-90.
2. McFadden ER Jr. Fatal and near-fatal asthma [editorial; comment]. N. Engl. J Med. 1991; 324(6): 409-11.
3. Turner-Warwick M. On observing patterns of airflow obstruction in chronic asthma. Br. J Dis. Chest 1977; 71(2): 73-86.
4. Sears MR, Rea HH, Beaglehole R, Gillies A3, Hoist PE, O'Donnell TV, Rothwell RP, Sutherland DC. Asthma mortality in New Zealand: a two year national study. N. Z. Med. J1985; 98(777): 271-5.
5. Ruffin RE, Latimer KM, Schembri DA. Longitudinal study of near fatal asthma. Chest 1991; 99(1): 77-83.
6. Crompton G. The catastrophic asthmatic. Br. J Dis. Chest 1987; 81(4): 321-5.
7. Guidelines for management of asthma in adults: II - Acute severe asthma. Statement by the British Thoracic Society, Research Unit of the Royal College of Physicians of London, King's Fund Centre, National Asthma Campaign [published erratum appears in BMJ1990 Dec 1; 301(6763): 1272] [see comments]. BMJ. 1990; 301(6755): 797-800.
8. Hetzel MR, Clark TJ, Branthwaite MA. Asthma: analysis of sudden deaths and ventilatory arrests in hospital. Br. Med. J1977; 1(6064): 808-11.
9. Wasserfallen JB, Schaller MD, Feihl F, Perret CH. Sudden asphyxic asthma: a distinct entity? Am. Rev. Respir. Dis. 1990; 142(1): 108-11.
10. Guidelines for the diagnosis and management of asthma. National Heart, Lung, and Blood Institute. National Asthma Education Program. Expert Panel Report. J Allergy Oin. Immunol. 1991; 88(3 Pt 2): 425-534.
11. RubinfeldAR, Pain MC. Perception of asthma. Lancet 1976; 1(7965): 882-4.
12. Hudge/ DW, Weil JV. Asthma associated with decreased hypoxic ventilatory drive. A family study. Ann. Intern. Med. 1974; 80(5): 623-5.
13. Arnold AC, Lane DJ, Zapata E. The speed of onset and severity of acute severe asthma. Br. J Dis. Chest 1982; 76(2): 157-63.
14. O'Hollaren MT, YungingerJW, Offord KP, Somers MJ, O'Connell EJ, Bal/ard DJ, Sachs MI. Exposure to an aeroallergen as a possible precipitating factor in respiratory arrest in young patients with asthma [see comments]. N. Engl. J Med. 1991; 324(6): 359-63.
15. Picado C, Castillo JA, Montserrat JM, Agusti-Vidal A. Aspirin-intolerance as a precipitating factor of life-threatening attacks of asthma requiring mechanical ventilation. Eur. Respir. J1989; 2(2): 127-9.
16. Molfino NA, Nannini U, Martelli AN, Slutsky AS. Respiratory arrest in near-fatal asthma [see comments]. N. Engl. J Med. 1991; 324(5): 285-8.
17. Molfino N A, Nannini U, RebuckAS, Slutsky AS. The fatality-prone asthmatic patient. Follow-up study after near-fatal attacks. Chest 1992; 101(3): 621 -3.
18. Sears MR, Taylor DR, Print CG, Lake DC, Li QQ, Planner/ EM, Yates DM, Lucas MK, Herb/son GP. Regular inhaled beta-agonist treatment in bronchia/ asthma [see comments]. Lancet 1990; 336(8728): 1391-6.
19. Spitzer WO, Suissa S, Ernst P, Horw/t? RI, Habbick B, Cockcroft D, Boivin JF, McNutt M, Buist AS, Rebuck AS. The use of beta-agonists and the risk of death and near death from asthma [see comments]. N. Engl. J Med. 1992; 326(8): 501-6.
20. McFadden ER Jr, Lyons HA. Arterial-blood gas tension in asthma. N.Engl.J Med. 1968; 278(19): 1027-32.
21. Hogg JC. Varieties of airway narrowing in severe and fatal asthma. J Allergy Clin. Immunol. 1987; 80(3 Pt 2): 417-9.
22. Bai TR. Abnormalities in airway smooth muscle in fatal asthma. Am. Rev. Respir. Dis. 1990; 141(3): 552-7.
23. SurS, HuntLW, Crotty ТВ, Gleich GJ. Sudden-onset fatal asthma [editorial]. Mayo Clin. Proc. 1994; 69(5): 495-6.
24. Pepe PE, Marini JJ. Occult positive end-expiratory pressure in mechanically ventilated patients with airflow obstruction: the auto-PEEP effect. Am. Rev. Respir. Dis. 1982; 126(1): 166-70.
25. International consensus report on diagnosis and treatment of asthma. National Heart, Lung, and Blood Institute, National Institutes of Health. Bethesda, Maryland 20892. Publication no. 92-3091, March 1992 [see comments]. Eur. Respir. J1992; 5(5): 601-41.
26. Darioli R, Perret C. Mechanical controlled hypoventilation in status asthmaticus. Am. Rev. Respir. Dis. 1984; 129(3): 385-7.
27. Tuxen DV, Lane S. The effects of ventilatory pattern on hyperinflation, airway pressures, and circulation in mechanical ventilation of patients with severe air-flow obstruction. Am. Rev. Respir. Dis. 1987; 136(4): 872-9.
28. Crompton GK, Grant IW, Chapman BJ, Thomson A, McDonald CF. Edinburgh Emergency Asthma Admission Service: report on 15 years' experience. Eur. J Respir. Dis. 1987; 70(5): 266-71
ВЕНТИЛЯТОР-АССОЦИИРОВАННОЕ ПОВРЕЖДЕНИЕ ЛЕГКИХ: ВЛИЯНИЕ ВЕНТИЛЯТОРА, ПЕРФУЗИИ И ПОЛОЖЕНИЯ
Алан Броккард (Лозанна, Швейцария)
Введение
Механическая вентиляция легких (ИВЛ) используется много лет с целью поддержки дыхания пациента при острой дыхательной недостаточности. И хотя ИВЛ спасла много жизней, она может сама по себе повреждать легкие. В экспериментах было показано, что повреждение легких при ИВЛ не сходно с изменениями на фоне острого респираторного дистресс синдрома (1,2). Данные, полученные в моделях на животных, привели к стратегически новым направлениям использования ИВЛ, которые были проверены в клинических исследованиях и показали, что исходы заболеваний критических больных зависят в значительной мере от применения ИВЛ (3,4). Это были первые крупные рандомизированные исследования, подтвердившие лечебный эффект ИВЛ при РДСВ. С тех пор подобные исследования стали широко проводиться на концепции экспериментальных моделей вентилятор-ассоциированных повреждений легких (ВАПЛ). Отмечено, что получаемые в эксперименте результаты сходны с клиническими данными. В нашем обзоре даны современные представления о влиянии вентилятора, перфузии и положения на ВАПЛ.
Повреждения легких, вызванные механической вентиляцией
Подобные поражения легких включают утечку воздуха (баротравма) и некардиогенный отек легких, характеризующийся диффузным поражением альвеол (травма эпителия и эндотелия) (2). Последнее при ВАПЛ может быть вызвано избыточным давлением в конце вдоха (волюмотравма) и/или повторяющимся коллапс/открытие нарушением проходимости дистальных отделов дыхательных путей (ателектравма). Такой механический стресс может провоцировать патологические изменения на молекулярном уровне, что приводит к повышению концентрации цитокинов в легких и системном кровотоке (биотравма), усиливая повреждение легких и способствуя развитию полиорганной недостаточности.
Баротравма
Она характеризуется утечкой воздуха в ткани или пространства вокруг дыхательных путей или альвеол. Это может привести как к подкожной, так и к интерстициальной эмфиземе легких, стать причиной появления воздуха в плевральной полости, средостении, перикарде, забрюшинном пространстве и, наконец, к воздушной эмболии. Баротравма обычно развивается на фоне ИВЛ с использованием положительного давления, которое приводит к появлению избыточного градиента давлений в дистальных дыхательных путях и окружающей интерстициальной ткани. Однако в недавних исследованиях (5) не удалось обнаружить корреляции между давлением в конце выдоха (ПДКВ), пикового и давления плато, дыхательного объема, комплайнса системы дыхания и частотой возникновения баротравмы. Во все это мы охотно верим только потому, что все перечисленные факторы сравнения использовались без учета величины экстрамурального (интерстициально-го) давления и влияния значительного механического стресса на емкость поддерживающих легкие структур. Заболевания легких (такие, как РДСВ), проявляющиеся острой дыхательной недостаточностью, имеют очень высокий риск развития баротравмы (6). Это, вероятно, обусловлено тяжестью дыхательной недостаточности, которая требует повышенного давления в дыхательных путях для поддержания адекватной оксигенации, а также снижением объема дыхательных путей, чтобы противостоять значительному механическому сдавлению (например, при массивной пневмонии).
Волюмотравма
В эксперименте доказано, что избыточный дыхательный объем и транспульмональное давление, которое противостоит пиковому давлению в дыхательных путях, могут привести к перенапряжению легочной ткани (7) и повышению ее проницаемости (некардиоген-ный отек легких). Определить избыточный дыхательный объем относительно легочных объемов пациента при проведении вентиляции несложно. У здоровых людей легочные объемы зависят от размеров тела. У пациентов с РДСВ объем легочной ткани, получающий дыхательный объем, может быть значительно снижен в силу отека или регионарного коллапса легких («легкие ребенка») (8). Существуют методики вентиляции, при которых оценивается соотношение задаваемого дыхательного объема со степенью перерастяжения легочной ткани, хотя они несовершенны. В силу того, что транспульмональное давление изменяется параллельно с размером объема альвеол, верхняя граница транспуль-монального давления (альвеолярное минус плевральное) отражает степень перенапряжения альвеол. Чтобы определить максимальное альвеолярное давление на фоне механической вентиляции, пользуются инспираторной паузой в 3-5 секунд (давление плато). Плевральное давление измеряется пищеводным балонным способом, однако он не всегда доступен. К тому же давление в пищеводе не всегда достоверно отражает плевральное в положении пациента лежа на спине. Однако без этой методики определить плевральное давление невозможно. Основываясь на параметрах нормальной физиологии дыхания, давление плато, составляющее не более 25 см Ь^О, нельзя ассоциировать с перерастяжением альвеол. В мультицентровом исследовании у пациентов с РДСВ при проведении профилактической вентиляции легких (низкий дыхательный объем) среднее давление плато составило 25 см НгО (4). Хотя плевральное давление измерить непросто, несмотря на это можно учитывать, что изменения его при заданном дыхательном объеме зависит от комплайнса грудной клетки. Например, при низком комплайнсе грудной клетки будет снижаться пиковое транспульмональное давление (и таким образом, степень растяжения альвеол), связанное с заданным пиковым альвеолярным давлением (давлением плато) во время ИВЛ. Чтобы точно оценить риск возникновения баротравмы при заданном давлении плато, необходимо учитывать комплайнс грудной клетки и внутри-брюшное давление. Несмотря на то, что при некоторых обстоятельствах комплайнс грудной клетки может быть значительно снижен (ожирение, увеличенный в размерах живот) дыхательный объем должен устанавливаться с таким расчетом, чтобы давление плато не превышало 25 см Н20. Таким путем можно снизить риск перерастяжения альвеол. Некоторые исследователи используют для построения кривой псевдостатическое давление/объем, чтобы определить перерастяжение альвеол. Такой подход является спорным и не всегда доступен в обычной практике (9).
Ателектравма
Этот вид поражения легких подразумевает открытие и закрытие участков легких, особенно в зависимых отделах. Раскрытие захлопнутых бронхиол теоретически является причиной «синдрома ножниц», который может привести к повреждению эпителиальной поверхности. Утверждение, что ИВЛ с низким давлением в конце выдоха имеет неблагоприятное повреждающее влияние на легкие, появилось в результате сравнения данных исследований традиционной ИВЛ (без или с низким ПДКВ) с ИВЛ с высоким ПДКВ (10,11) или ИВЛ с высокочастотной характеристикой (ВЧИВЛ) (12). Концепция открытия и коллабирования альвеол в целом принимается, но остается несколько нерешенных вопросов. Например, при поражении легких жирными кислотами в зависимых зонах не происходит коллабирования альвеол несмотря на тяжелое поражение, вероятно, за счет отека, при котором альвеолы наполняются жидкостью (13). В ситуации с точно контролируемой гемодинамикой (модель изолированно перфузируемых легких) использование ПДКВ с целью поддержания альвеол открытыми и/или ограничения дыхательных экскурсий не имеет профилактического значения (14). Несмотря на то, что сохраняется много спорных вопросов, концепция поддержания легких открытыми несет положительный им-
пульс к внедрению новых методик ИВЛ (3) и вдохновляет клинических исследователей. Безопасные методики (по крайней мере, используемые в последнее время) у некоторых пациентов приводят к улучшению газообмена (15). Насколько изменяются при этом исходы заболеваний, остается неясным. Другим аспектом ИВЛ, который может привести к повреждению легких, является частота, с которой доставляется дыхательный объем (16).
Биотравма
Механический стресс легких может стать причиной воспаления с активацией нейтро-филов и усиленной продукцией различных цитокинов (17,18). Такая реакция способствует дальнейшему повреждению легких и запускает системный воспалительный ответ и полиорганную недостаточность (19). Недостаточно ясно на какой стадии такая ответная реакция может служить маркером тяжести ВАПЛ или ключевым элементом повреждающего процесса в целом. Подобные ответные реакции оцениваются и в клинических ситуациях (20).
ВАПЛ и гемодинамика в легких
Повреждение легких за счет вентилятора - это состояние, которое является следствием использования избыточного дыхательного объема и/или перемежающегося открытия и коллабирования дыхательных путей. Состояние гемодинамики может также влиять на ВАПЛ.
Например, некоторые профилактические эффекты ПДКВ могут в некоторой степени влиять на состояние системной гемодинамики (21). West и колл. отметили, что взаимодействие дыхательного объема и гидростатического интрамурального капиллярного давления в совокупности могут стать причиной эпителиального и эндотелиального повреждения (22). В изолированном перфузированном легком кролика такие факторы, как интенсивность кровотока (14) и среднее давление в дыхательных путях (23) способствуют развитию ВАПЛ. Эти факторы приводят к повышению внутрисосудистого давления за счет ускорения кровотока в сосудах, диаметр которых сужается на фоне увеличенных легочных объемов и среднего давления в дыхательных путях. Это предполагает, что пациенты на ИВЛ имеют высокий риск развития ВАПЛ в зависимости от гемодинамики, а также то, что лечебные режимы ИВЛ могут стать несостоятельными из-за связанных с ними нарушений гемодинамики.
Положение пациента и ВАПЛ
Оксигенация улучшается в положении пациента на животе примерно у 2/3 всех больных с РДСВ. Такая методика проведения ИВЛ уменьшает риск развития ВАПЛ у здоровых собак (23) и с легкими, пораженными жирными кислотами (24). Существуют значительные различия между положением на спине и животе. В положении пациента на животе жидкость дыхательных путей дренируется в направлении проксимальных отделов дыхательных путей, а в положении на спине - в дорзальном направлении. В положении на животе плевральное давление относительно однородно в вертикальном направлении и более отрицательное в зависимых зонах. Это позволяет легче раскрывать закрытые альвеолы зависимых зон и удерживать их в таком состоянии, то есть ограничивать их вентиляцию в режиме открытия/коллапса, способствовать более равномерному распределению вентиляции, что значительно снижает вероятность ВАПЛ. И, наконец, в положении на животе кровоток более однородно распределяется между зависимыми и непораженными участками легких. При ВАПЛ такое потенциально благоприятное влияние положения на животе на перфузию в легких способствует уменьшению регионарного сосудистого стресса у пациентов на ИВЛ. Клинических данных о том, что использование положения на животе изменяет результаты лечения пациентов, еще нет. В недавно завершенном, но еще не опубликованном мультицентровом итальянском исследовании сообщается, что у 2000 пациентов при использовании ИВЛ в положении на животе показатель ле-
18 Зак. 1581
тальности не снизился, однако показатель летальности в ранние сроки у пациентов на ИВЛ с использованием увеличенного дыхательного объема достоверно улучшился.
Клинические исследования
Большинство данных по ВАПЛ получено на экспериментальных моделях. Экстраполяция их на пациентов - очень важная проблема. В пяти исследованиях проверялась гипотеза, что влияние ИВЛ ухудшает результаты лечения. В трех исследованиях получены негативные результаты, в двух - исходы улучшились, причем у тех пациентов, которые вентилировались небольшими дыхательными объемами. В самом крупном клиническом исследовании (4) при использовании ИВЛ на основе малых дыхательных объемов леталь-
. ность снизилась на 25%. В других позитивных работах использование небольшого дыхательного объема заставляло применять дополнительные режимы вентиляции, а ПДКВ при этом требовалось чаще, чем в группах с традиционной ИВЛ. Летальность в ранние сроки и частота возникновения баротравмы отмечена реже (3). Наиболее ярким отличием двух последних позитивных исследований и трех негативных (25-27) является использование разных дыхательных объемов при сравнении групп: в двух позитивных - 6 и 12мл/кг, а в негативных - 7 и 10 мл/кг. Ключевым положением является то, что избыточный дыхательный объем (например, 12 мл/кг) при ИВЛ у пациентов с РДСВ является вредным. Основываясь на результатах мультицентрового исследования терапии РДСВ высказано предположение, что наиболее оптимальным дыхательным объемом при ИВЛ таких пациентов является 6 мл/кг идеальной массы тела. Это предложение не следует
, считать полностью обоснованным. Единственным достоверным в приведенных выше исследованиях моментом является то, что избыточный дыхательный объем при ИВЛ паци-
u ентов с РДСВ является вредным, а 6 мл/кг идеальной массы тела - идеальным. Мы же устанавливаем дыхательный объем так, чтобы давление плато не превышало 25 см Н2<Э. Такой уровень давления достигался при использовании малых дыхательных объемов в мультицентровом исследовании терапии пациентов с РДСВ. Мы убеждены, что подбор дыхательного объема по давлению плато более физиологичен, чем по расчету его на массу тела, при этом следует принимать во внимание и степень тяжести заболевания легких.
Заключение
Современные клинические данные и результаты многочисленных экспериментальных работ на животных указывают на то, что ВАПЛ - реальная клиническая проблема. Профилактика его развития - очень важный вопрос интенсивной терапии, который требует тщательного подбора дыхательного объема, чтобы избежать перерастяжения альвеол. В современных исследованиях проводится поиск оптимального уровня ПДКВ как вспомогательного режима ИВЛ, а также определяется роль положения пациента на животе во время механической вентиляции. Есть еще два важных фактора, которые влияют на возникновение ВАПЛ - это частота дыхания при ИВЛ с ПДКВ и состояние легочного кровотока.
Литература
1. Dreyfuss D, Saumon G. Ventilator-induced lung injury: lessons from experimental studies. Am J Respir Crit Care Med 1998; 157:294-323.
2. SlutskyAS. Lung injury caused by mechanical ventilation. Chest 1999; 116:95-155.
3. Amato MB, Barbas CS, Medeiros DM, Maga/di RB, Schettino GP, Lorenzi-Filho G et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N EnglJ Med 1998; 338:347-354.
4. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N EnglJ Med 2000; 342:1301-1308.
5. Weg JG, Anzueto A, Balk RA, Wiedemann HP, Pattishall EN, Schork MA et al. The relation of pneumothorax and other air leaks to mortality in the acute respiratory distress syndrome. N EnglJ Med 1998; 338:341-346.
6. Gammon RB, Shin MS, Groves RH, Jr., Hardin JM, Hsu C, Buchalter SE. Clinical risk factors for pulmonary barotrauma: a multivariate analysis. Am J Respir Crit Care Med 1995; 152:1235-1240.
7. Dreyfuss D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure. Am Rev Respir Dis 1988; 137:1159-1164.
8. Gaftinoni L, Pesenti A, Avalli L, Rossi F, Bomb/no M. Pressure-volume curve of total respiratory system in acute respiratory failure. Computed tomographic scan study. Am Rev Respir Dis 1987; 136:730-736.
9. Hick/ing KG. The pressure-volume curve is greatly modified by recruftment. A mathematical model of ARDS lungs. Am 3 Respir Crit Care Med 1998; 158:194-202.
10. Corbridge TC, Hall JB. The assessment and management of adults with status asthmaticus. Am J Respir Crit Care Med 1995; 151:1296-1316.
11. Muscedere JG, Mullen JB, Can K, Slutsky AS. Tidal ventilation at low airway pressures can augment lung injury. Am J Respir Crit Care Med 1994; 149:1327-1334.
12. McCulloch PR, Forkert PC, Froese AB. Lung volume maintenance prevents lung injury during high frequency oscillatory ventilation in surfactant-deficient rabbits. Am Rev Respir Dis 1988; 137:1185-1192.
13. Martynowicz MA, Minor ТА, Walters BJ, Hubmayr RD. Regional Expansion of Oleic Acid-Injured Lungs. Am J Respir Crit Care Med 1999; 160:250-258.
14. Brpccard AF, Hotchkiss JR, Suzuki S, Olson D, Marini JJ. Effects of mean airway pressure and tidal excursion on lung injury induced by mechanical ventilation in an isolated perfused rabbit lung model. Crit Care Med 1999; 27:1533-1541.
15. Lapinsky SE, Aubin M, Mehta S, Boiteau P, Slutsky AS. Safety and efficacy of a sustained inflation for alveolar recruitment in adults with respiratory failure. Intensive Care Med 1999; 25:1297-1301.
16. Hotchkiss JR, Blanch L, Murias G, Adams AB, Olson DA, Wangensteen OD eta/. Effects of Decreased Respiratory Frequency on Ventilator-induced Lung Injury. Am J Respir Crit Care Med 2000; 161:463-468.
17. Imai Y, Kawano T, Miyasaka K, Takata M, Imai T, Okuyama K. Inflammatory chemical mediators during conventional ventilation and during high frequency oscillatory ventilation. Am J Respir Crit Care Med 1994; 150:1550-1554.
18. Tremblay L, Valenza F, Ribeiro SP, Li J, Slutsky AS. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J С/от Invest 1997; 99:944-952.
19. Slutsky AS, Tremblay LN. Multiple system organ failure. Is mechanical ventilation a contributing factor? Am J Respir Crit Care Med 1998; 157:1721-1725.
20. Ranieri VM, Suter PM, Tortorella C, De Tullio R, DayerJM, Brienza A et a/. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA 1999; 282:54-61.
21. Dreyfuss D, Saumon G. Role of tidal volume, FRC, and end-inspirator/ volume in the development of pulmonary edema following mechanical ventilation. Am Rev Respir Dis 1993; 148:1194-1203.
22. Fu Z, Costello ML, Tsukimoto K, Prediletto R, Elliott AR, Mathieu-Costello О et al. High lung volume increases stress failure in pulmonary capillaries. J Appl Physio/1992; 73:123-133.
23. BroccardAF, Hotchkiss JR, Kuwayama N, Olson DA, Jama/ S, Wangensteen DO et al. Consequences of vascular flow on lung injury induced by mechanical ventilation. Am J Respir Crit Care Med 1998; 157:1935-1942.
24. Broccard A, Shapiro RS, Schmitz LL, Adams AB, Nahum A, Marini JJ. Prone positioning attenuates and redistributes ventilator-induced lung injury in dogs. Crit Care Med 2000; 28:295-303.
25. Brower RG, Shanholtz CB, Fessler HE, Shade DM, White P, Jr., Wiener CM et al. Prospective, randomized, controlled clinical trial comparing traditional versus reduced tidal volume ventilation in acute respiratory distress syndrome patients. Crit Care Med 1999; 27:1492-1498.
26. Brochard L, Roudot-Thoraval F, Roupie E, Delclaux C, Chastre J, Fernandez-Mondejar E et al. Tidal volume reduction for prevention of ventilator-induced lung injury in acute respiratory distress syndrome. The Multicenter Trail Group on Tidal Volume reduction in ARDS. Am J Respir Crit Care Med 1998; 158:1831-1838.
27. Stewart ТЕ, Meade MO, Cook DJ, Granton JT, Hodder RV, Lapinsky SE et al. Evaluation of a ventilation strategy to prevent barotrauma in patients at high risk for acute respiratory distress syndrome. Pressure- and Volume-Limited Ventilation Strategy Group. N EnglJ Med 1998; 338:355-361.
ГАЗООБМЕН ПРИ ОСТРОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ
Горам Хеденстриерна (Уппсала, Швеция)
Введение
Острая дыхательная недостаточность (ОДН) и острый респираторный дистресс взрослых (РДСВ) представляют собой клинические синдромы, для которых характерна двусторонняя инфильтрация легких и тяжелое нарушение оксигенации артериальной крови. При ОДН соотношение парциального напряжения кислорода в артериальной крови (РаО2 в мм.рт.ст.) к фракции кислорода во вдыхаемой смеси (FiOa) менее 200, а при РДСВ - менее 150 (1). Летальность остается высокой и достигает 40% как при ОДН, так и при РДСВ (2). Удивительно, что при этих двух состояниях она одинакова. Однако основной причиной смерти при ОДН и при РДСВ является не артериальная гипоксемия. Ишемия тканей приводит к дисфункции органов и создает предпосылки воспаления. Врачи прикладывают массу усилий, чтобы улучшить газообмен, а варианты режимов искусственной вентиляции легких, которые они используют, могут привести к поражению легочной ткани и стимулировать выброс медиаторов воспаления, что в свою очередь приведет к поражению других органов. Если это так, то в интенсивной терапии этих состояний необходимо придерживаться баланса между достаточным газообменом и сокращением риска механического повреждения легочной ткани.
В нашей лекции рассматриваются вопросы неоднородности структуры поражения легких и неравномерности нарушений вентиляции и кровотока, а в разделе методики венти-* ляции - вопросы улучшения газообмена и уменьшение риска механического повреждения легочной ткани.
Распространение патологического процесса
Для ОДН и РДСВ характерно наличие легочных инфильтратов за счет выхода из сосудов жидкости, богатой белками. Образуется отек легочной ткани, который позже трансформируется в фиброз. Инфильтраты при рентгенологическом исследовании выглядят как очаги повышенной плотности. При компьютерной томографии (КТ) обнаруживается, что жидкость скапливается в зависимых отделах, указывая на влияние силы тяжести (3). В очагах уплотнения заметны участки разряжения в виде буквы О (зоны Хаунсфильда -ЗХ), указывающие на отсутствие в них воздуха. По степени плотности очаги уплотнения сходны с участками ателектазирования во время анестезии, но количество их значительно больше. Например, при РДСВ у пациентов на КТ 70-80% легочной ткани уплотнено по сравнению с 4-8% у здоровых лиц во время анестезии. Верхушечные отделы меньше вовлекаются в процесс уплотнения легочной ткани, чем прикорневые или базальные сегменты. Правая и левая нижние доли могут быть несколько уменьшены в объеме и безвоздушны за счет приподнятой повышенным внутрибрюшным давлением диафрагмы (4).
Распределение вентиляции
У здоровых людей при спонтанном дыхании вентиляция увеличивается при распространении в сторону нижних отделов легких, поэтому в положении на спине дорзальные отделы лучше вентилируются, чем вентральные. Анестетики и миорелаксанты нарушают этот процесс распределения вентиляции, которая становится больше в вентральных и средних отделах, а в ниже расположенных отделах легких вентиляция практически отсутствует (5). Морфологически это можно сравнить с ситуацией, обусловленной развитием ателектазов в задне-базальных (невентилируемых) отделов и закрытием дыхательных путей, расположенных выше коллабированной зоны легкого (6). Закрытие дыхательных путей будет снижать вентиляцию в перемежающемся режиме, когда закрытие происходит во время выдоха, а открытие - на фоне вдоха. Если закрытие становится постоян-
ным, то вентиляция прекращается и участок легочной паренхимы коллабируется, усиливая уже имеющийся ателектаз. Скорость коллабирования зависит от фракции кислорода в закрытой зоне (7). Если человек перед закрытием дыхательных путей дышал воздухом, то для развития каллапса соответствующей зоны легкого потребуются часы, а если проводилась преоксигенация - минуты (8). При ОДН и РДСВ вентиляция также больше сохраняется в области верхушек легких, так как в других отделах уплотнение ткани, так же как и коллабирование, прекращают ее (3). Пока нет данных о том, как сила тяжести влияет на распространение вентиляции в краниально-каудальном направлении по сравнению с непораженными легкими. Скорее всего вентиляция направлена в сторону верхушек, так как коллапс и уплотнение легочной ткани образуются в области базальных отделов легких, близ диафрагмы (4).
Распределение перфузии
Очень мало исследований посвящено изучению кровотока в легких у пациентов с РДСВ. У здоровых людей при спонтанном дыхании перфузия увеличивается в области нижних отделов легких, то есть отличается от более верхних в сторону ниже расположенных участков ткани в силу действия силы тяжести (9). Однако существуют отделы, в которых кровоток отличается при одинаковой гравитации, а иногда даже выше, несмотря на большую силу тяжести (10). Механизм таких нарушений еще недостаточно изучен. Положительное давление вентиляции может препятствовать венозному возврату и току крови через ткань легкого, что приводит к снижению сердечного выброса. Кровоток, таким образом, устремляется в сторону зависимых зон, особенно, если используется положительное давление в конце вдоха (ПДКВ) (9). Особенно нежелательно использовать такой режим вентиляции при наличии коллабирования и уплотнения легочной ткани в этих зависимых зонах, так как это увеличивает в них перфузию. С другой стороны, ПДКВ способно уменьшить объем соответствующих «патологических отделов», вовлекая их в работу. Влияние ПДКВ на перфузию в этих невентилируемых зонах (то есть шунтируемых) в основном благоприятно, хотя не во всех случаях. Например, если доля коллабированных участков достигает 60%, а шунт составляет всего 30%, можно сказать, что невентилируемые участки легких недостаточно перфузируются. Это обусловлено гипоксической легочной вазоконстрикцией и, возможно, механическим сдавлением сосудов в коллабированных зонах. В экспериментальной модели отека легкого из-за жирных кислот участки пораженной ткани хуже перфузируются, чем в начале отека (11).
При РДСВ часто развивается легочная гипертензия (3). При оценке давления в легочной артерии и КТ данных отмечается значительная корреляция между средним давлением в легочной артерии и массой легких (3). Причины такой взаимосвязи остаются неясными. Повышенное давление в легочной артерии усиливает отек легких, что повышает их массу. С другой стороны отек ткани повышает давление в артериях за счет их сдавления. Тем не менее, в любом случае, повышение артериального легочного давления в среднем на 1 мм.рт.ст. увеличивает массу легких на 14% (3).
Газообмен
Нарушение газообмена (нарушение артериальной оксигенации и примешивание венозной крови «шунт») напрямую зависит от выраженности патологического процесса, то есть массивности невентилируемых тканей (3). Это доказывает, что шунт (то есть перфузия невентилируемых зон) является главной причиной гипоксемии у пациентов с РДСВ. Такая зависимость между объемом неаэрируемых тканей и венозным примешиванием должна быть использована. Однако по венозному примешиванию нельзя установить истинный шунт (перфузия осуществляется в невентилируемых, ателектазированных и инфильтрированных тканях) в тех зонах, которые относительно плохо вентилируются по сравнению с их перфузией, то есть, в которых низкое вентиляционно-перфузионное соотношение (В/П). В исследованиях с использованием инертных газов с целью уточнения степени распределения В/П главной находкой оказался высокий шунт, который колебал-
ся от 20 до 70% величины сердечного выброса (СВ) (12). Таким образом, это подтвердило положение, что невентилируемые зоны легкого играют доминирующую роль в развитии гипоксемии при РДСВ. У некоторых пациентов наблюдается избыточная перфузия в участках с низким В/П, но в основном преобладают другие нарушения. Это удивительно, так как снижение легочных объемов при РДСВ приводит к сужению дыхательных путей и их закрытию, поэтому можно сразу же полагать, что именно это приводит к нарастанию сопротивления вентиляции и созданию участков с «низким В/П». Существуют и другие факторы. Во-первых, альвеолы менее стабильны, чем в норме, и коллабируются быстрее при уменьшении своих размеров, то есть при меньшей вентиляции. Во-вторых, вентилируемые отделы не увеличиваются в размерах и диаметр дыхательных путей не уменьшается.
Методы улучшения газообмена
Используется много методик искусственной вентиляции легких (ИВЛ) с целью улучшения газообмена у пациентов с РДСВ и в экспериментальных исследованиях. В лекции автор попытается продемонстрировать влияние некоторых из них на процесс распределения вентиляции, газообмен и на легкие в целом.
ПДКВ - часто используемый вариант проведения ИВЛ с целью улучшения оксигенации крови. Повышенное давление увеличивает легочные объемы и может привести к раскрытию коллабированных участков легочной ткани. За счет этого получают улучшение окси-„ генации крови. Однако дополнительное повышение внутригрудного давления снижает сердечный выброс и, как следствие, легочной кровоток стремится к снижению (9). Такое , повышение перфузии в локальных ателектазированных зонах приводит даже к увеличению шунта (6)! .*
ПДКВ может вызвать перерастяжение альвеол и их разрыв, называемый баротравмой.
В основном это случается в верхних долях, так как они более воздушны. Однако, кажется, что при РДСВ вероятность ее возникновения в нижних долях больше (13). Развивается так называемый «синдром ножниц», то есть открытие и закрытие участков легочной ткани при каждом вдохе (14). Недавно в экспериментальных исследованиях на животных была доказана цикличность коллапса открытия альвеол в зависимых зонах легкого (15). Если это и есть механизм баротравмы, то ПДКВ способно предотвращать подобный перемежающийся коллапс пораженных тканей.
Первые сообщения по использованию ИВЛ с изменением соотношения вдох/выдох от нормального 1:2 в сторону 2:1 и до 4:1 (вентиляция с инверсией соотношения вдох/выдох, IRV) с целью улучшения оксигенации отражали негативные результаты (16). IRV обычно сочетается с ИВЛ, контролируемой по давлению, которая быстро повышает давление в дыхательных путях и имеет высокую скорость вдуваемого потока. Считалось, что такое быстрое повышение скорости потока будет открывать выключенные из вентиляции альвеолы, а удлинение времени вдоха вовлечет их в процесс газообмена. Хотя это наиболее понятное описание механизма IRV, тем не менее основной эффект базируется на укорочении выдоха. Это создает внутреннее ПДКВ, которое и поддерживает альвеолы открытыми. Мы сравнили традиционную принудительную вентиляцию (CMV) с ПДКВ и IRV с ПДКВ на одинаковых цифрах и не обнаружили преимуществ IRV (17). На фоне последней удлинялось время аэрации легочной ткани за счет укорочения выдоха, что поддерживало наиболее коллабированные участки открытыми более длительно, чем на фоне CMV. Однако в экспериментальных работах получены обратные результаты. Выше расположенные открывающиеся ИВЛ участки становились более аэрированы при IRV, а ниже расположенные лучше растягивались при CMV (уровень внешнего ПДКВ при CMV и внутреннего IRV был практически одинаков: 20 и 17 см Н2О, соответственно) (18). Исследование легочного кровотока с использованием радиоактивных изотопов не выявило отличий при CMV и IRV, но шунтирование крови, оцененное с использованием инертных газов, было больше при IRV. Таким образом, полученные данные указывают на лучшую аэрацию и растяжение альвеол при CMV.
Существуют ли вспомогательные методики вентиляции при спонтанном дыхании на фоне тяжелого поражения легких? Вентиляция с поддержкой давлением (ВПД) не исключает возможности самостоятельного дыхания, начиная с установленного предварительно положительного давления в дыхательных путях, которое несколько увеличивается на вдохе и возвращается с исходному на выдохе. Putensen и соавт. отмечали лучшую оксигена-цию крови у экспериментальных животных при ВПД в сочетании с поддержкой давлением в пределах 10% от дыхательного объема (этот режим называется также BIPAP - вентиляция с поддержкой давлением в двух фазах) по сравнению с обычной механической вентиляцией (19,20). Предварительные данные нашего экспериментального исследования показывают дозозависимое улучшение оксигенации с увеличением фракции спонтанного дыхания. Более того, у животных, которые дышат самостоятельно (в пределах 50-100% от общей вентиляции), давление в легочной артерии ниже, а РаС>2 становится выше, чем исходное через 6 часов от начала острого поражения легких. Однако, с другой стороны, экспериментальные свиньи, находившиеся во время исследования на CMV, не выздоравливали. Хотя эти данные предварительные, тем не менее, можно предполагать, что по сравнению с CMV спонтанное дыхание и его поддержка в режиме BIPAP способствует нормализации состояния легких. ,
Заключение
Острая дыхательная недостаточность характеризуется отеком легочной ткани и фиброзом, ателектазами и уплотнением пораженных, чаще нижних зон легочной ткани и реже верхних отделов. Этот процесс нарушает распределение вдыхаемого воздуха: исключается вентиляция зависимых участков, а в верхних развивается повышенная воздуш-HOctV. Кровоток умеренно снижается в коллабированных зонах, приводя к увеличению шунта. Другие варианты нарушения соотношения вентиляция/перфузия менее значимы. Различные методики вентиляции легких используются с целью открытия альвеол, находящихся в коллабированном или уплотненном состоянии. Спонтанное дыхание приводит к сокращению объема плотных тканей и улучшает оксигенацию крови. Необходимы дальнейшие исследования по оценке перехода от полностью принудительной вентиляции через вспомогательные режимы на самостоятельное дыхание.
Литература
1. Bernard GR, Artigas A, Brigham KL, Morris A, Spragg R.. Am 3 Respir Crit Care Med 1994; 149:818-824.
2. Luhr OR, Antonsen K, Karlsson M, Aardal S, Thorsteinsson A, Bonde J. Am J Respir Crit Care Med, 1999; 159:1849-1861.
3. Gattinoni L, PesentiA, Rossi G, Fumagalli R, Marcolin R, Mascheroni D et al. Anesthesiology 1988; 69:824-832.
4. Puybasset L, Cluzel P, Gusman P, Grenier P, Preteux F, RoubyJ. Intensive Care Med 2000; 26:857-869.
5. Tokics, L, G. Hedenstierna, LH. Lundquist, and A. Strandberg. J. Appl. Physio/. 1996; 81(4): 1822-1833.
6. Hedenstierna G. Wagner PD, eds. New York, Basel: Marcel Dekker Inc., 2000:177-198.
7. Dantzker DR, Wagner PD, West JB. J Appl Physiol 1975; 38(5): 886-895.
8. Rothen, H. U., B. Sporre, G. Engberg, G. Wegenius, A. Reber, andG. Hedenstierna.. Lancet 1995; 345:1387-1391.
9. 9 WestJB, Dollery CT, Naimark A: J Appl Physiol 1964, 19: 713-724.
10. Glenny RW, Lamm Щ Albert RK, Robertson HT: J Appl Physiol 1991, 71: 620-629
11. Schuster DP, HallerJAppI Physiol 1990; 69:353-361.
12. Melot C. Thorax 1994; 49:1251-1258.
13. Gattinoni L, Bomb/no M, Pelosi P, Lissoni A, Pesenti A, Fumagalli R, JAMA 1994; 271:1772-1779.
14. Muscedere JG, Mullen JB, Can K, Slutsky AS. Am J Respir Crit Care Med 1994; 149:1327-1334.
15. Neumann P, Berg/undJE, Mondejar EF, Magnusson A, Hedenstierna G. Am J Resp Crit Care Med 1998; 158:1636-1643.
16. Tharratt RS, Allen RF, A/bertson ТЕ. Chest 1988; 94: 755-762.
17. Lessard MR, Guerot E, Lor/no H, Lemaire F, Brochard L Anesthesiology 1994; 80: 983-991.
18. Neumann P, BerglundJ, Hedenstierna G. Am J Respir Crit Care Med 2000; 161:1537-1545.
19. Putensen C, Rasanen J, Lopez FA. Am J Resp Crit Care Med 1994; 150:101-108.
20. Putensen C, Mutz NJ, Putensen-Himmer G, Zinserling J: Am J Respir Crit Care Med 1999; 159:1241 -1248.
ТРАХЕОСТОМИЯ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
М.Квинтел (Мангейм, Германия)
Введение
С момента ее первого описания Шевалье Джексоном в 1909 году современная методика оперативной трахеостомии (ТС) широко используется у пациентов отделений интенсивной терапии (ОИТ) с целью длительного или экстренного доступа к дыхательным путям (1). Впервые методика чрескожной трахеостомии описана Шелдоном и соавт. в 1967 году и Тойе и Вейнстейном и соавт. в 1985 году (2,3). «Классическая» техника чрескожной дилятационной трахеостомии (ЧДТ) с использованием разработанных расширителей была применена Чиаглиа и соавт. в 1985 году (4). Трахеостомия - наиболее широко используемый метод хирургического вмешательства у критически больных (5). Показания и длительность трахеостомии остаются спорными (6,7). Последние данные подтверждают, что ранняя трахеостомия у пациентов ОИТ может снизить длительность механической вентиляции, сроки госпитализации в ОИТ и в стационаре в целом (8). Ранняя трахеостомия выполняется по широко используемым разнообразным методикам ЧДТ.
Основные аспекты трахеостомии у пациентов в ОИТ
Трахеостомия имеет практические и теоретические преимущества перед традиционной интубацией, такие как безопасность дыхательных путей, исключение травматизации связочного и голосового аппарата гортани, простая санация дыхательных путей и полости рта, возможность перорального питания, повышенная комфортность пациента, снижение мертвого пространства и сопротивления дыхательных путей (табл.1).
Таблица 1: Преимущества трахеостомии перед интубацией
• безопасность дыхательных путей
• исключение травматизации связочного и голосового аппарата гортани
• снижение мертвого пространства и сопротивления дыхательных путей
• простая санация дыхательных путей и полости рта
• возможность перорального питания
• повышенная комфортность пациента
Влияние трахеостомии на сопротивление дыхательных путей и работа дыхания при этом остаются спорными вопросами. Дейл и соавт. отметили, что трахеостомия снижает работу дыхания у пациентов ОИТ (9), а на фоне предшествовавшей трахеостомии интубации сопротивление было выше из-за большей задержки мокроты в дыхательных путях. Модификации вспомогательных режимов вентиляции и автоматическое изменение давления манжеты (АИДМ) позволяет компенсировать сопротивление традиционной эндот-рахеальной трубки (ЭТТ) (10,11). Таким образом, меньшее сопротивление трахеостомии не может быть веским аргументом ее выполнения.
Внутрибольничная транспортировка критически больных для проведения хирургических вмешательств сопряжена с высоким риском. Частота осложнений при выполнении трахеостомии в операционной и в ОИТ одинакова (12). Учитывая это обстоятельство, если трахеостомия выполняется технически аккуратно, то можно избежать риска транспортировки и стоимости использования операционной (13).
Длительность трахеостомии
Длительность ИВЛ, сроки пребывания в ОИТ и в стационаре в целом у пациентов, которым была выполнена трахеостомия в первые 7 суток ИВЛ, меньше, чем у тех, кому она была выполнена позже (8,14). Нейрохирургическим пациентам с низким уровнем оценки по шкале комы Глазго более выгодно накладывать трахеостому раньше (15,16). В проспективном исследовании терапевтических и хирургических пациентов исходы лечения дыхательной недостаточности были лучше у трахеостомированных, чем у традиционно интубированных (19). Подобные результаты отмечены и при лечении пациентов с нозо-комиальной пневмонией, требовавших аэрозольной ингаляционной терапии, с аспирацией и тех, кто нуждался в переинтубациях.
Чрескожная дилятационная методика по сравнению с открытой оперативной трахеостомией
Есть очень немного рандомизированных исследований, сравнивающих ЧДТ и XT. Преимущества - на стороне ЧДТ, выполненной у 456 пациентов (18-20). В других исследованиях не было обнаружено отличий по количеству как крупных, так и незначительных осложнений (21,22,23). Эти данные необходимо дополнить расчетами экономических затрат.
Последний мета-анализ сравнительных исследований ЧДТ и XT осуществлен за период 1960-1996гг. Наибольшая частота осложнений в период 1960-1984гг. отмечена при XT, а за период 1985-1996гг. на долю ЧДТ приходится преобладание периоперационных осложнений, включая смерть и остановку кровообращения. Послеоперационные осложнения наиболее характерны для XT. Эти данные противоречивы и должны быть интерпретированы очень тщательно по сравнению с ЧДТ.
Чрескожная дилятационная трахеостомия (ЧДТ)
В настоящее время доступны и используются 4 различные методики чрескожной трахеостомии. Все они предполагают пункцию трахеи и введение в нее проводника. Пункция должна выполняться между 1-ми 2-м или 3-м и 4-м хрящами трахеи. Есть сведения, что при пункции между 3-м и 4-м хрящами риск случайных повреждений сосудов и других образований меньше, если нет анатомических отклонений (25). Проводник вводится в сторону карины, за исключением методики трансларингеальной трахеостомии Фантони (ТЛТ), при которой он проводится вверх за голосовые связки. По методике Чиаглиа последовательно с повышением диаметра в трахею вводятся дилятаторы с гидрофильной оболочкой до размера канюли. Недавно эта методика была модифицирована за счет использования специально разработанного дилятатора, введение которого заменяет всю процедуру. Методика, оригинально описанная Григгсом, предусматривает использование специально разработанного зажима, через отверстие на концах сомкнутых бранш которого вводится проводник. Расширяя бранши до необходимого размера, в трахею по проводнику вводится канюля. И наконец, есть методика трансларингеальной трахеостомии, которая предусматривает использование специальной канюли, состоящей из гибкого пластикового конуса с металлическим кончиком для расширения тканей изнутри трахеи наружу. В этом случае проводник применяется не только как направляющее приспособление, но и как расширитель для создания стомы. После расширения канюля может быть продвинута в сторону карины, используя специальный обтуратор.
В Европейских странах были проведены сравнительные обзоры частоты и длительности применения XT и ЧДТ. В двух крупных исследованиях методики ЧДТ по Чиаглиа (26,27) отмечены низкие показатели летальности, обусловленной самой методикой, и общей частоты осложнений. Эти данные подтверждаются клиническими наблюдениями безопасности и эффективности применения этого метода в ОИТ. Подобные результаты
получены при оценке методики введения проводника через дилятацитонный зажим с отверстием (28). При сравнении различных методик ЧДТ результаты отличаются незначительно, а при сравнении с транслатеральными способами особым моментом является повреждение задней стенки трахеи (29). Значение использования фиброоптических проводников еще недостаточно оценено, но теоретически эта процедура должна занять свое место в ряду остальных. Отсроченные результаты после ЧДТ практически сходны с традиционной XT (30,31).
Заключение .
ЧДТ является методом выбора для трахеостомии у пациентов ОИТ. Результатом обзоров является вывод, что ЧДТ несет меньше осложнений, чем XT. He исключая это, необходимо подчеркнуть определенные показания для выполнения XT (табл.2). Чтобы решиться на трахёостомию, необходимо взвесить доступность новых методик и их необходимость. Даже если есть минимальный риск выполнения ЧДТ, то не стоит ее выполнять.
Таблица 2. Абсолютные и относительные противопоказания для чрескожной дилятационной трахеостомии (ЧДТ)
• Возраст старше 15 лет
• Трудная интубация
• Подтвержденная или прогнозируемая трахеохондромаляция
• Анатомические трудности в области шеи (ожирение или короткая шея, крупная гортань)
• Неустранимые кровотечения
i • Ранее выполнявшиеся операции на шее и/или грудной клетке Литература
1. Jackson С, Tracheostomy. Laryngoscope 1909.19:285-290
2. Sheldon CH, Pudenz RH, Tichy FY. Percutaneous tracheostomy. JAMA 1957, 165:2068-2070
3. Toye FJ, Weinstein JO, A percutaneous tracheostomy device. Surgery 1969, 65:384-389
4. Ciaglia P, Firsching R, Syniec C. Chest 1985, 87:715-719
5. Heffner JE, Miller KS, Sahn SA. Chest 1986, 90:269-274
6. PlummerAL, Gracey DR. Chest 1989, 96:178-180
7. Marsh HM, Gillespie DJ, Baumgartner AE. Timing of tracheostomy in the critically ill patient. Chest 1989, 96:190-193
8. D'Amelio LF, Hammond JS, Spain DA, SutyakJP. Am Surg 1994, 60:180-185
9. Dieh/JL, BAtrousS, TouchardD, Lemaire F, BrochardL. Am JRespir Crit Care Med1999,159:383-388
10. Guttmann J, Bernhard H, Mols G, Benzing A, Fabry B, Geiger K. Intensive Care Med 1997, 23:1119-1124
11. Haberthur C, Fabry B, Stacker R, Ritz R, Guttmann J Intensive Care Med 1999, 25:514-519.
12. UpadhyayA, MaurerJ, Turner J, Tiszenkel H, Rosengart T. J Am Coll Surg 1996,183:51-55
13. Van Natta TL, Morris JA, Eddy VA, Nunn CR, Rutherford EJ, Neuzil D, Jenkins JM, BassJG. Ann Surg 1998, 227:618-626
14. Rodriguez JL, Steinberg SM, Luchetti FA, Gibbons Ю, Taheri PA, Flint LM. Surgery 1990,108:655-659
15. Koh WY, Lew TWK, Chin NM, Wong MFM. Anaesth Intens Care 1997, 25:365-368
16. QureshiAI, SuarezJI, Parekh PD, Bhardwaj A. Crit Care Med 2000; 28:1383-1387
17. KollefMH, Ahrens TS, Shannon W. Crit Care Med 1999, 27:1714-1720
18. Мое KS, Stoeckli SJ, Schmid S, Weymuller EA Jr.. Percutaneous tracheostomy: a comprehensive evaluation. Ann Otol Rhinol Laryngol 1999, 108:384-391
19. Holdgaard HO, Pedersen J, Jensen RH, Outzen KE, Midtgaard T, Johansen L V, M0ller. J, Paaske PB. Percutaneous dilatational tracheostomy versus conventional surgical tracheostomy. Acta Anaesthesiol Scand 1998, 42:545-550
20. McHenry CR, Raeburn CD, Lange RL, Priebe PP. Am Surgl997, 63:646-652
21. Stoeckli SJ, Breitbach T, Schmid S. Laryngoscope 1997,107:1643-1646
22. Graham JS, Mulloy RH, Sutherland FR, Rose S. J Trauma 1996, 42:245-250
23. Gysin C, DulguerovP, GuyotJP, Perneger TVAbajo B, Chevrolet JC. Ann Surg 1999; 230:708-714
24. Dulguerov P, Gysin C, Perneger TV, Chevrolet JC. Crit Care Med 1999, 27:1617:1625
25. Muhammad JK, Major E, Wood A, Patton DW. IntJ Oral Maxillofac Surg 2000; 29:217-222
26. Hill BB, Zweng TN K, Maley RH, Charash WE, Toursarkissian B, Kearney PA. J Trauma 1996, 40:238-243
27. Walz MK, Peitgen K, ThuraufN, Trost HA, Wolfhard U, Sander A, Ahmad/ C, Eigler FW. Intensive Care Med 1998, 24:685-690
28. Ambesh SP, Kaushik S. Percutaneous dilational tracheostomy: Anesth Analg 1998, 87:556-561
29. Westphal K, Byhahn C, Rinne T, Wilke HJ, Wimmer-Greinecker G, Lischke V. Ann ThoracSurg 1999, 68:486-492
30. Law RC, Carney AS, Manara AR. Anaesthesia 1997; 52:51 -5652
31. Rosenbower TJ, Morris Jr. JA, Eddy VA Ries WR. Am Surg 1998, 64:82-87
ТЕРАПИЯ ОТКРЫТЫХ ЛЕГКИХ™ В АНЕСТЕЗИИ И ИНТЕНСИВНОЙ
ТЕРАПИИ
Д. Поэльма, Б. Лахманн (Роттердам, Нидерланды)
Введение
Каждый год миллионам людей во всем мире проводятся интубация трахеи и искусственная вентиляция легких во время анестезии и в интенсивной терапии. Во время общей анестезии может наблюдаться артериальная гипоксемия [1, 2]. Влияние анестезии на мозг, сердечно-сосудистую систему и желудочно-кишечный тракт описано достаточно подробно, однако влияние анестезии на легкие изучено слабо.
В интенсивной терапии механическая вентиляция является важным компонентом лечения больных с нарушением функций легких, в частности, с острой дыхательной недостаточностью (ОДН), острым респираторным дистресс-синдромом взрослых (РДСВ). Характерное уменьшение комплайнса легких, вызванное увеличением поверхностного натяжения, приводит к альвеолярному коллапсу в конце выдоха, ателектазированию и увеличению шунтирования справа налево и уменьшению РаО2 [3].
Ателектазы во время анестезии
Компьютерная томография (КТ) позволила изучить физиологию и патофизиологию легких и грудной клетки во время анестезии. Так был выяснен механизм гипоксемии, возникающий во время общей анестезии. Перфузия невентилируемых участков легких приводит к несоответствию вентиляции и перфузии и вызывает артериальную гипоксе-мию. Количество ателектазов по данным КТ коррелирует с величиной интрапульмонарно-го шунта [4]. Образование ателектазов является важной причиной артериальной гипоксемии во время общей анестезии [5].
В здоровых легких с ателектазами гипоксическая легочная вазоконстрикция перенаправляет кровь из зоны ателектаза. Ингаляционные анестетики угнетают этот механизм [6], чем могут усилить артериальную гипоксемию.
Ателектазы развиваются во время анестезии у детей и взрослых [4, 7], обнаруживаются у 90% больных в наиболее критических зонах [8]. Это состояние ухудшается на фоне уменьшения функциональной остаточной емкости легких (ФОН) или резорбции чистого кислорода (так называемые резорбтивные ателектазы).
Уменьшение ФОБ
ФОЕ это объем, остающийся в легких после нормального выдоха. У взрослых он составляет около 50% общего легочного объема. ФОЕ является результатом баланса между стабильностью грудной клетки с одной стороны и сил растяжения легких с другой.
Во время анестезии уменьшение ФОЕ связано с: положением тела [9], самой анестезией [10] или хирургическим вмешательством на органах брюшной полости. У взрослых положение на спине уменьшает ФОЕ на 0,7 л по сравнению с вертикальным [9]. Сама по себе анестезия уменьшает ФОЕ на 0,4 л [10]. Уменьшение может даже касаться резиду-ального объема, который остается в легких после форсированного выдоха.
Уменьшение ФОЕ в положении на спине можно объяснить двумя путями (рис. 1):
1) Уменьшение диаметра грудной клетки [11]. У больных, лежащих на спине, сила тяжести деформирует грудную клетку, уменьшает расстояние между грудиной и спиной, а это снижает объем грудной клетки.
Рис. 1. Причины уменьшения функциональной резидуальной емкости. Резорбтивные ателектазы
Образование ателектазов во время введения в анестезию находится под влиянием состава газа, концентрации кислорода. Использование для преоксигенации меньшей концентрации кислорода (30% против 100%) может предотвратить раннее образование ателектазов [12]. При спонтанном дыхании чистым кислородом в течение минуты им замещается более трех четвертей азота в легких. Резорбтивные ателектазы могут возникать, только если блокируются или коллабируются проводящие воздушные пути. Таким образом, если поддерживать в воздушных путях достаточный уровень ПДКВ (например, 10 mmHg), ателектазы устраняются или минимизируются даже при дыхании 100% кислородом [13].
Большинство больных, подвергающихся анестезии, здоровы и имеют нормальную функцию легких. Однако в ОИТ у больных часто наблюдается патология легких (ОДН, РДСВ) с уровнем летальности до 60% [14]. Патология легких и необходимость механической вентиляции значительно увеличивает риск ателектазирования.
Ателектазирование в интенсивной терапии
Одной из особенностей ОДН/РДСВ является неактивная система сурфактанта. Сур-фактант это поверхностно активное вещество, образующее тонкую оболочку внутренней поверхности легких, контролирующее поверхностное натяжение. Он препятствует прохождению жидкости в воздушное пространство легких, сохраняя их сухими. Контролируя поверхностное натяжение, сурфактант также стабилизирует соотношения поверхностного натяжения и площади поверхности легких. Без этого для расправления альвеол потребовалось бы гораздо большее усилие, а во время выдоха альвеолы бы спадались. Сурфактант минимизирует необходимость приложения силы для расправления альвеол и предотвращения их коллапса. Поддерживаемое поверхностное натяжение обеспечивает одинаковое давление во всех альвеолах, независимо от их размеров. Если напряжение сурфактанта постоянное, меньшие альвеолы с большим давлением растяжения опорожняются в большие. Этот механизм важен, потому что альвеолы присоединяются одна к другой, и если их расширение не будет регулироваться подобным способом, точка со-
2) Краниальное смещение диафрагмы в грудной клетке [11]. Сила тяжести вызывает краниальный сдвиг внутрибрюшных органов и выталкивание диафрагмы вверх. То же самое делает хирургическая операция. Если больной находится в положении с опущенным головным концом, внутренние органы смещают диафрагму еще более краниально.
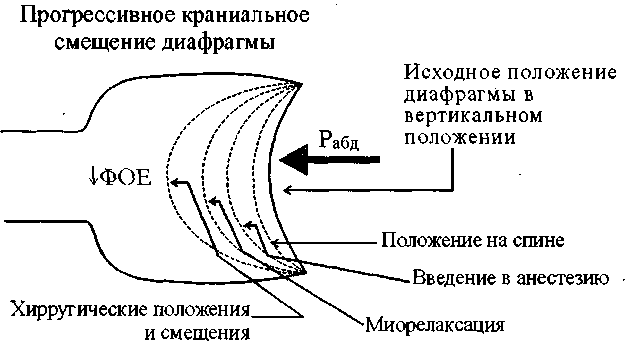
единения должна будет оттягиваться большими альвеолами гораздо дальше, чем могут растянуться меньшие альвеолы. Подобные силы растяжения, возможно, являются основной причиной структурного повреждения, выброса цитокинов из разрушенной паренхимы, запуская механизмы острой дыхательной недостаточности. Если альвеолы поддерживают свой размер относительно других, силы растяжения не возникает.
В нормальных легких сурфактант образует на поверхности альвеол оболочку постоянной толщины (равной примерно одной молекуле). Во время нормального выдоха площадь поверхности легких уменьшается. Если поверхность альвеол становится меньше, чем требуется для молекул сурфактанта, они отжимаются от поверхности альвеол и выталкиваются в дыхательные пути (рис. 2). Нормальное функционирование легких происходит при поддержании баланса между синтезом, выделением и потреблением сурфактанта.

Рис. 2. Баланс между синтезом, выделением и удалением сурфактанта:
а) здоровые легкие. Данное давление необходимо для открытия альвеол. Количество молекул на поверхности и в гипофазу достаточно для замещения потери во время выдоха;
b) дисбаланс между синтезом, выделением и потерей сурфактанта во время искусственной вентиляции легких. В начале вдоха существует явный дефицит молекул сурфактанта, однако они мигрируют из хранилища в гипофазе. В конце выдоха на поверхности оказывается вполне достаточное количество сурфактанта.
c) Во время следующего выдоха поверхностно активные молекулы отжимаются. В гипофазе нет молекул для компенсации, возникает ситуация серьезного дефицита сурфактанта.
При традиционной искусственной вентиляции легкие больного наполняются и опустошаются ритмично. Используется естественное свойство легких спадаться для усиления удаления воздуха. Если альвеолы сокращаются до меньшего размера, чем обычно (ниже ФОЕ), большее количество сурфактанта теряется в дыхательные пути или образуются его
сгустки без свойств регуляции поверхностного натяжения. Этот эффект усиливается при вентиляции с большим дыхательным объемом. Возникает состояние дефицита сурфак-танта.
Самым явным" и ранним эффектом является увеличение жесткости легких, требующей большего давления для достижения необходимого дыхательного объема. Не столь явным становится увеличение силы растяжения между альвеолами, вызывая их сдвиг и шунтирование. Коллапс дыхательных путей вызывает ателектазирование, нарушение регуляции поверхностного натяжения, приводящее к снижению перфузии и отеку легких (белки в отечной жидкости угнетают сурфактант).
Эти эффекты нежелательны для здоровых легких, а в пораженных являются жизнеуг-рожающими. Субоптимальная вентиляция является ятрогенным повреждением: не лечение, а причина ОДН, РДСВ.
Необходимо проводить механическую вентиляцию с параметрами выше ФОЕ для предотвращения истощения сурфактанта и неблагоприятного влияния вентиляции на механику дыхания и обмен жидкости в легких.
Это делается с помощью открытия легких. Основной принцип показан на кривой давление - объем, так называемой «кривой бутылки Кьянти» рис. 3). Для открытия легких необходимо давление Ро, однако после этого оно должно поддерживаться в пределах зоны DC. Если давление падает ниже Рс, легкие снова спадаются.
Рис. 3 Схематический рисунок кривой давление-объем, показывающий предполагаемый механизм работы и коллапса альвеол. Изменение объема при увеличении давления во время вдоха показано сплошной линией. В точке А альвеолы коллабированы. В точке В на фоне давления Ро легкие начинают открываться, альвеолярный объем растет (пунктирная линия) и достигает точки D. Обратите внимание, что в точках В и D давление в альвеолах одинаковое. Когда давление снижается до уровня закрытия (Рс) в точке С, изменения объема соответствуют сплошной линии, т.е. вновь возникает коллапс.
Практическое значение
Оптимально оборудование состоит из аппарата ИВЛ, проводящего вентиляцию легких, контролируемую по давлению, и постоянного мониторинга газового состава крови. Процесс проходит в три этапа (рис. 4).
выявление давления открытия и коллабирования легких больного; открытие легких;
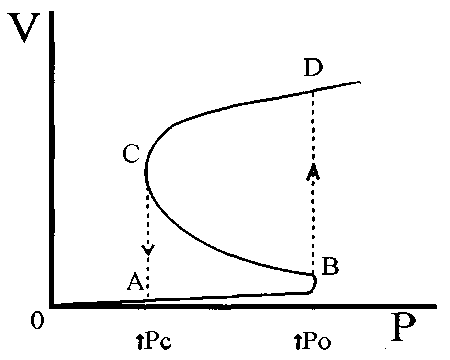
поддержание легких открытыми.
Рис.4. Диаграмма принципов терапии открытых легких.
Выявление давления открытия и коллабирования легких
1) Осторожно повышать давление в дыхательных путях пока РаО2 не достигнет мак-•Лн симального значения. Эта точка, при которой легкие полностью открыты (давление Ро на рис. 3).
2) Медленно уменьшать давление, пока РаС>2 не начнет снижаться. При этом значении некоторые альвеолы начинают спадаться (давление PC на рис. 3).
Открытие легких
3) Увеличить давление до уровня Ро за короткий промежуток времени (5-10 сек.) для повторного открытия легких.
Поддержание легких открытыми
4) Убедитесь, что ПДКВ установлено выше уровня давления PC. Настройте на вентиляторе:
наименьшее давление в дыхательных путях - чтобы избежать влияния на гемодинамику (повышенное давление может способствовать пережатию альвеолами капиллярного русла);
наименьшую амплитуду давления и оптимальное соотношение вдоха и выдоха и частоту - чтобы избежать возможных сил растяжения (в зоне выше PC небольшие изменения давления приводят к значительным изменениям объема и обеспечивают соответствующую элиминацию СО2 . На практике постоянное определение РаО2 оказывается достаточно чувствительным, чтобы реагировать на малейшие ателектазы.
Вывод
Во время анестезии и интенсивной терапии легочных заболеваний легкие оказываются склонными к коллапсу, ателектазированию и артериальной гипоксемии. Ателектазов
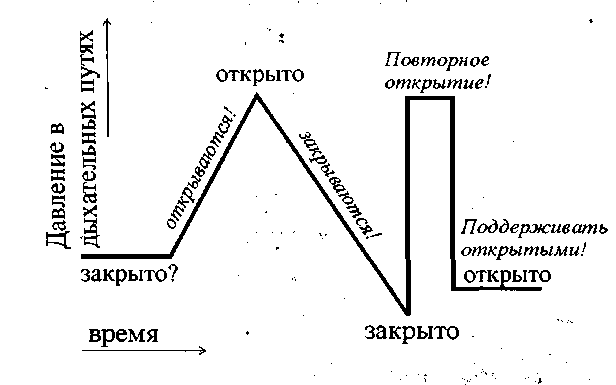
можно избежать, поддерживая легкие открытыми в течение всего дыхательного цикла. Это уменьшает внутрилегочной шунт и улучшает артериальную оксигенацию. Терапия открытых легких предохраняет их от дальнейшего повреждения ИВЛ, позволяет уменьшить F102, способствует рассасыванию интерстициального и интрапульмонарного отека, может уменьшить давление в легочной артерии.
Комбинация этого лечения с ранней экзогенной сурфактантной терапией могло бы улучшить работу легких у больных на ИВЛ и помочь раннему снятию больных с ИВЛ.
Литература
1. Sykes M, Young W, Robinson В. Oxygenation during anaesthesia with controlled ventilation. BrJ Anaesth 1965;37:314-25,
2. Marshall BE, Wyche MQ, Jr. Hypoxemia during and after anesthesia. Anesthesiology 1972;37:178-209.
• 3. Lachmann B. The role of pulmonary surfactant in the pathogenesis and therapy of ARDS. In: Vincent JL, (ed.), Update in intensive care and emergency medicine. Berlin: Springer- Verslag. 1987:123-34.
4. Brismar B, Hedenstierna G, Lundquist H, Strandberg A, Svensson L, Tokics L Pulmonary densities during anesthesia with muscular relaxation-a proposal of atelectasis. Anesthesiology 1985;62:422-8.
5. Rothen HU, Sporre B, Engberg G, Wegenius G, Hedenstierna G. Airway closure, atelectasis and gas exchange during general anaesthesia. BrJ Anaesth 1998;81:681-6.
6. Sykes MK, Loh L, Seed RF, Kafer ER, Chakrabarti MK. The effect of inhalational anaesthetics on hypoxic pulmonary vasoconstriction and pulmonary vascular resistance in the perfused lungs of the dog and cat. Br J Anaesth 1972;44:776-88.
7. Damgaard-Pedersen K, Qvist T. Pediatric pulmonary СГ-scanning. Anaesthesia-induced changes. Pediatr Radio! 1980;9:145-8.
8. Lundquist H, Hedenstierna G, Strandberg A, Tokics L, Brismar B. CT-assessment of dependent lung densities in man during general anaesthesia. Acta Radiol 1995;36:626-32.
9. Lumb AB, Nunn JF. Respiratory function and ribcage contribution to ventilation in body positions commonly used during anesthesia. AnesthAnalg 1991;73:422-6.
10. Don HF., Wahba WM, Craig DB. Airway closure, gas trapping, and the functional residual capacity during anesthesia. Anesthesiology 1972;36:533-9.
чЛ< 11. Hedenstierna G, Strandberg A, Brismar B, Lundquist H, Svensson L, Tokics L. Functional residual capacity, thoracoabdominal dimensions, and central blood volume during general anesthesia with muscle paralysis and mechanical ventilation. Anesthesiology 1985;62:247-54.
12. Rothen HU, Sporre B, Engberg G, Wegenius G, Reber A, Hedenstierna G. Prevention of atelectasis during general anaesthesia. Lancet 1995;345:1387-91.
13. Neumann P, Rothen HU, Berglund JE, Valtysson J, Magnusson A, Hedenstierna G. Positive end-expiratory pressure prevents atelectasis during general anaesthesia even in the presence of a high inspired oxygen concentration. Acta Anaesthesiol Scand 1999;43:295-301.
14. Ranieri VM, SuterPM, Tortorella C, De Tullio R, DayerJM, Brienza A, Bruno F, SlutskyAS. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA 1999;282:54-61.
15. Lachmann B. Open up the lung and keep it open. Intensive Care Med 1992;18:319-21.
16. Lachmann B, Danzmann E, Haendly B, Jonson B. Ventilator settings and gas exchange in respiratory distress syndrome. In: Prakash О ,(ed.), Applied physiology in clinical respiratory care. The Hague: Nijhoff. 1982:141-76.
17. Bohm S, Vazquez de Anda G, Lachmann B. The Open Lung Concept. In: Vincent J, (ed.), Yearbook of Intensive Care and Emergency Medicine. Heidelberg: Springer-Ver/ag. 1998: 430-40.
18. Lachmann B, Jonson B, Lindroth M, Robertson B. Modes of artificial ventilation in severe respiratory distress syndrome. Lung function and morphology in rabbits after wash-out of alveolar surfactant. Crit Care Med 1982; 10:724-32.
19. Hartog A, Vazquez de Anda GF, Gommers D, Kaisers U, Lachmann B. At surfactant deficiency, application of 'the open lung concept' prevents protein leakage and attenuates changes in lung mechanics. Crit Care Med 2000;28:'1450-4.
20. Vazquez de Anda GF, Hartog A, Verbrugge SJ, Gommers D, Lachmann B. The open lung concept: pressure-controlled ventilation is as effective as high-frequency oscillatory ventilation in improving gas exchange and lung mechanics in surfactant-deficient animals. Intensive Care Med 1999;25:990-6.
Подписано в печать 24.06.2002. Физ. п. л. 36,0. Формат 60x84'/.. Тираж 1500 экз. Заказ № 1581
Отпечатано в полном соответствии с качеством предоставленных диапозитивов на издательско-полиграфическом
предприятии «Правда Севера». 163002, г. Архангельск, пр. Новгородский, 32
7. Mul/er M,, Sch/ndler E., Kwapisz M,, et al. Effect of intraoperative angiotensin-converting enzyme inhibition by quinoprilat on hypotension after coronary artery surgery. Br J Anaest 2000 Mar; 84:396-8.
8. Greenbaum R., Zucchelli P., Caspi A., et al: Comparison of pharmacokinetics of fosinoprilat with enalaprilat and /isinopril in patients with congestive heart failure and chronic renal insufficiency. Br J С/от Pharmacol 2000; 49: 23-31.
9. Licker M., Neidhart P., Lustenberger S., et al: Long-term angiotensin-converting enzyme inhibitor treatment attenuates adrenergic responsiveness without altering hemodynamic control in patients undergoing cardiac surgery. Anesthesiology 1996; 81: 299-307.
10. Eyraud D., Mouren S., Teugels K., et al: Treating anesthesia-induced hypotension by angiotensin II in patients chronically treated with angiotensin-converting enzyme inhibitors. Analg 1998; 86:259-65.
11. Brabant S.M., Bertrand M., Eyard D., Darmon P.L,Coriat P.: The hemodynamic effects of anesthetic induction in vascular surgical patients chronically treated with angiotensin II receptor antagonists. Anest Analg 1999; 89: 6:1388-1392.
12. Burnier M., Brunner HR.: Angiotensin II receptor antagonists. Lancet 2000 Feb 19; 355 (9204): 637-45.
УВАЖАЕМЫЕ ЧИТАТЕЛИ!
В издательстве Северного государственного медицинского университета готовится к выходу в свет книга «Основы неотложной хирургической помощи»: руководство для врачей общей практики (семейных врачей) в двух томах под редакцией профессора Р.Н. Калашникова 2-е издание, исправленное и дополненное.
Настоящая книга призвана облегчить задачу оказания неотложной хирургической помощи.
В общей части приведены принципы соблюдения асептики и антисептики, основы хирургической техники и первичной хирургической обработки ран, вопросы оказания первой врачебной помощи при кровотечениях и травмах. Даны основы реанимации при состояниях, угрожающих гибелью пострадавших.
В специальном разделе описаны типичные наиболее частые повреждения и принципы оказания неотложной хирургической помощи. Книга рассчитана на врачей общего профиля и на молодых врачей, не имеющих опыта практической работы в экстремальных ситуациях. Книга принесет пользу и студентам медицинских вузов.
Издательский центр СГМУ принимает заказы на эту книгу, готов рассмотреть Ваши пожелания и предложения по адресу:
163061, Архангельск, пр. Троицкий, 51, каб. 330
Телефоны для справок (8182) 20-61-90, 64-03-42
E-mail: pub@asma.ru

