
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Окислительно-восстановительные электроды
На электродах всех видов протекают реакции окисления или восстановления. Однако если реакция протекает на поверхности инертного материала и при этом не выделяется металл или газообразное вещество, то такие электроды принято называть окислительно-восстановительными, или редокс-электродами. Различают два вида окислительно-восстановительных электродов.
Простые окислительно-восстановительные электроды отличаются тем, что не сопровождающееся образованием металла или газообразных веществ изменение степени окисления элемента на поверхности инертного материала происходит без участия ионов или молекул других веществ.
Простые редокс-электроды характеризуются электродной реакцией, которую можно представить в общей форме:
Mz+ + ye = M(z−y)+,
условной записью
Mz+, M(z−y)+ Pt
и выражением для электродного потенциала
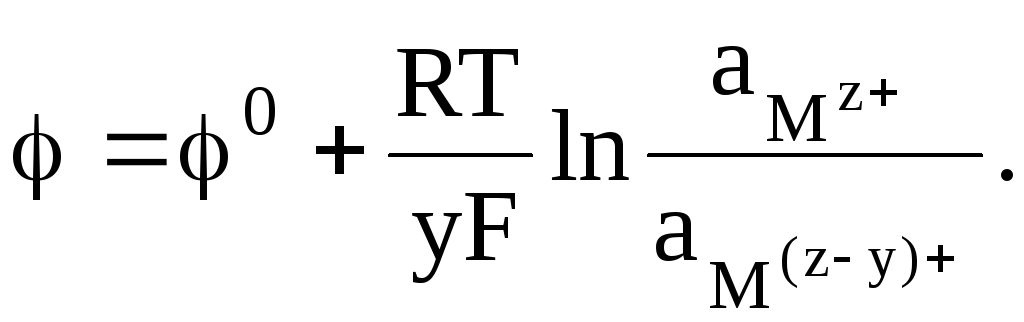 (2
- 5)
(2
- 5)
В качестве примера простого редокс-электрода можно привести электрод, на котором происходит восстановление ионов Fe3+ до Fe2+:
Fe3+ + e = Fe2+,
Fe3+, Fe2+ Pt,
![]()
Кроме приведенного электрода к числу простых редокс-электродов относятся цериевый электрод Ce4+,Ce3+/Pt, на котором протекает реакция:
Ce4+ + e = Ce3+,
таллиевый Tl3+,Tl+/Pt, ванадиевый V3+, V2+/Pt электроды и др.
Соотношение между активностями ионов с разной степенью окисления в простом редокс-электроде и, следовательно, электродный потенциал его зависят от окислительных свойств среды. С этой целью они могут использоваться в аналитической химии и биохимических исследованиях.
Еще одно применение простых редокс-электродов связано с расчетом потенциала некоторых гипотетических электродов.
Как правило, электрод, содержащий ионы в высшей степени окисления в контакте с металлом, например, Fe3+/Fe, неустойчив. Для расчета потенциала такого гипотетического электрода можно воспользоваться следующим приемом.
Найдем стандартный потенциал устойчивого электрода 1-го рода, в котором ионы с низшей степенью окисления металла находятся в контакте с металлом:
M(z−y)+
+ (zy)e
= M,
![]()
и стандартный электродный потенциал устойчивого простого редокс-электрода
Mz+
+ ye
= M(zy)+,
![]() .
.
Ионы с высшей степенью окисления можно восстановить до металла, проведя последовательно процессы в гальванических элементах, первый из которых состоит из стандартного электрода сравнения и простого редокс-электрода и работа в котором равна
W’1=
![]() yF,
yF,
а второй состоит из стандартного электрода и электрода 1-го рода и в котором совершается работа, равная
W’2
=
![]() (z-y)F.
(z-y)F.
Вся работа по восстановлению ионов с высшей степенью окисления до металла равна
W’ = W’1 + W’2 .
Если бы была возможна реакция прямого восстановления ионов в высшей степени окисления
Mz+
+ ze
= M,
![]() ,
,
то работа по восстановлению ионов оказалась бы равной
W’x
=
![]() zF.
zF.
Так как при постоянном давлении и постоянной температуре полезная работа квазистатического процесса не зависит от пути (она определяется приращением энергии Гиббса), то из равенства работ
W’x = W’ следует
![]() yF
+
yF
+
![]() (z−y)F
=
(z−y)F
=
![]() zF.
zF.
Таким образом, стандартный потенциал гипотетического электрода можно вычислить по формуле:
![]() ,
(2 - 6)
,
(2 - 6)
которая называется формулой Лютера.
Сложные окислительно-восстановительные электроды. Отличительной особенностью этих электродов является то, что в реакции окисления или восстановления принимают участие другие ионы и молекулы.
Приведем в качестве примера сложного редокс-электрода кислотный перманганатный электрод:
MnO4 + 8H+ + 5e = Mn2+ + 4H2O,
MnO4, Mn2+, H+ Pt,

Еще одним примером сложного редокс-электрода может служить гипойодиттно-йодидный электрод:
IO + H2O + 2e = I + 2OH−,
IO,I, OH Pt,

Существуют разнообразные варианты сложных редокс-электродов, которые невозможно выразить единой формой записи. Характерно, что электродный потенциал сложных окислительно-восстановительных электродов зависит от водородного показателя среды. Эта особенность использована для измерения рН в специальном электроде - хингидронном электроде.
Хингидронный электрод представляет собой платиновую проволоку, погружаемую в исследуемую среду, в которую добавлено небольшое количество кристаллов хингидрона - эквимолекулярной смеси хинона С6Н4О2 и гидрохинона С6Н4(ОН)2. Хингидрон трудно растворяется в воде. Поэтому активность кристаллов хингидрона можно считать равной 1. На этом электроде происходит восстановление хинона до гидрохинона:
С6Н4О2 + 2Н+ +2е = С6Н4(ОН)2.
Условно электрод можно записать следующим образом:
Н+ С6Н4О2,С6Н4(ОН)2, Pt.
Электродный потенциал хингидронного электрода зависит от рН среды:
![]()
Хингидронный электрод работает только в кислых и нейтральных средах, так как в щелочных средах происходит образование солей гидрохинона, которые хорошо растворимы в воде.
