
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
В.Н. Захарченко Курс физической химии Москва
УДК 541.1
Захарченко
В.Н. Курс физической химии. Часть 2.
Электрохимические системы и процессы.
Часть 3. Химическая кинетика и катализ.
– М.: РГМУ, 2002, с.
ISBN 5–88458–103–3
Во второй части учебного пособия «Курс физической химии» излагаются основные сведения о термодинамике гальванического элемента, описываются основные типы электродов и приводятся принятые представления о строении и свойствах электролитов.
В третьей части в предлагаемом пособии рассматриваются основные положения формальной кинетики с описанием важнейших типов реакций, механизмы химических превращений и основные представления о катализе.
Рецензенты:
профессор А.Г.Атанасянц (Российский химико-технологический университет им. Д.И.Менделеева),
профессор А.П. Каплун (Московская академия тонкой химической технологии им. М.В.Ломоносова).
ISBN 5–88458–103–3
© В.Н. Захарченко
© РГМУ, 2002
Часть 2. Электрохимические системы и электрохимические процессы
В данной части рассматриваются системы, которые совершают полезную работу в ходе химической реакции. Практически единственным результатом такой работы может быть электрическая энергия. Если работа совершается в квазистатических условиях, то для описания этих систем успешно применяются методы классической термодинамики. Существуют методы описания систем, в которых процессы протекают с конечной скоростью. Как правило, они близки к обычному термодинамическому подходу и называются квазитермодинамическими. В нестатических условиях, когда происходит перемещение с конечной скоростью заряженных частиц в растворах, решающую роль могут играть свойства электролитов. Они также изучаются в этой части курса.
Термодинамика гальванического элемента
Гальванический элемент
Гальваническим элементом называется устройство, в котором в результате химической реакции совершается полезная работа в виде электрической работы.
Рассмотрим, какие условия должны выполняться, чтобы реакция сопровождалась именно этой работой.
Прежде всего необходимо, чтобы реакция осуществлялась с переходом зарядов. Единственным химическим источником электрической работы может быть устройство, в котором протекает реакция окисления - восстановления. Только в ходе этой реакции происходит переход электронов от восстановителя к окислителю.
Второе условие требует, чтобы заряды переносились по всей электрической цепи.
Для пояснения второго условия рассмотрим следующую реакцию окисления - восстановления:
Cu2+ + Zn = Cu + Zn2+.
В этой реакции происходит перенос двух электронов от атома цинка к иону меди.
Однако если поместить цинковую пластинку в раствор, содержащий ионы меди, электрическую работу получить невозможно, так как восстановление ионов меди будет происходить при их прямом контакте с атомами цинка. Для того, чтобы совершалась электрическая работа, электроны должны от атомов цинка пройти к ионам меди по электрической цепи. Поэтому процесс окисления атомов цинка и процесс восстановления ионов меди необходимо пространственно разделить. Таким образом, цинковая пластинка не должна контактировать с ионами меди, содержащимися в растворе электролита. По этой причине цинковую пластинку следует погрузить в раствор, содержащий ионы цинка, а ионы меди должны контактировать с медью.
Следовательно, гальванический элемент состоит из двух основных частей, в одной из которых происходит окисление одного соединения, а в другой - восстановление другого (в данном случае - окисление цинка в одной части устройства и восстановление ионов меди в другой). Эти части называются полуэлементами. В качестве синонима используют другое название - электрод. Каждый из электродов обязательно содержит металл, погруженный в раствор электролита, а в ряде случаев - еще и малорастворимую соль, газ и другие вещества, не содержащиеся в фазе электролита.
Пару полуэлементов необходимо соединить с образованием электрической цепи. Для этого металлическую часть одного полуэлемента соединяют с металлической частью другого полуэлемента металлическим проводником. Цепь можно замкнуть, приведя в контакт растворы электролитов обоих полуэлементов (жидкостное соединение).
Однако по ряду причин для жидкостного соединения используют трубку, заполняемую промежуточным раствором электролита, чаще всего раствором хлорида калия. Такое жидкостное соединение называется солевым мостиком.
Определенный интерес представляет составление цепи в гальваническом элементе в том случае, когда один из элементов содержит неводный электролит. Например, один из полуэлементов может содержать водный раствор электролита, в который погружен малоактивный или даже инертный металл (цинк, медь, ртуть, платина и т.д.), а другой - электролит на основе безводного ацетона с погруженным в него металлическим натрием. Такой гальванический элемент, содержащий водный солевой мостик, а тем более при прямом контакте растворов, не будет стабильным (взаимодействие натрия с водой может привести даже к взрыву). В этом случае для замыкания цепи можно использовать ионизированный газ (Захарченко В.Н., 1974). Между двумя поверхностями растворов электролитов помещают источник ионизирующего излучения. Ионизированный газ содержит газ и электроны, подобен раствору электролита в солевом мостике.
В высокотемпературных гальванических элементах электролитом служат расплавленные вещества, которые называют ионными жидкостями. К ним относятся расплавы солей и расплавы оксидов.
Известны гальванические элементы с твердыми электролитами, например, с таблетированными ионными кристаллами -AgI или кристаллами -Ag2HgI4 .
Металл, погруженный в раствор электролита, может непосредственно участвовать в реакции, как это происходит с медью и цинком в приведенном выше примере. Если металл входит в суммарное уравнение химической реакции, протекающей в гальваническом элементе, он называется активным материалом. В других случаях процессы окисления и восстановления могут происходить только на поверхности металла, и он не входит в суммарное уравнение реакции и является лишь переносчиком электронов. Такой металл называется инертным электродным материалом. Наиболее часто в качестве инертных электродных материалов используются углерод и платина.
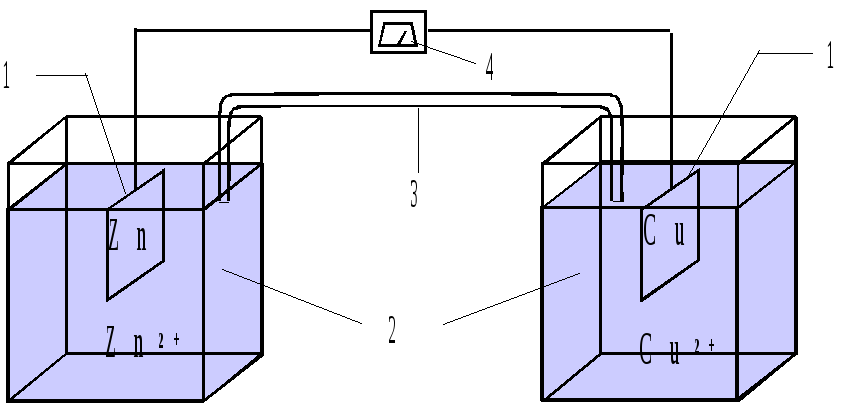
Гальванический элемент можно изображать графически. Например, в элементе, в котором протекает приведенная выше реакция Cu2+ + Zn = Cu + Zn2+, необходимо изобразить цинковую пластину, погружаемую в сосуд с раствором соединения, диссоциирующего с образованием ионов цинка, и медную пластину, погружаемую в сосуд с раствором, в котором содержатся ионы меди. Далее необходимо показать соединение медной пластины с цинковой и солевой мостик, соединяющий оба раствора электролита (рис. 1-1).
Рис. 1 - 1. Схема
гальванического элемента: 1
- электродные материалы, 2 - электролиты,
3 ‑ солевой мостик, 4 - потенциометр.
Вначале устанавливается, какой из двух электродов данного элемента является более отрицательным.
Общие правила установления соотношения между знаками электродов будут рассмотрены при дальнейшем изложении курса. Для гальванического элемента, в котором происходит восстановление ионов меди атомами цинка, более отрицательным является цинк, а медь имеет более положительный потенциал.
Крайним слева записывается электродный материал более отрицательного электрода.
В приводимом случае слева необходимо записать цинк:
Zn.
2а. Если вне фазы электролита находится несколько веществ, включая газы, труднорастворимые соли и др., то их записывают, отделяя друг от друга запятыми, причем крайним слева всегда указывается металл (или другой проводник первого рода) более отрицательного электрода.
Приведем примеры:
Pt, H2; Ag, AgCl; C, C6H4O2, C6H6O2; Hg, Hg2Cl2.
Проводится вертикальная черта и указывается состав электролита левого (более отрицательного) электрода.
В рассматриваемом примере реакции между ионами меди и цинком с цинковой пластиной контактирует раствор, содержащий ионы цинка. Следовательно,
Zn Zn2+.
3а. Если раствор электролита содержит несколько видов ионов или других веществ, принимающих участие в реакции, то их записывают, отделяя друг от друга запятыми.
Например,
Pt MnO4 −, Mn2+, H+.
В случае соединения растворов электролитов солевым мостиком ставятся две вертикальных черты, правее которых записывается состав раствора электролитов правого (более положительного) электрода.
В рассматриваемом примере у медного электрода электролит содержит ионы меди. Следовательно,
Zn Zn2+ Cu2+.
4а. Этот пункт правил повторяет пункт 3а для правого электрода.
Проводится вертикальная черта и указываются материалы правого электрода, причем крайним справа записывается металл или другой проводник первого рода.
Полная запись гальванического элемента с цинковым и медным электродами такова:
ZnZn2+Cu2+Cu.
