
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Необратимая реакцияn-ого порядка
Реакция n-го порядка описывается уравнением:
![]() .
(9 - 32)
.
(9 - 32)
Его интегрирование с учетом граничных условий (С = С0 при = 0) дает:
![]() .
(9 - 33)
.
(9 - 33)
Время полупревращения находим подстановкой 1/2 вместо и С0/2 вместо С:
![]() .
(9 - 34)
.
(9 - 34)
Обозначив
![]() ,
,
получим более компактную форму уравнения, связывающего время полупревращения с начальной концентрацией вещества:
![]() .
(9 - 35)
.
(9 - 35)
Методы определения порядка реакции
Общий порядок реакции n по экспериментальным данным можно определять несколькими методами.
Однако в качестве первого шага целесообразно установить, является ли данная реакция реакцией первого порядка. С этой целью строят график в координатах: логарифм отношения исходной концентрации к концентрации в данный момент времени время от начала реакции. В соответствии с уравнением (9 - 10) для реакции первого порядка зависимость должна выражаться прямой с угловым коэффициентом, равным константе скорости k (см. рис. 9 - 1). Если кинетическая зависимость отклоняется от прямой, то используют один из следующих методов.
Дифференцирование кинетической кривой
Рис.
9 - 5. Определение
порядка реакции методом графического
дифференцирования кинетической кривой.

![]() ,
в соответствии с уравнением (9 ‑ 7)
имеем:
,
в соответствии с уравнением (9 ‑ 7)
имеем:
![]() ;
;
![]() .
.
Делением частей правого равенства на соответствующие части левого равенства получим:
 .
(9 - 36)
.
(9 - 36)
После логарифмирования равенства (9 - 36) находим формулу для определения порядка реакции:
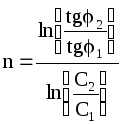 .
(9 - 37)
.
(9 - 37)
В основу еще одного метода определения порядка реакции положена зависимость времени полупревращения от исходной концентрации.
Логарифмируя равенство (9 - 35), имеем:
![]() .
(9 - 38)
.
(9 - 38)
На рис. 9 - 6 показана зависимость логарифма времени полупревращения от логарифма исходной концентрации. Угловой коэффициент прямой tg на рис. 9 ‑ 6 равен - (n − 1).
Рис.
9 - 6. Определение
порядка реакции по зависимости времени
полупревращения от исходящей концентрации.

Частный порядок реакции по веществу определяют при условии, что концентрация данного вещества во много раз меньше концентраций остальных веществ. Обработка экспериментальных данных проводится с применением тех же методов, что и при определении порядка реакции в целом.
Кинетика сложных реакций
Параллельные реакции
Рассмотрим наиболее простой случай параллельных реакций:
k1 k2
С A B.
Скорость реакции образования вещества В в соответствии с принципом независимого протекания реакций определяется уравнением:
![]() ,
(10 - 1)
,
(10 - 1)
а скорость образования вещества С - уравнением:
![]() .
(10 - 2)
.
(10 - 2)
Общая скорость расходования вещества А по обеим реакциям составляет
![]() .
(10 - 3)
.
(10 - 3)
Интегрирование уравнения (10 - 3) с учетом граничных условий (СA = CA,0 при = 0) дает:
![]() .
(10 - 5)
.
(10 - 5)
Другая форма уравнения для кинетики параллельных реакций первого порядка имеет следующий вид:
![]() .
(10 - 6)
.
(10 - 6)
Из соотношений (10 - 1) и (10 - 2) следует, что отношение скоростей образования веществ В и С всегда постоянно и равно отношению констант скоростей k1 и k2. Следовательно, выполняется условие: отношение концентраций веществ В и С также равно отношению констант:
![]() .
(10 - 7)
.
(10 - 7)
Рис.
10 - 1.
Кинетические кривые для параллельных
реакций первого порядка.

СВ + СС = СА,0 − СА
и соотношения (10 ‑ 7) следует:
![]() ,
,
![]() ,
,
а с учетом уравнения (10 ‑ 6) получим:
![]() ,
,
![]() .
(10 - 9)
.
(10 - 9)
Типичный вид кинетических кривых и соотношение между концентрациями продуктов реакции и исходного вещества показаны на рис. 10 - 1.
