- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Необратимая реакция второго порядка
Реакция второго порядка описывается уравнением:
![]() (9
- 21)
(9
- 21)
с граничными условиями: C = C0 при = 0.
Решение уравнения (9 - 21) дает:
![]() .
(9 - 22)
.
(9 - 22)
Постоянная интегрирования находится подстановкой граничных условий в уравнение (9 - 22):
![]() .
.
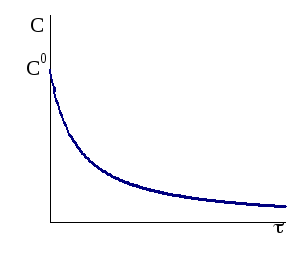
Кинетическое уравнение для необратимой реакции второго порядка приобретает следующую форму:
![]() .
(9 - 23)
.
(9 - 23)
В отличие от реакции первого порядка время полупревращения 1/2 для реакции второго порядка зависит от начальной концентрации. В этом можно легко убедиться подстановкой в уравнение (9 - 23) 1/2 вместо и С0/2 вместо С:
![]() (9
- 24)
(9
- 24)
или
![]() .
(9 - 25)
.
(9 - 25)
Кинетическое уравнение реакции второго порядка, содержащее время полупревращения вместо константы скорости, можно получить следующим образом.
Используя равенство (9 - 25) и уравнение (9 - 23), получим:
![]() ;
;
![]() ;
;
![]() .
(9 - 26)
.
(9 - 26)
Рис.
9 - 3.
Кинетическая кривая реакции второго
порядка.
![]()
Два случая бимолекулярной реакции
Возможные случаи бимолекулярной реакции можно представить следующим образом:
2A Продукты реакции,
A + B Продукты реакции.
Первый случай описывается уравнениями (9 - 21) и (9 - 23). При равенстве концентраций веществ A и B также применимы уравнения (9 - 21) и (9 - 23).
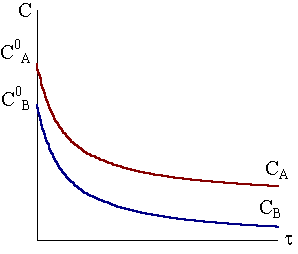
Если концентрации веществ А и В не равны (СА ≠ СВ), то применяется другое уравнение, для вывода которого используем следующие условия.
Пусть к началу реакции концентрация вещества А и концентрация вещества В соответственно равны a и b, а к моменту времени концентрация вещества уменьшится на х и станет равной CA = a – x. В соответствии с уравнением реакции концентрация вещества В также уменьшится на х и окажется равной CB = b − x. Кинетическое уравнение примет следующий вид:
![]() (9
- 27)
(9
- 27)
или
![]() ;
;
![]() .
(9 - 28)
.
(9 - 28)
При интегрировании уравнения (9 - 28) воспользуемся известным из курса математического анализа методом неопределенных коэффициентов, согласно которому дробь, входящую в левую часть равенства (9 - 28), можно представить суммой двух дробей, содержащих неопределенные множители и :
![]() .
.
Проведя очевидные преобразования, получим:
![]() .
(9 - 29)
.
(9 - 29)
Так как в числителе левой части равенства (9 - 29) не содержится х, то
+ = 0, (а)
а равенство числителя левой части 1 означает:
b + a = 1. (b)
Из условий (a) и (b) следует, что неопределенные коэффициенты равны:
![]() ,
,
![]() .
.
Интегрирование уравнения (9 - 28) дает:
![]() .
(9 - 30)
.
(9 - 30)
Граничные условия (х = 0 при = 0) позволяют найти постоянную интегрирования:
![]() .
.
Окончательный вид уравнения, описывающего кинетику бимолекулярной необратимой реакции с разными исходными концентрациями веществ, таков:
![]() .
(9 - 31)
.
(9 - 31)
Нетрудно
заметить, что прямая подстановка в
уравнение (9 ‑ 31) равных исходных
концентраций (a
= b)
приводит к неопределенности типа ![]() .
.
Рис.
9 - 4.
Кинетические кривые веществ в случае
реакции А+В
Продукты при неравных исходных
концентрациях веществ.