
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Характеристика электрохимических цепей
Основные принципы классификации электрохимических цепей
В основу классификации электрохимических цепей (электрохимических систем) положены два основных признака:
природа возникновения ЭДС,
наличие границы между электролитами обоих электродов.
По первому признаку различают физические и химические цепи, а по второму - цепи с переносом, если граница имеется, и цепи без переноса, если граница отсутствует.
Физические электрохимические цепи
В физических цепях источником возникновения ЭДС является работа физического процесса, который может быть принципиально реализован и без гальванического элемента.
Рассмотрим важнейшие из физических цепей.
Гравитационные цепи
Работу в такой цепи осуществляет металл, опускающийся под действием силы тяжести.
Первая гравитационная цепь была составлена в 1875 г. Р.А.Колли. Она содержит две стеклянные трубки с расположенными внизу пористыми керамическими мембранами. При заполнении трубок ртутью и погружении их в раствор, содержащий соли ртути, металлическая ртуть не вытекает через поры мембраны, но в то же время контактирует с раствором электролита. Если уровни ртути в трубках различны, то происходит переход ионов из металлической ртути в раствор из донной части трубки с более высоким уровнем и разряд ионов на поверхности ртути в трубке с низким уровнем. Ртуть в трубке с более высоким уровнем оказывается катодом, а с более низким уровнем - анодом.
Электродная реакция для ртутного электрода такова:
Hg22+ + 2e = 2Hg.
Следовательно, при образовании или растворении 2 моль по цепи протекают 2 фарадея электричества.
Работа, совершаемая ртутью при опускании ее от верхнего уровня h1 до нижнего h2, равна:
![]() .
.
ЭДС такой цепи равна:
![]() .
.
ЭДС гравитационной цепи очень мала (при разности уровней ртути в 1 м она составляет около 20 мкВ). В связи с этим силу тяжести можно заменить на центробежную силу. Такие цепи называются центробежными.
Аллотропические цепи
В цепях этого типа источником работы является переход из одной кристаллической формы металла в другую.
Аллотропическую цепь можно записать в следующей форме:
MMz+, Ax−M,
где M и M - кристаллические формы металла.
По данным ЭДС аллотропической цепи можно экспериментально определить термодинамические характеристики перехода
M M.
Так как электрическая работа цепи равна убыли энергии Гиббса - G, то
G = −zFE.
К.В. Захарченко использовал аллотропическую цепь для определения термодинамической активности аморфного кобальта (аморфные металлы образуются при чрезвычайно быстром охлаждении расплавленного металла). Цепь, содержащая один электрод из аморфного кобальта, а другой из кристаллического металла, позволила по данным ЭДС найти термодинамическую активность аморфного кобальта, которая оказалась в зависимости от скорости охлаждения равной от 15 до 27. По температурной зависимости ЭДС, используя уравнение Гиббса - Гельмгольца, были вычислены изменения энтальпии и энтропии при переходе кобальта из кристаллического в аморфное состояние.
Концентрационные цепи
Существует несколько типов концентрационных цепей.
Например, используя в качестве электродов амальгаму кадмия разной концентрации, можно получить цепь
Cd(Hg)Cd2+Cd(Hg),
aCd’ aCd’’
ЭДС которой равна
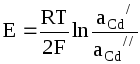 .
.
К подобного рода цепям можно отнести электрохимическую систему, содержащую два водородных электрода с разными давлениями водорода и общим электролитом.
Второго рода цепи представляют одинаковые электродные материалы, погружаемые в растворы одинаковых электролитов, но имеющих разную термодинамическую активность. Эти цепи используются для определения чисел переноса ионов.
