
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
Формальная кинетика предполагает, что порядок реакции зависит от молекулярности самой медленной стадии. Согласно теории активных столкновений химическая реакция начинается с соударения двух (значительно реже - трех) молекул. Так как большая часть реакций имеет первый порядок, то это означает, что реакция не ограничивается только столкновением двух частиц.
Механизм реакции, объясняющий появление первого порядка при столкновении двух молекул, был предложен Линдеманом в 1922 г. и называется схемой Линдемана.
Согласно этой схеме столкновение двух молекул не приводит к мгновенному химическому превращению, а его результатом является перераспределение энергии молекул в момент удара и образование частицы с избыточной энергией А*:
k1
А + А А* + А. (I)
Частица с избыточной энергией А* (ее можно также называть возбужденной молекулой) способна претерпевать дальнейшее превращение до продукта В:
k2
А* В. (II)
Кроме того, сталкиваясь с другими частицами, активная частица А* может вернуть избыток энергии и вернуться в исходное состояние:
k -1
А* + А А + А. (III)
Всю совокупность реакций можно представить следующим образом: k1
А + А А* + А. (IV)
k -1 k2
В
Скорость накопления активных частиц в соответствии с этой схемой описывается уравнением:
![]() (12
- 20)
(12
- 20)
Зависимость концентрации активных частиц от времени с начала реакции показана на рис. 12 - 2.
Как видно из рис. 12 - 2, вначале концентрация активных частиц в течение короткого времени очень быстро возрастает, затем в течение длительного времени медленно уменьшается. Производная концентрации по времени до точки максимума по абсолютной величине может во много раз превышать производную концентрации по времени после точки максимума. В связи с этим, сравнивая производную после достижения максимума с производной на начальном участке кривой, можно для убывающей части кривой принять:
![]() .
(а)
.
(а)
Условие (а) называется квазистационарным состоянием.
Рис.
12 - 2. Изменение
концентрации промежуточного вещества
со временем.

 .
(12 - 21)
.
(12 - 21)
Решение уравнения (12 - 21) относительно концентрации активных частиц дает:
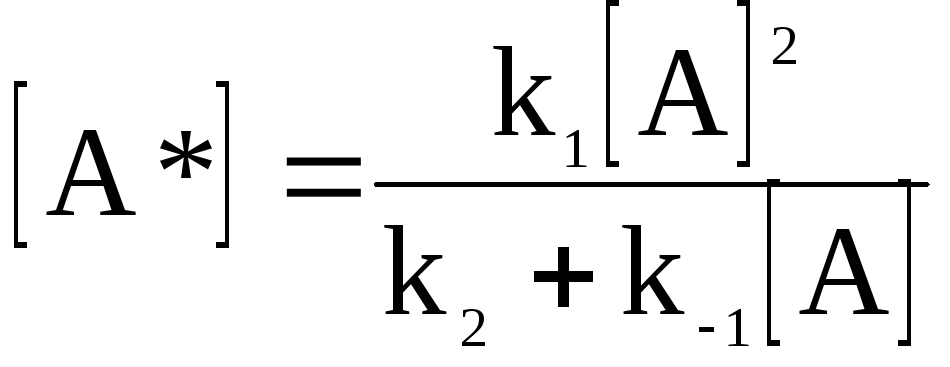 .
(12 - 22)
.
(12 - 22)
Скорость образования вещества В характеризуется уравнением:

или
 .
(12 - 23)
.
(12 - 23)
Если константа скорости k2 окажется достаточно большой, чтобы выполнялось условие k2 >> k−1[A], то уравнение (12 - 23) превращается в уравнение скорости реакции второго порядка:
![]() .
(12 - 24)
.
(12 - 24)
В случае очень малой константы k2 выполняется условие: k2 << k−1[A], а уравнение (12 - 23) превращается в уравнение скорости реакции первого порядка:
![]() .
(12 - 25)
.
(12 - 25)
Полученные результаты легко объяснимы.
Если скорость превращения активной частицы очень велика, то она существует крайне непродолжительное время и не успевает сталкиваться с другими частицами. В этом случае скорость реакции определяется только стадией (I) и реакция является бимолекулярной.
Если частица, не превращаясь, существует в течение длительного времени, то велика вероятность ее столкновения с другими частицами. В этом случае скорость реакции возрастает вместе с увеличением скорости накопления промежуточных активных частиц и скорости их превращения в продукты реакции и убывает с ростом скорости превращения активных частиц в исходные неактивные.
Схема Линдемана подтверждается данными, полученными при изучении реакций в газовых фазах.
При очень низких давлениях газа столкновения активных частиц с другими молекулами происходят редко и они успевают превратиться в продукты реакции. В этом случае следует ожидать второй порядок реакции. При высоких давлениях частота столкновений возрастает и полностью выполняется условие: k2 << k−1[A], а реакция описывается уравнением (12 - 15). Опыт показал, что проводя реакцию от давлений в несколько сотых мм рт. ст. (от нескольких Па) до десятков атмосфер (несколько МПа), можно наблюдать переход от кинетики реакции второго порядка до реакции первого порядка.
