
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Термодинамика гальванического элемента
В квазистатическом процессе, который осуществляется при очень высоком электрическом сопротивлении внешней части цепи или при работе с другим источником, развивающим равную, но противоположно направленную электродвижущую силу, то есть при почти нулевом электрическом токе в цепи полезная работа гальванического элемента определяется равенством
![]() ,
(1 - 1)
,
(1 - 1)
в котором E - электродвижущая сила (ЭДС) элемента, q - переносимый заряд.
Если в гальваническом элементе протекает реакция
1A1 + 2A2 + ...+i Ai + ...= 1B1 + 2B2 +... + jBj +...,
то ее полезная работа в пересчете на количества превращаемых веществ, равных стехиометрическим коэффициентам, совпадает с полезной работой
![]() .
(1 - 2)
.
(1 - 2)
Переносимый по цепи заряд определяется произведением числа электронов, переносимых от ионов, атомов или молекул окисляемого вещества к ионам, атомам или молекулам восстанавливаемого вещества z, на заряд одного электрона e. Так как при использовании сродства количество веществ выражается в молях, то это произведение необходимо умножить на постоянную Авогадро NA.
Таким образом,
![]() .
(1 - 3)
.
(1 - 3)
Принимая во внимание, что произведение заряда одного электрона на постоянную Авогадро равно постоянной Фарадея F, то выражению для ЭДС гальванического элемента можно придать следующий вид:
![]() .
(1 - 4)
.
(1 - 4)
Для многократно рассматривавшейся реакции
Cu2+ + Zn = Cu + Zn2+
z=2, так как от атома цинка к иону меди переносятся два электрона.
В более сложном примере для реакции
2KMnO4 + 10FeSO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
(2![]() + 10
+ 10![]()
![]() 10
10![]() + 2
+ 2![]() )
)
(нижняя запись показывает изменение степени окисления элементов) число переносимых зарядов составит 10F.
Используя традиционную форму записи выражения для сродства химической реакции (см. часть 1 «Курса физической химии», стр. 76),
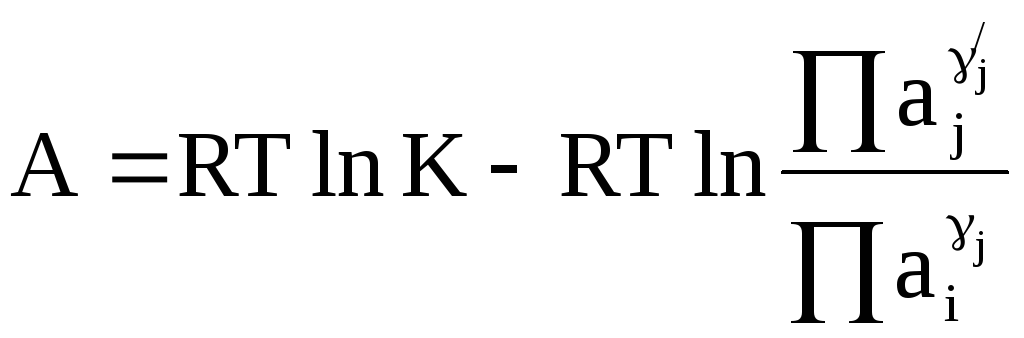 ,
(1 - 5)
,
(1 - 5)
в котором K - константа равновесия, a1, a2, ...,ai,... - активности веществ, 1,2,... ...,i, ...,j... - стехиометрические коэффициенты, получим выражение для ЭДС гальванического элемента:
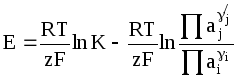 .
(1 - 6)
.
(1 - 6)
В стандартном состоянии термодинамические активности равны 1 и правый член выражения (1 - 6) обращается в нуль. Следовательно, ЭДС для стандартных условий (она также называется стандартной ЭДС) находится по формуле
![]() .
(1 - 7)
.
(1 - 7)
В электрохимии принято записывать уравнения со знаком «плюс» перед вторым членом. С учетом этой особенности и выражения (1 - 7) окончательная форма уравнения для ЭДС принимает следующий вид:
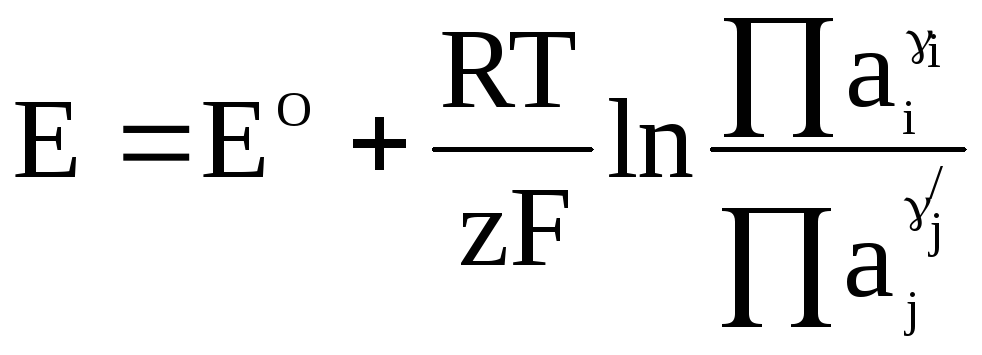 .
(1 - 8)
.
(1 - 8)
Уравнение (1 - 8) называется уравнением Нернста.
