
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Термодинамика гальванического элемента
- •Гальванический элемент
- •Термодинамика гальванического элемента
- •Электродный потенциал. Электродные реакции
- •Основные типы электродов
- •Классификация электродов
- •Электроды 1-го рода
- •Электроды 2-го рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Ионоселективные электроды
- •Ионы в растворах электролитов
- •Классическая теория электролитической диссоциации
- •Взаимодействие растворяемого вещества с растворителем
- •Межионное взаимодействие в растворах
- •Термодинамика растворов электролитов
- •Формальные представления об активности ионов в растворах электролитов
- •Экспериментальные данные по коэффициентам активности
- •Явления переноса в растворах электролитов
- •Диффузия в растворах электролитов
- •Диффузионный потенциал
- •Электрическая проводимость растворов электролитов
- •Электрохимическая поляризация
- •Эдс поляризации и электродная поляризация
- •Теории электродной поляризации
- •Характеристика электрохимических цепей
- •Основные принципы классификации электрохимических цепей
- •Физические электрохимические цепи
- •Гравитационные цепи
- •Аллотропические цепи
- •Концентрационные цепи
- •Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Химические источники тока
- •Эталонные гальванические элементы
- •Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Формальная кинетика
- •Основные понятия
- •Классификация химических реакций по их кинетике
- •Необратимая реакция первого порядка
- •Необратимая реакция второго порядка
- •Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •Необратимая реакцияn-ого порядка
- •Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Кинетика сложных реакций
- •Параллельные реакции
- •Обратимая реакция
- •Последовательные реакции
- •Влияние температуры на скорость химических реакций
- •Эмпирические закономерности влияния температуры на скорость реакций
- •Уравнение Аррениуса
- •Элементарные акты химических превращений
- •Теория активных столкновений
- •Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •Теория переходного состояния (теория активного комплекса)
- •Химическая индукция
- •Фотохимические процессы
- •Основные законы фотохимии
- •Механизм фотохимических реакций
- •Цепные реакции
- •Общие сведения о цепных реакциях
- •Зарождение цепи и методы обнаружения свободных радикалов
- •Развитие и обрыв цепи
- •Катализ
- •Общие сведения
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Ферментативный катализ
- •Гетерогенный катализ
- •Предметный указатель
- •Оглавление
Электродный потенциал. Электродные реакции
Рассмотрим на примере уже многократно рассматривавшегося медно-цинкового элемента (его также называют элементом Якоби - Даниеля) строение всей гальванической цепи.
Совершая обход по цепи, можно заметить, что рассматриваемый элемент содержит следующие фазы: электролит левого (более отрицательного) электрода (в данном случае с ионами Zn2+), металлический электродный материал левого электрода (цинк), металлический материал правого электрода (медь), электролит, контактирующий с правым электродом и содержащий ионы Cu2+. Таким образом, в цепи происходят переходы из фазы в фазу на границах: раствор с ионами Zn2+ цинк, цинкмедь, медь раствор с ионами Cu2+, раствор с ионами Cu2+ раствор с ионами Zn2+. Каждый переход сопровождается скачком электрического потенциала. Сумма этих скачков равна ЭДС гальванического элемента.
Соединение двух металлических проводников в цепи (цинк и медь) третьим, например, серебряной или железной проволокой, приводит к появлению новых скачков потенциала. Однако величина ЭДС останется прежней (закон Вольты).
В условиях равновесия или квазистатического процесса скачок потенциала на границе металлраствор для одного электрода не зависит от соответствующего скачка потенциала для другого электрода (принцип независимого протекания электродных реакций в квазистатических условиях).
Пренебрегая скачком потенциала между двумя растворами электродвижущую силу элемента можно представить как разность двух независимых величин, одна из которых п относится к правому электроду, а другая л - к левому электроду:
![]() .
(1 - 9)
.
(1 - 9)
Величины п и л называются электродными потенциалами.
Подобно тому, как ЭДС элемента определяется всей реакцией, протекающей в нем, электродные потенциалы определяются реакциями, протекающими на электродах. Эти реакции называют частными.
При записи частных реакций необходимо руководствоваться следующим принципом:
Реакция в гальваническом элементе в целом является разностью частных реакций, протекающих на электродах.
В рассматриваемом примере на правом электроде, которым, как уже неоднократно указывалось, является катод, протекает следующая частная реакция:
Cu2+ + 2e = Cu.
Реакция, протекающая на левом электроде, записывается однотипно:
Zn2+ + 2e = Zn.
Реакция в целом получается как разность частных (электродных) реакций:
Cu2+ + 2e = Cu
Zn2+ + 2e = Zn
Cu2+ + Zn = Cu + Zn2+.
Так как возможны различные варианты записи электродных реакций, например, практиковались следующие: Zn = Zn2+ + 2e, Zn – 2e = Zn2+, то одновременное использование различных форм может привести к путанице. В связи с этим следует руководствоваться правилами записи электродных реакций:
Окисленная форма элемента (в приведенных примерах ионы Cu2+ и Zn2+) должна записываться в левой части равенства, а восстановленная форма элемента (соответственно Cu и Zn) - в правой;
Электроны с положительным коэффициентом записываются в левой ча ти равенства.
Приведем еще несколько примеров записи электродных реакций:
MnO4− + 8H+ +5e = Mn2+ + 4H2O, (а)
Cl2 + 2e = 2Cl, (б)
1/2O2 + H2O + 2e = 2OH, (в)
AgI + e = Ag + I. (г)
При записи электродных реакций следует обращать внимание не только на материальный баланс, но и на равенство сумм зарядов левой и правой частей равенства.
Зависимость электродного потенциала от активностей (в случае газообразных продуктов от давления) имеет такой же вид, что и ЭДС. В частности, для медного и цинкового электродов выражения для электродных потенциалов можно записать следующим образом:
![]()

Реакциям (а) - (г) соответствуют выражения для электродных потенциалов:

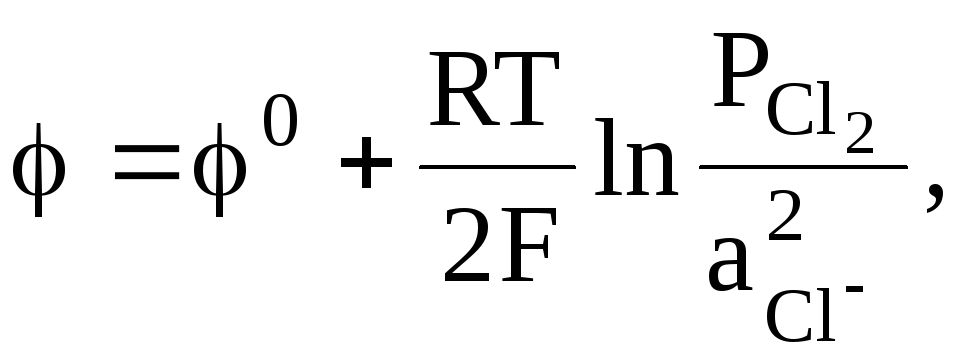
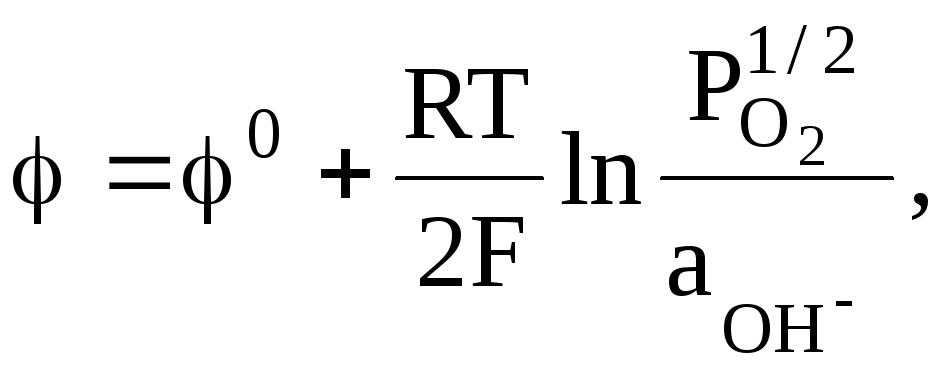
![]()
Активности металлической меди и металлического цинка, имеющих кристаллическую решетку и, следовательно, находящихся в стандартном состоянии, равны 1 и не включаются в приведенные выше выражения для электродных потенциалов. По той же причине не включается активность кристаллической соли AgCl.
Для всех рассмотренных выше электролитов вода является растворителем и находится в существенном избытке. Поэтому в ходе реакции ее активность практически не изменяется и как константа входит в другую константу выражения для электродного потенциала 0 .
Константа 0 отвечает значению электродного потенциала при стандартных термодинамических условиях, в частности, равенствах активностей веществ в конденсированном состоянии 1. В связи с этим она называется стандартным электродным потенциалом.
Нетрудно заметить, что разность стандартных электродных потенциалов правого и левого электродов равна стандартной ЭДС:
![]() (1
- 10)
(1
- 10)
В отличие от ЭДС, абсолютная величина которой может быть определена, абсолютные значения стандартных электродных потенциалов принципиально не могут быть установлены. В связи с этим может быть построена только относительная шкала стандартных электродных потенциалов. Идея построения такой шкалы сводится к следующему.
Пусть
для какого-то электрода (назовем его
электродом
сравнения)
потенциал (не обязательно стандартный)
условно принимается равным .
Тогда ЭДС гальванического элемента,
составленного из стандартного электрода,
потенциал которого равен
![]() ,
и электрода сравнения, окажется равной
,
и электрода сравнения, окажется равной![]() .
Если стандартный электродный потенциал
другого электрода равен
.
Если стандартный электродный потенциал
другого электрода равен![]() ,
то ЭДС гальванического элемента,
составленного из этого электрода в
стандартных условиях и электрода
сравнения, должна быть равной
,
то ЭДС гальванического элемента,
составленного из этого электрода в
стандартных условиях и электрода
сравнения, должна быть равной![]() .
.
Разность между этими ЭДС равна стандартной ЭДС гальванического элемента, составленного из двух сравниваемых электродов,
![]() .
.
Для одного из множества электродов сравнения можно условно принять = 0. Такой электрод называется стандартным электродом сравнения. Тогда ЭДС гальванического элемента, составленного из данного электрода, располагаемого справа, и стандартного электрода сравнения, располагаемого слева, окажется равной электродному потенциалу сравниваемого электрода по условной шкале, то есть = .
Предлагалось несколько электродов в качестве стандарта для отсчета электродных потенциалов. По предложению В. Нернста был принят стандартный водородный электрод, с которым мы ознакомимся позднее.
В заключение рассмотрим правила условной записи отдельных электродов.
Принято записывать отдельный электрод как правую часть гальванического элемента, левым полуэлементом которого является воображаемый (не записываемый) стандартный электрод сравнения.
Приведем примеры такой записи.
Медный электрод, на котором протекает реакция Сu2+ + 2e = Cu, может быть записан следующим образом:
Cu2+Cu.
(Место стандартного
электрода сравнения)
Цинковый электрод, на котором протекает реакция Zn2+ + 2e = Zn, записывается так:
Zn2+Zn.
Если на платиновом электроде протекает реакция MnO4 + 8H++ +5e = Mn2+ + 4H2O, то такой электрод может быть записан следующим образом:
MnO4, Mn2+, H+Pt.
Из изложенного следует, что при записи отдельных электродов слева указывается состав раствора электролита, а справа после вертикальной черты - вещества, находящиеся вне раствора электролита, причем крайним справа указывается металл, на поверхности которого протекает реакция.
