
- •Раздел II. Молекулярная физика
- •Глава1. Некоторые понятия молекулярной физики
- •§1 Массы атомов и молекул. Молярная масса
- •§2. Молекулярные силы
- •§3. Агрегатные состояния вещества. Особенности теплового движения в различных агрегатных состояниях вещества
- •§4. Равновесные процессы
- •Глава 2. Оcновы статической теории идеального газа
- •§1. Модель идеального газа
- •§2. Основное уравнение кинетической теории газов для давления
- •§3. Температура и её измерение. Опытные температурные шкалы.
- •2. Измерение давления газа при постоянном объёме производится с большей точностью, чем измерение объёма при постоянном давлении.
- •§4. Температура ― мера средней кинетической энергии поступательного движения молекул.
- •§5 Уравнение Менделеева-Клапейрона. Следствие из этого уравнения.
- •§6. Распределение Максвелла.
- •§7. Свойства распределения Максвелла.
- •§8. Распределение Больцмана. Барометрическая формула.
- •§ 9. Число степеней свободы молекул. Теорема о равномерном распределении энергии теплового движения по степеням свободы.
- •Глава 3. Основы термодинамики
- •§1. Внутренняя энергия, работа, теплота
- •§2. Первое начало термодинамики
- •§3. Теплоёмкость. Вычисление теплоёмкости идеального газа
- •§4. Изотермический процесс. Работа идеального газа при изотермическом изменении его объема
- •§5. Адиабатический процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •§6. Круговые обратимые процессы (циклы). Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу. Тепловые и холодильные машины
- •§7. Недостаточность первого начала термодинамики для однозначного описания процессов, происходящих в природе.
- •§8. Второе начало термодинамики. Формулировка основного постулата, выражающего второе начало термодинамики. Постулаты Кельвина и Клаузиуса и их эквивалентность
- •§9 . Цикл Карно и его кпд
- •§10. Математическое выражение второго начала термодинамики для обратимых процессов. Равенство Клаузиуса. Энтропия. Постоянство энтропии при обратимых процессах в замкнутой системе
- •§11. Основное уравнение термодинамики для обратимых процессов. Вычисление энтропии идеального газа.
- •§12. Второе начало термодинамики для необратимых процессов. Неравенство Клаузиуса. Возрастание энтропии при необратимых процессах в замкнутой системе. Общая формулировка второго начала термодинамики
- •§13. Примеры. Вычисление изменения энтропии при необратимых процессах
- •§14. Закон возрастания энтропии и превращение теплоты в работу
- •Глава 4. Реальные газы
- •§1. Экспериментальные изотермы. Область двухфазных состояний. Критическое состояние вещества
- •§2. Фазовая диаграмма жидкость-газ или кривая равновесия фаз
- •§З. Уравнение Ван-дер-Ваальса
- •§4. Изотермы Ван-дер-Ваальса и их сравнение с экспериментальными изотермами. Пересыщенный пар и перегретая жидкость
- •§5. Внутренняя энергия газа Ван-дер-Ваальса. Изотермическое расширение газа Ван-дер-Ваальса. Адиабатическое расширение газа Ван-дер-Ваальса в пустоту.
- •Глава 5. Столкновения молекул и явления переноса в газах
- •§1. Среднее число столкновений и средняя длина свободного пробега молекул
- •§2 Виды явлений переноса. Общее уравнение явлений переноса в газах
- •§3. Теплопроводность
- •§4. Вязкость
- •§5. Диффузия в газах
- •С точки зрения молекулярно кинетической теории за переносимую величину нужно взять концентрацию компоненты , рассчитанную на одну молекулу, т.Е.
- •Глава6. Твердые тела
- •§1. Аморфное и кристаллическое состояние вещества
- •§2. Классификация кристаллов по типу молекул, составляющих кристалл
- •§3. Анизотропия кристаллов
- •§4. Теплоемкость атомных кристаллов
- •Приложение а. Основные понятия теории вероятностей
- •§1. Понятие вероятности события
- •§2. Простейшие теоремы теории вероятностей
- •§3. Интегральная функция распределения случайной величины
- •§4. Плотность вероятности
- •§5. Среднее значение
Глава1. Некоторые понятия молекулярной физики
§1 Массы атомов и молекул. Молярная масса
Так как массы атомов и молекул чрезвычайно малы (10–25 – 10–27 кг), то их удобно измерять не в килограммах, а в специальных относительных единицах. В качестве единичной атомной массы mед принимается двенадцатая часть массы изотопа углерода 12С. Измерения этой величины дали следующее значение:
(1) |
Относительной атомной единицей массы Аr называется отношение массы данного атома mат к атомной единице массы mед, т. е.
(2) |
Величины Аr для химических элементов приведены в таблице Менделеева.
Относительная молекулярная масса молекулы Mr определяется по аналогичной формуле:
(3) |
Относительные молекулярные массы с достаточной точностью могут быть найдены в виде суммы относительных атомных масс, составляющих молекулу. Зная Mr для данной молекулы, легко найти её массу
(4) |
В системе единиц СИ количество вещества выражается в молях. Молем называют количество вещества, содержащее столько частиц (молекул, атомов, электронов, фотонов и т.д.), сколько атомов содержится в 12г изотопа углерода 12C. Это число называют постоянной Авогадро NA. Согласно определению
(5) |
Учтя (1), получим
(6) |
Массу одного моля называют молярной массой. Очевидно, что
(7) |
С учетом (3) и (5), выражение (7) примет вид
(8) |
Число молей связано с числом N молекул, содержащихся в данном количестве вещества, соотношением
(9) |
Умножив числитель и знаменатель выражения (9) на массу mмол молекулы, получим
(10) |
§2. Молекулярные силы
Силы, действующие между молекулами, по своей природе являются силами электрическими. Молекула состоит из положительно заряженных ядер атомов, составляющих молекулу, и отрицательно заряженных электронных оболочек атомов. Поэтому при взаимодействии молекул одновременно действуют как силы притяжения разноименных зарядов, так и силы отталкивания одноименных. И те и другие с увеличением расстояния между центрами масс молекул быстро уменьшаются. Однако убывание сил отталкивания оказывается более быстрым, чем сил притяжения, в результате чего оказывается, что силы отталкивания преобладают на весьма малых расстояниях между молекулами, а силы притяжения ― на более дальних расстояниях, однако и они довольно быстро убывают с расстоянием. Качественно это можно объяснить так.
При расстоянии между молекулами значительно большем их диаметра (рис. 1.а), молекулы практически не взаимодействуют, так как вращающиеся вокруг ядер электроны полностью компенсируют заряды этих ядер и молекулы в целом электрически нейтральны. (При этом электрическое поле нейтральной молекулы, вообще говоря, полностью не исчезает, но оно очень быстро убывает за пределами молекулы. Практически оно равно нулю на расстояниях двух-трёх диаметров молекулы.)
П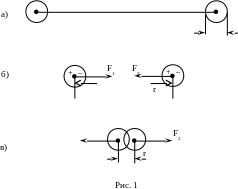 ри
дальнейшем сближении двух молекул
(рис.1,б) начинает постепенно проявляться
взаимодействие электрических зарядов
ядер и электронных оболочек молекул.
Это происходит из-за притяжения
разноимённых и отталкивания одноимённых
зарядов. Произойдёт небольшая деформация
(поляризация) обеих взаимодействующих
молекул, как это показано на рис. 1,б. В
результате между молекулами возникнут
силы притяжения.
ри
дальнейшем сближении двух молекул
(рис.1,б) начинает постепенно проявляться
взаимодействие электрических зарядов
ядер и электронных оболочек молекул.
Это происходит из-за притяжения
разноимённых и отталкивания одноимённых
зарядов. Произойдёт небольшая деформация
(поляризация) обеих взаимодействующих
молекул, как это показано на рис. 1,б. В
результате между молекулами возникнут
силы притяжения.
По мере дальнейшего сближения деформация молекул и величина сил притяжения будут возрастать. Однако, когда молекулы подойдут «вплотную» друг к другу и «соприкоснутся» своими электронными оболочками, то дальнейшее сближение окажется «практически» невозможным. Между электронными оболочками возникнут огромные силы отталкивания, резко возрастающие по мере дальнейшего взаимного проникновения оболочек. На таких расстояниях будут преобладать силы отталкивания (рис. 1,в).
Абсолютная величина сил взаимодействия существенно зависит от конкретного строения молекул. Кроме того, для несферических молекул силы взаимодействия зависят, очевидно, не только от расстояния r между центрами масс молекул, но и от взаимной ориентации молекул. Однако общий характер зависимости силы взаимодействия от расстояния одинаков ― притяжение на больших расстояниях и отталкивание на малых.

Рис. 2
На рис. 2,а,б приведены зависимости сил отталкивания, которые в физике положительны (F1>0), и сил притяжения (F2<0) от расстояния r между молекулами. Эти силы действуют одновременно. Поэтому, чтобы найти результирующую, их нужно сложить. Если сложить ординаты положительной быстро падающей силы отталкивания F1 с отрицательными ординатами медленно растущей силы притяжения F2, то результирующая функция F=F1+F2 будет иметь вид, показанный на рис. 2,в.
Как
видим из рис.2,в, на расстояниях r
< r0
между молекулами преобладают силы
отталкивания, а при r
> r0
― силы притяжения, при
![]() эти силы равны. Как известно из механики,
сила F
связана с потенциальной энергией Ep
соотношением
эти силы равны. Как известно из механики,
сила F
связана с потенциальной энергией Ep
соотношением
(11) |
На
рис.2,г приведена проинтегрированная
функция F(r),
т. е. потенциальная энергия Ep
взаимодействия молекул как функция
расстояния r.
Из рисунка видно, что потенциальная
энергия при r
= r0
принимает минимальное значение Ep0.
Точка r
= ro
является точкой устойчивого равновесия
взаимодействующих молекул (в этой точке
сила
![]() ).
).
Из теории и опыта следует, что потенциальная энергия взаимодействия молекул Ep(r) хорошо описывается функцией вида:
(12) |
где a1 и a2 положительные постоянные. Первый член соответствует силам отталкивания, второй ― силам притяжения. Величина показателя n степени зависит от структуры молекулы и находится в пределах 8≤ n ≤ 15. Как видно из формулы (12), силы притяжения, хотя и медленнее (r –7), чем силы отталкивания (r –n+1) убывают с ростом r, но, как показывают расчеты, и они на расстояниях ρ>10 –9 м между молекулами оказываются пренебрежимо малыми. Поэтому сферу с радиусом ρ10 –9 м называют сферой молекулярного действия сил. На расстояниях ρ>10 –9 м силу взаимодействия между молекулами полагают равной нулю.
Приведем в качестве иллюстрации известные из теории и опыта эффективные диаметры d некоторых молекул
Таблица 1.
Молекула |
H2 |
He |
O2 |
N2 |
CO2 |
d, 10 –10 м |
2,74 |
2,18 |
3,61 |
3,75 |
4,65 |
Как видно из таблицы, силами притяжения можно пренебречь уже на расстояниях в несколько диаметров молекул.
