
- •Часть 1
- •Одесса – 2004
- •Содержание
- •Введение
- •I. Механика
- •1. Кинематика материальной точки
- •1.1. Основные понятия кинематики
- •1.2. Нормальное и касательное ускорения
- •1.3. Движение точки по окружности. Угловые скорость и ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа
- •3.2. Связь между работой и изменением кинетической энергии
- •3.3. Связь между работой и изменением потенциальной энергии
- •3.4. Закон сохранения механической энергии
- •3.5. Соударения
- •4. Вращательное движение твёрдого тела
- •4.1. Кинетическая энергия вращательного движения. Момент инерции
- •4.2. Основной закон динамики вращательного движения
- •4.3. Закон сохранения момента импульса
- •4.4. Гироскоп
- •II. Механические колебания и волны
- •5. Общая характеристика колебательных процессов. Гармонические колебания
- •6. Колебания пружинного маятника
- •7. Энергия гармонического колебания
- •8. Сложение гармонических колебаний одинакового направления
- •9. Затухающие колебания
- •10. Вынужденные колебания
- •11. Упругие (механические) волны
- •12. Интерференция волн
- •13. Стоячие волны
- •14. Эффект Допплера в акустике
- •III. Молекулярная физика
- •15. Основное уравнение молекулярно-кинетической теории газов
- •16. Распределение молекул по скоростям
- •17. Барометрическая формула
- •18. Распределение Больцмана
- •Іv. Основы термодинамики
- •19. Основные понятия термодинамики
- •20. Первое начало термодинамики и его применение к изопроцессам
- •21. Число степеней свободы. Внутренняя энергия идеального газа
- •22. Классическая теория теплоёмкости газов
- •23. Адиабатный процесс
- •24. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •25. Идеальная тепловая машина Карно
- •26. Второе начало термодинамики
- •2. Невозможен процесс, единственным результатом которого была бы передача теплоты от холодного тела к горячему.
- •27. Энтропия
- •V. Электростатика
- •28. Дискретность электрического заряда. Закон сохранения электрического заряда
- •29. Закон Кулона. Напряжённость электростатического поля. Вектор электрического смещения
- •30. Силовые линии. Поток вектора . Теорема Остроградского-Гаусса
- •31. Применения теоремы Остроградского-Гаусса для расчёта полей
- •32. Работа по перемещению заряда в электростатическом поле. Циркуляция вектора
- •33. Связь между напряжённостью поля и потенциалом
- •34. Электроёмкость проводников. Конденсаторы
- •35. Энергия электростатического поля
- •VI. Постоянный электрический ток
- •36. Основные характеристики тока
- •37. Закон Ома для однородного участка цепи
- •38. Закон Джоуля - Ленца
- •39. Правила Кирхгофа
- •40. Контактная разность потенциалов
- •41. Эффект Зеебека
- •42. Эффект Пельтье
20. Первое начало термодинамики и его применение к изопроцессам
Первое начало термодинамики — это обобщение закона сохранения энергии с учётом тепловых процессов. Его формулировка: количество теплоты, сообщённое системе, расходуется на выполнение работы против внешних сил и изменение её внутренней энергии:
dQ=dA+dU. |
(20.1) |
Первому началу термодинамики можно дать другую формулировку, если учесть, что dA=dQ-dU, т.е.
dA |
(20.2) |
На основании (20.2) первое начало термодинамики можно сформулировать следующим образом: невозможно построить тепловой двигатель, который совершал бы работу большую, чем количество затраченной теплоты.
Применим первое начало термодинамики к различным изопроцессам.
1. Изохорный процесс (V=const). В этом процессе объём системы остаётся постоянным, поэтому dA=PdV=0 и dQ=dU. В изохорном процессе теплота, подведенная к системе, полностью расходуется на изменение её внутренней энергии.
2. Изобарный процесс (Р=сonst). Так как объём изменяется, то при подведении теплоты к системе она частично превращается в работу и поэтому первое начало термодинамики имеет вид: dQ=dA+dU.
Вычислим согласно (19.2) работу, совершаемую системой при изобарном процессе
|
(20.3) |
3. Изотермический процесс (T=const). При постоянной температуре изменения внутренней энергии идеального газа не происходит: dU=0, поэтому dQ=dA.
В изотермическом процессе вся теплота, подведенная к газу, расходуется на совершение работы.
Поскольку давление Pconst, то в (19.2) его нельзя выносить за знак интеграла. Выразим давление Р через объём V с помощью уравнения Менделеева-Клапейрона:
|
(20.4) |
Подставляя (20.4) в (19.2), получим:
|
(20.5) |
21. Число степеней свободы. Внутренняя энергия идеального газа
Числом степеней свободы называется число независимых координат, которыми описывается движение тела в пространстве. Материальная точка имеет три степени свободы, поскольку при её движении в пространстве изменяются три координаты x, y и z.
Рис.
21.1
Средняя кинетическая энергия поступательного движения молекулы равна 3/2 kТ — формула (15.11). Это движение можно рассматривать как движение с тремя степенями свободы, поскольку молекулы идеального газа можно принять за материальные точки. Все три степени свободы равноправны, поэтому можно считать, что на одну степень свободы приходится энергия
|
(21.1) |
В статистической физике доказывается, что на любую степень свободы движения молекулы (поступательную, вращательную и т.д.) приходится одна и та же энергия, равная 1/2 kТ. Это утверждение носит название закона равнораспределения энергии по степеням свободы.
В общем случае, когда молекула имеет i степеней свободы, её кинетическая энергия
|
(21.2) |
Подсчитаем теперь внутреннюю энергию одного киломоля идеального газа. Эта энергия может быть найдена умножением средней энергии одной молекулы на их число, т.е. число Авогадро:
![]() .
.
Поскольку kNA=R, где R — универсальная газовая постоянная, то
|
(21.3) |
Из (21.З) видно, что внутренняя энергия идеального газа полностью определяется его температурой.

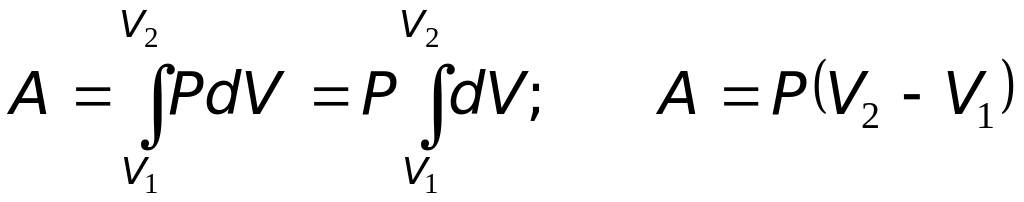 .
.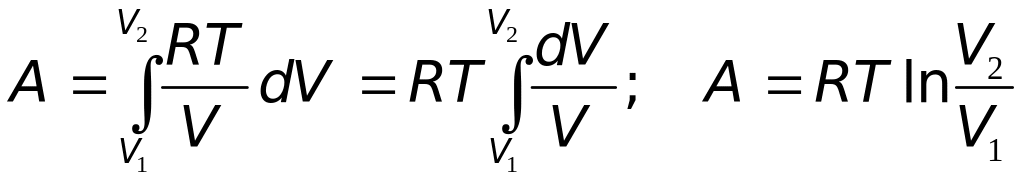 .
.