
- •Часть 1
- •Одесса – 2004
- •Содержание
- •Введение
- •I. Механика
- •1. Кинематика материальной точки
- •1.1. Основные понятия кинематики
- •1.2. Нормальное и касательное ускорения
- •1.3. Движение точки по окружности. Угловые скорость и ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа
- •3.2. Связь между работой и изменением кинетической энергии
- •3.3. Связь между работой и изменением потенциальной энергии
- •3.4. Закон сохранения механической энергии
- •3.5. Соударения
- •4. Вращательное движение твёрдого тела
- •4.1. Кинетическая энергия вращательного движения. Момент инерции
- •4.2. Основной закон динамики вращательного движения
- •4.3. Закон сохранения момента импульса
- •4.4. Гироскоп
- •II. Механические колебания и волны
- •5. Общая характеристика колебательных процессов. Гармонические колебания
- •6. Колебания пружинного маятника
- •7. Энергия гармонического колебания
- •8. Сложение гармонических колебаний одинакового направления
- •9. Затухающие колебания
- •10. Вынужденные колебания
- •11. Упругие (механические) волны
- •12. Интерференция волн
- •13. Стоячие волны
- •14. Эффект Допплера в акустике
- •III. Молекулярная физика
- •15. Основное уравнение молекулярно-кинетической теории газов
- •16. Распределение молекул по скоростям
- •17. Барометрическая формула
- •18. Распределение Больцмана
- •Іv. Основы термодинамики
- •19. Основные понятия термодинамики
- •20. Первое начало термодинамики и его применение к изопроцессам
- •21. Число степеней свободы. Внутренняя энергия идеального газа
- •22. Классическая теория теплоёмкости газов
- •23. Адиабатный процесс
- •24. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •25. Идеальная тепловая машина Карно
- •26. Второе начало термодинамики
- •2. Невозможен процесс, единственным результатом которого была бы передача теплоты от холодного тела к горячему.
- •27. Энтропия
- •V. Электростатика
- •28. Дискретность электрического заряда. Закон сохранения электрического заряда
- •29. Закон Кулона. Напряжённость электростатического поля. Вектор электрического смещения
- •30. Силовые линии. Поток вектора . Теорема Остроградского-Гаусса
- •31. Применения теоремы Остроградского-Гаусса для расчёта полей
- •32. Работа по перемещению заряда в электростатическом поле. Циркуляция вектора
- •33. Связь между напряжённостью поля и потенциалом
- •34. Электроёмкость проводников. Конденсаторы
- •35. Энергия электростатического поля
- •VI. Постоянный электрический ток
- •36. Основные характеристики тока
- •37. Закон Ома для однородного участка цепи
- •38. Закон Джоуля - Ленца
- •39. Правила Кирхгофа
- •40. Контактная разность потенциалов
- •41. Эффект Зеебека
- •42. Эффект Пельтье
16. Распределение молекул по скоростям
Рис.16.1![]()
![]() .
Нанесём их на ось скоростей в виде точек.
Как видно из рис. 16.1,
распределение точек на оси будет
неравномерным — в области больших и
малых скоростей они располагаются
сравнительно редко, а большинство из
них группируется вблизи некоторого
промежуточного значения.
.
Нанесём их на ось скоростей в виде точек.
Как видно из рис. 16.1,
распределение точек на оси будет
неравномерным — в области больших и
малых скоростей они располагаются
сравнительно редко, а большинство из
них группируется вблизи некоторого
промежуточного значения.
Подсчитаем
число молекул dN, скорости которых
попадают внутрь интервала скоростей
от v до
![]() (рис. 16.1). Очевидно, что dN
пропорционально
общему числу молекул N и ширине интервала
dv. Кроме того, dN
зависит
от того, у какого значения скорости
выбран интервал шириной dv (как видно из
рис. 16.1, если продвигать этот интервал,
не меняя его ширины, вдоль оси v, то число
точек, попадающих внутрь этого интервала,
будет изменяться). Таким образом, dN
пропорционально некоторой функции
f(v). В итоге
(рис. 16.1). Очевидно, что dN
пропорционально
общему числу молекул N и ширине интервала
dv. Кроме того, dN
зависит
от того, у какого значения скорости
выбран интервал шириной dv (как видно из
рис. 16.1, если продвигать этот интервал,
не меняя его ширины, вдоль оси v, то число
точек, попадающих внутрь этого интервала,
будет изменяться). Таким образом, dN
пропорционально некоторой функции
f(v). В итоге
|
(16.1) |
Из (16.1) следует
|
(16.2) |
Функция![]() является функцией распределения молекул
по скоростям. Для единичного интервала
скоростей (dv =1) f(v)
= dN/N, т.е. функция
распределения численно равна доле
молекул, скорости которых попадают
внутрь единичного интервала скоростей
при заданном значении скорости.
является функцией распределения молекул
по скоростям. Для единичного интервала
скоростей (dv =1) f(v)
= dN/N, т.е. функция
распределения численно равна доле
молекул, скорости которых попадают
внутрь единичного интервала скоростей
при заданном значении скорости.
Явный вид функции распределения был найден Максвеллом в 1860 г.:
|
(16.3) |
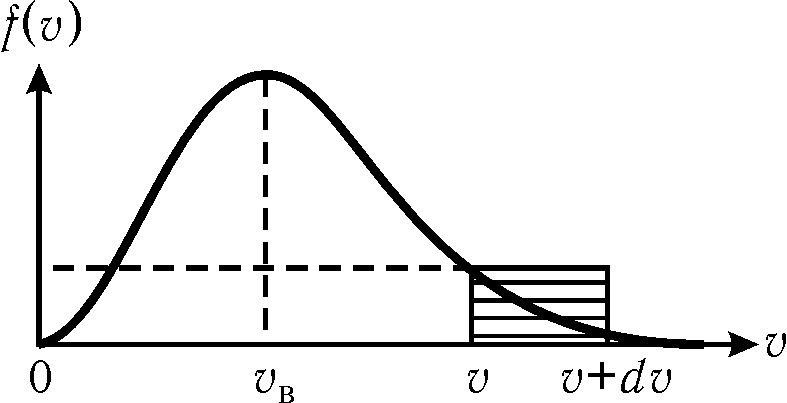
График функции показан на рис. 16.2.
|
|
Рис. 16.2 |
Рис. 16.3 |
С помощью этого графика можно найти относительное число молекул, скорости которых лежат в интервале от v до v+dv. Для этого нужно найти площадь заштрихованной фигуры (рис. 16.2), которую приближенно можно заменить прямоугольником со сторонами f(v) и dv. С учётом (16.2) имеем
![]() ,
,
что и требовалось доказать.
Из рис. 16.2
видно, что при той же ширине интервала
скоростей наибольшая площадь получается
вблизи скорости, соответствующей
максимуму функции распределения. Эта
скорость называется наиболее вероятной.
Значение наиболее вероятной скорости
можно найти из условия![]() .
Используя это условие, из (16.3) можно
получить:
.
Используя это условие, из (16.3) можно
получить:
|
(16.4) |
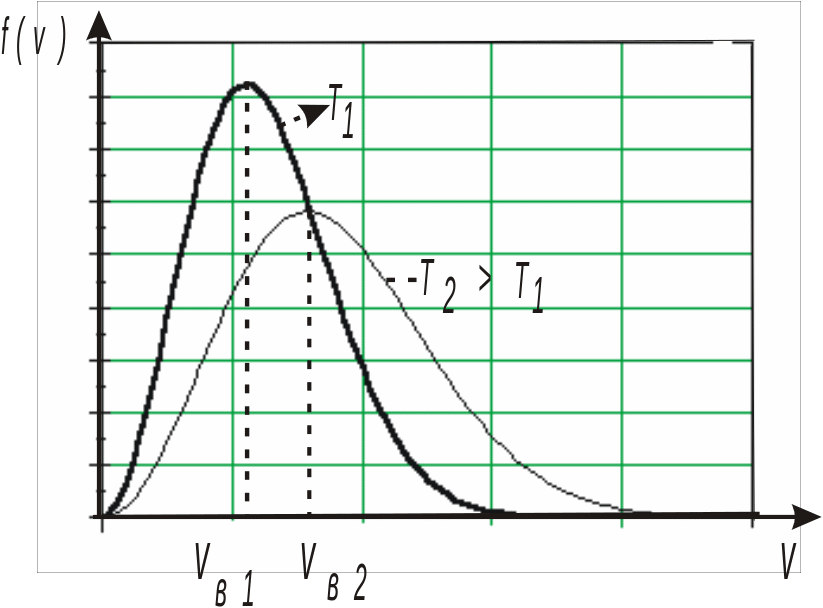
Отметим, что с повышением температуры наиболее вероятная скорость возрастает, поэтому с ростом температуры максимум функции распределения смещается в область больших скоростей. При этом возрастает также доля молекул, обладающих большими значениями скоростей — рис. 16.3.
С помощью функции
распределения f(v)
можно найти среднее значение скорости
vср и квадрат
среднеквадратичной скорости![]() :
:
|
(16.5) |
|
(16.6) |
Подставив сюда f(v) из (16.3), получим:
|
(16.7) |
|
(16.8) |
Формулу (16.8)
проще получить, если учесть, что средняя
кинетическая энергия хаотического
движения молекул![]() ,
откуда
,
откуда
|
(16.9) |
Из выражений
(16.4), (16.7) и (16.9) видно, что![]() .
Отношение этих скоростей
.
Отношение этих скоростей![]() .
Заменим в формулах (16.4), (16.7) и (16.9) отношение
k/m на
.
Заменим в формулах (16.4), (16.7) и (16.9) отношение
k/m на
 ,
,
где — молярная масса, т.е. масса одного моля газа. Тогда формулы (16.4), (16.7) и (16.9) примут вид, удобный для практических расчётов:
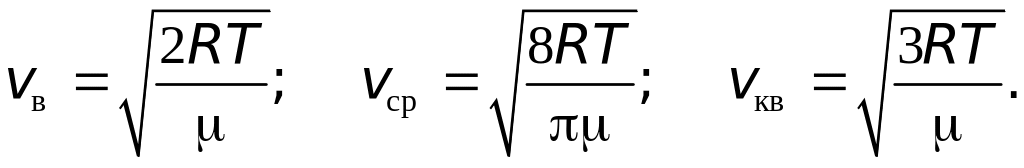

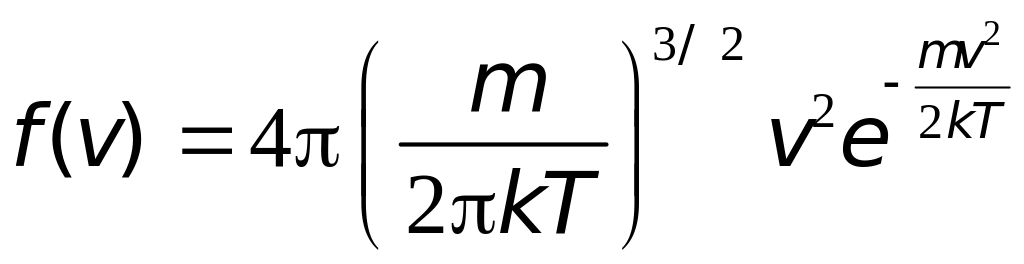 .
.
 .
.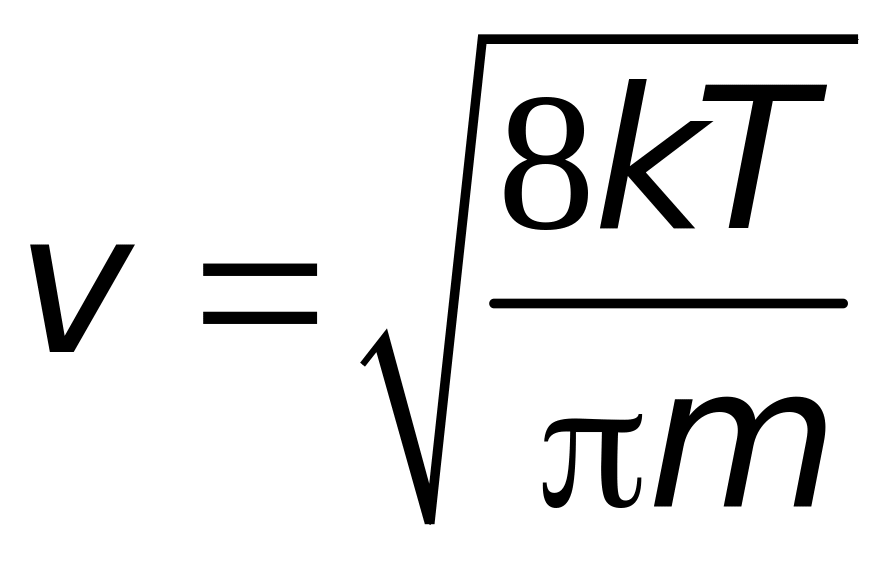 ;
;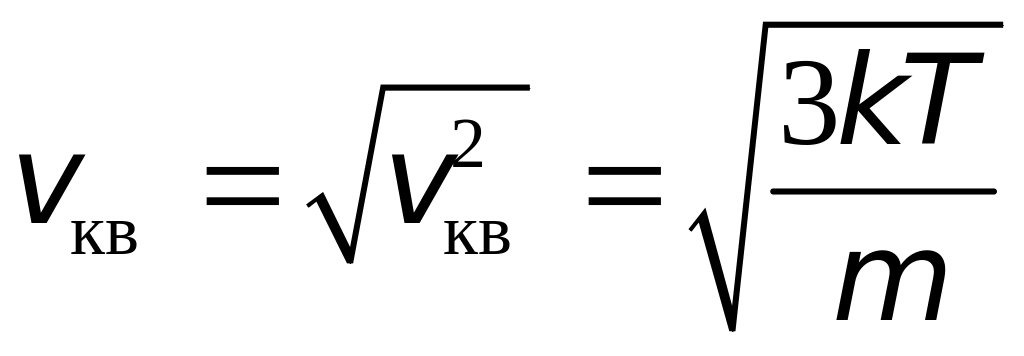 .
. .
.