
- •Часть 1
- •Одесса – 2004
- •Содержание
- •Введение
- •I. Механика
- •1. Кинематика материальной точки
- •1.1. Основные понятия кинематики
- •1.2. Нормальное и касательное ускорения
- •1.3. Движение точки по окружности. Угловые скорость и ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа
- •3.2. Связь между работой и изменением кинетической энергии
- •3.3. Связь между работой и изменением потенциальной энергии
- •3.4. Закон сохранения механической энергии
- •3.5. Соударения
- •4. Вращательное движение твёрдого тела
- •4.1. Кинетическая энергия вращательного движения. Момент инерции
- •4.2. Основной закон динамики вращательного движения
- •4.3. Закон сохранения момента импульса
- •4.4. Гироскоп
- •II. Механические колебания и волны
- •5. Общая характеристика колебательных процессов. Гармонические колебания
- •6. Колебания пружинного маятника
- •7. Энергия гармонического колебания
- •8. Сложение гармонических колебаний одинакового направления
- •9. Затухающие колебания
- •10. Вынужденные колебания
- •11. Упругие (механические) волны
- •12. Интерференция волн
- •13. Стоячие волны
- •14. Эффект Допплера в акустике
- •III. Молекулярная физика
- •15. Основное уравнение молекулярно-кинетической теории газов
- •16. Распределение молекул по скоростям
- •17. Барометрическая формула
- •18. Распределение Больцмана
- •Іv. Основы термодинамики
- •19. Основные понятия термодинамики
- •20. Первое начало термодинамики и его применение к изопроцессам
- •21. Число степеней свободы. Внутренняя энергия идеального газа
- •22. Классическая теория теплоёмкости газов
- •23. Адиабатный процесс
- •24. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •25. Идеальная тепловая машина Карно
- •26. Второе начало термодинамики
- •2. Невозможен процесс, единственным результатом которого была бы передача теплоты от холодного тела к горячему.
- •27. Энтропия
- •V. Электростатика
- •28. Дискретность электрического заряда. Закон сохранения электрического заряда
- •29. Закон Кулона. Напряжённость электростатического поля. Вектор электрического смещения
- •30. Силовые линии. Поток вектора . Теорема Остроградского-Гаусса
- •31. Применения теоремы Остроградского-Гаусса для расчёта полей
- •32. Работа по перемещению заряда в электростатическом поле. Циркуляция вектора
- •33. Связь между напряжённостью поля и потенциалом
- •34. Электроёмкость проводников. Конденсаторы
- •35. Энергия электростатического поля
- •VI. Постоянный электрический ток
- •36. Основные характеристики тока
- •37. Закон Ома для однородного участка цепи
- •38. Закон Джоуля - Ленца
- •39. Правила Кирхгофа
- •40. Контактная разность потенциалов
- •41. Эффект Зеебека
- •42. Эффект Пельтье
17. Барометрическая формула
Рассмотрим поведение идеального газа в поле силы тяжести. Как известно, по мере подъёма от поверхности Земли давление атмосферы уменьшается.
Найдём зависимость давления атмосферы от высоты над уровнем моря, используя следующую упрощённую модель:
Температура газа и его молекулярный состав не зависят от высоты;
Ускорение свободного падения на всех высотах, где существует атмосфера, постоянно.
Рис.
17.1
-dP = gdh, |
(17.1) |
где — плотность атмосферы на высоте h.
Из уравнения
Менделеева – Клапейрона
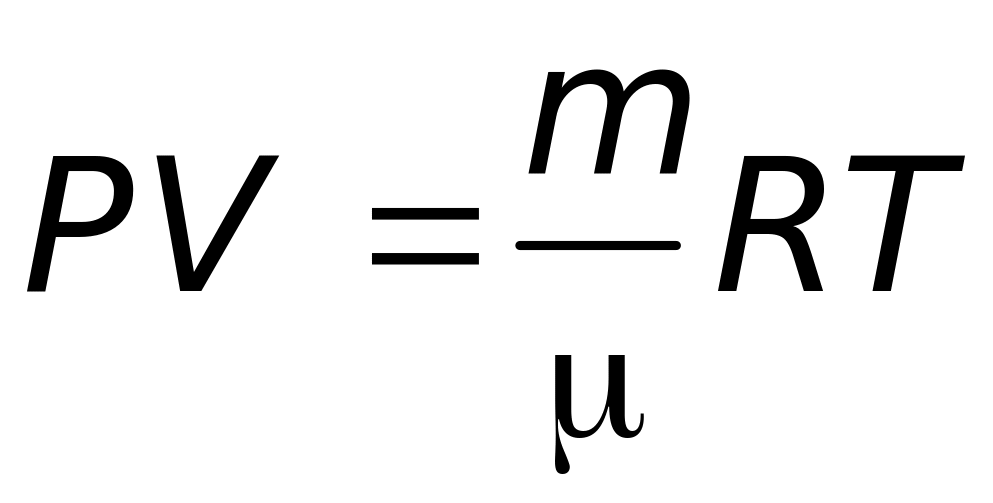 следует:
следует:
|
(17.2) |
Подставляя (17.2) в (17.1) и разделяя переменные, получим
![]()
Проинтегрируем последнее выражение, считая g=const, T=const:
|
(17.3) |
где Р и Р0 — давление атмосферы на высоте h и h0 соответственно.
Формула (17.3) выражает зависимость давления атмосферы от высоты и называется барометрической формулой. Если в (17.3) положить h0 = 0, т.е. высоту отсчитывать от уровня моря, то барометрическая формула примет вид
Рис.
17.2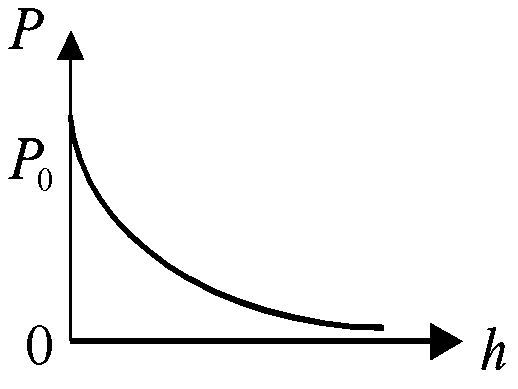
|
(17.4) |
График зависимости Р от h показан на рис. 17.2. Следует отметить, что несмотря на значительное число упрощений, формула (17.4) достаточно хорошо описывает изменение атмосферного давления с высотой и применяется для определения высоты полёта.
18. Распределение Больцмана
Выразим давление газа на высотах h и h0 через соответствующее число молекул в единице объёма п и п0, считая, что на разных высотах T=const:
P = nkT; |
(18.1) |
P0 = n0kT. |
(18.2) |
Преобразуем далее показатель степени в (17.3) следующим образом:
|
(18.3) |
где Wp — изменение потенциальной энергии молекулы при изменении высоты в поле тяжести Земли.
Подставляя (18.1) – (18.3) в (17.3), получим
|
(18.4) |
Это и есть распределение Больцмана для частиц, находящихся в потенциальном поле. Хотя эта формула выведена нами для частного случая распределения молекул в поле тяжести Земли, она имеет универсальный характер — описывает распределение частиц по энергиям в любом потенциальном поле (например, для зарядов в электростатическом поле).
Если потенциальную энергию отсчитывать от нуля, то
|
(18.5) |
Рис.
18.1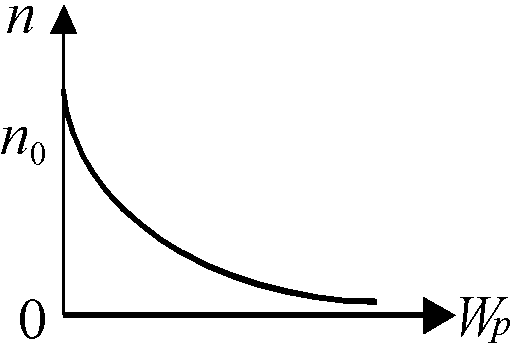
Іv. Основы термодинамики
19. Основные понятия термодинамики
1. Термодинамическая система — совокупность макроскопических тел, обменивающихся энергией между собой и окружающей средой.
2.Состояние термодинамической системы определяется совокупностью значений ее термодинамических параметров (параметров состояния) — всех физических величин, характеризующих макроскопические свойства системы (давление, объем, температура и др.). Связь между термодинамическими параметрами определяется уравнением состояния. Так, для идеального газа уравнение состояния — это уравнение Менделеева-Клапейрона.
3. Состояние термодинамического равновесия есть обобщение понятия механического равновесия и формулируется следующим образом. В системе, находящейся в состоянии термодинамического равновесия, должны быть равны давление во всех её частях (условие механического равновесия) и температуры (условие термического равновесия).
4. Термодинамический процесс — изменение состояния термодинамической системы, характеризующееся изменением её параметров состояния.
5. Равновесный процесс — бесконечная последовательность состояний равновесия.
6. Внутренняя энергия — суммарная кинетическая и потенциальная энергия взаимодействия всех частиц (атомов или молекул) тела.
Для идеального газа потенциальной энергией взаимодействия молекул можно пренебречь, поэтому внутренняя энергия идеального газа полностью определяется кинетической энергией всех его молекул, находящихся в некотором ограниченном объёме. Внутренняя энергия идеального газа может быть найдена как произведение средней кинетической энергии wср движения молекул на их число. Поскольку wср зависит лишь от температуры (см. формулу (15.11)), то можно утверждать, что внутренняя энергия идеального газа полностью определяется его температурой.
6. Работа есть количественная мера превращения энергии хаотического движения молекул или направленного движения тел в энергию направленного движения макроскопических тел. Схематически такой процесс превращения энергии показан на рис. 19.1.
Процесс 1 сопровождается выполнением механической работы, которая численно равна изменению кинетической энергии тела (3.4).
|
|
Рис. 19.1 |
Рис. 19.2 |
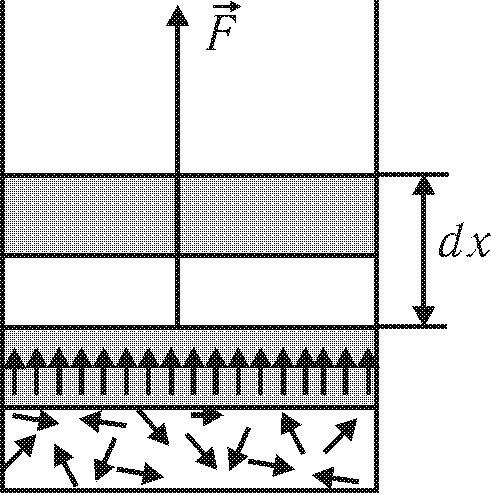
Рассмотрим пример, в котором иллюстрируется протекание процесса 2 При расширении газа энергия хаотического движения молекул переходит в энергию поступательного (направленного) движения поршня (рис. 19.2), за счёт чего совершается работа. Если поршень переместится на расстояние dx, то элементарная работа dA=Fdx, где F=PS — сила давления газа на поршень сечением S. Таким образом,
dA=PdV, |
(19.1) |
где dV=Sdx — изменение объёма газа.
Формула (19.1) есть термодинамическое выражение для элементарной работы. Полная работа при расширении газа от объема V1 до объёма V2 определяется формулой
|
(19.2) |
Рис.
19.3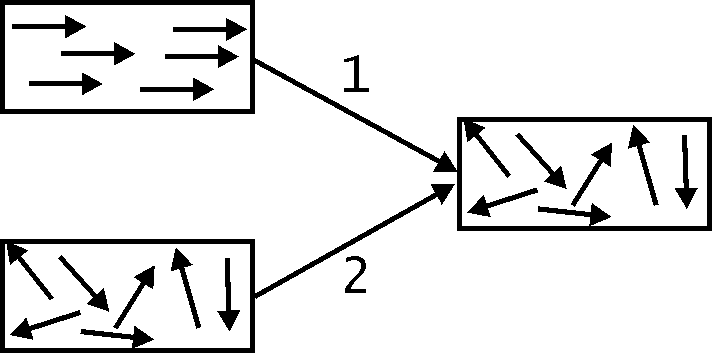
Будем считать работу положительной (А>0), если система выполняет работу над внешними телами. Если же внешние тела совершают работу над системой, то она отрицательна (А<0).
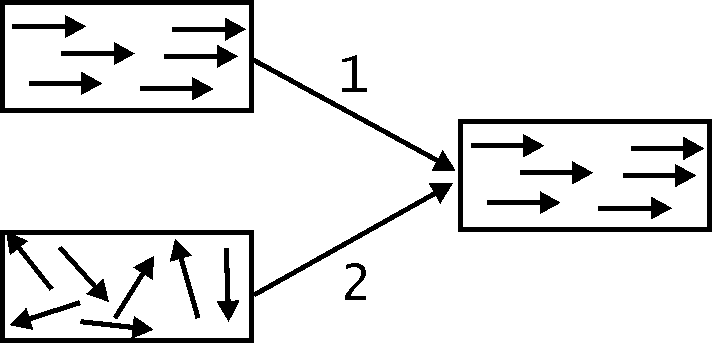
Теплота есть количественная мера превращения энергии направленного или хаотического движения в энергию хаотического движения (рис. 19.3).
Процесс 1 происходит при торможении тел под действием силы трения. Такой процесс сопровождается превращением энергии направленного движения (кинетической энергии) тела в энергию хаотического движения частиц окружающей среды, что эквивалентно передаче ей некоторого количества теплоты. Такое же превращение энергии наблюдается в процессе, обратном показанному на рис. 19.2 (т.е. в процессе сжатия газа).
Процесс превращения энергии хаотического движения в энергию хаотического движения (канал 2 на рис. 19.3) есть не что иное, как процесс передачи теплоты от горячего тела к холодному.

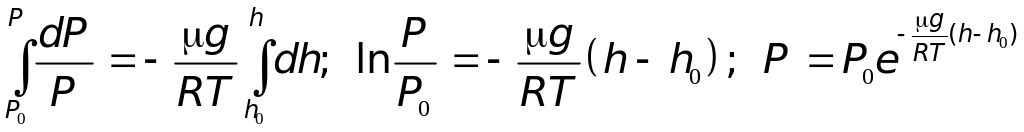 ,
,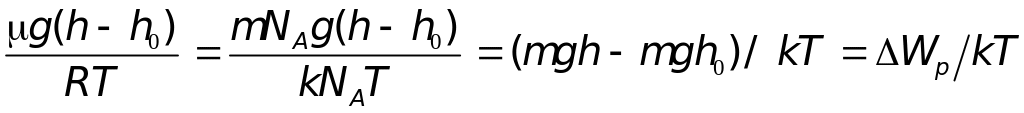 .
.
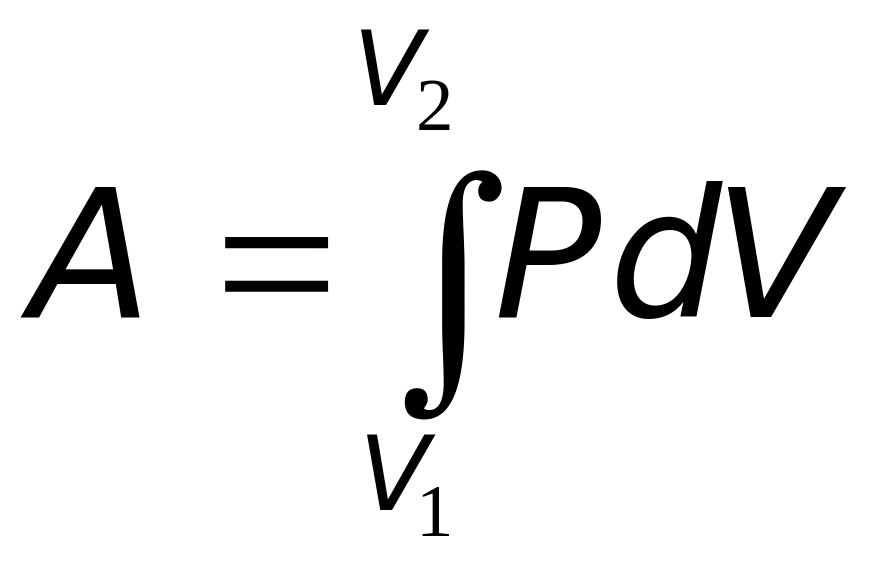 .
.