
- •Часть 1
- •Одесса – 2004
- •Содержание
- •Введение
- •I. Механика
- •1. Кинематика материальной точки
- •1.1. Основные понятия кинематики
- •1.2. Нормальное и касательное ускорения
- •1.3. Движение точки по окружности. Угловые скорость и ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа
- •3.2. Связь между работой и изменением кинетической энергии
- •3.3. Связь между работой и изменением потенциальной энергии
- •3.4. Закон сохранения механической энергии
- •3.5. Соударения
- •4. Вращательное движение твёрдого тела
- •4.1. Кинетическая энергия вращательного движения. Момент инерции
- •4.2. Основной закон динамики вращательного движения
- •4.3. Закон сохранения момента импульса
- •4.4. Гироскоп
- •II. Механические колебания и волны
- •5. Общая характеристика колебательных процессов. Гармонические колебания
- •6. Колебания пружинного маятника
- •7. Энергия гармонического колебания
- •8. Сложение гармонических колебаний одинакового направления
- •9. Затухающие колебания
- •10. Вынужденные колебания
- •11. Упругие (механические) волны
- •12. Интерференция волн
- •13. Стоячие волны
- •14. Эффект Допплера в акустике
- •III. Молекулярная физика
- •15. Основное уравнение молекулярно-кинетической теории газов
- •16. Распределение молекул по скоростям
- •17. Барометрическая формула
- •18. Распределение Больцмана
- •Іv. Основы термодинамики
- •19. Основные понятия термодинамики
- •20. Первое начало термодинамики и его применение к изопроцессам
- •21. Число степеней свободы. Внутренняя энергия идеального газа
- •22. Классическая теория теплоёмкости газов
- •23. Адиабатный процесс
- •24. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •25. Идеальная тепловая машина Карно
- •26. Второе начало термодинамики
- •2. Невозможен процесс, единственным результатом которого была бы передача теплоты от холодного тела к горячему.
- •27. Энтропия
- •V. Электростатика
- •28. Дискретность электрического заряда. Закон сохранения электрического заряда
- •29. Закон Кулона. Напряжённость электростатического поля. Вектор электрического смещения
- •30. Силовые линии. Поток вектора . Теорема Остроградского-Гаусса
- •31. Применения теоремы Остроградского-Гаусса для расчёта полей
- •32. Работа по перемещению заряда в электростатическом поле. Циркуляция вектора
- •33. Связь между напряжённостью поля и потенциалом
- •34. Электроёмкость проводников. Конденсаторы
- •35. Энергия электростатического поля
- •VI. Постоянный электрический ток
- •36. Основные характеристики тока
- •37. Закон Ома для однородного участка цепи
- •38. Закон Джоуля - Ленца
- •39. Правила Кирхгофа
- •40. Контактная разность потенциалов
- •41. Эффект Зеебека
- •42. Эффект Пельтье
III. Молекулярная физика
Молекулярная физика — это раздел физической науки, исследующий физические свойства и агрегатные состояния физических тел в зависимости от их молекулярного строения, характера теплового движения молекул и сил взаимодействия между ними.
15. Основное уравнение молекулярно-кинетической теории газов
Рассмотрим в качестве простейшей физической модели идеальный газ. Идеальным называется такой газ, для которого выполняются следующие условия:
размеры молекул настолько малы, что их можно рассматривать как материальные точки;
потенциальная энергия взаимодействия между молекулами равна нулю при любом расстоянии между ними — лишь в момент столкновения между молекулами возникают упругие силы отталкивания.
Хаотическое движение молекул газа можно представить как движение 1/3 общего их числа в направлении оси x, 1/3 — вдоль оси y, 1/3 — вдоль оси z. При этом в положительном направлении оси движется 1/2 соответствующего числа молекул, т.е. 1/6 часть — рис. 15.1.
|
|
Рис. 15.1 |
Рис. 15.2 |
Подсчитаем теперь число молекул, которые пересекают площадку сечением S, ориентированную перпендикулярно к оси х, за время dt — рис. 15.2. Для упрощения выкладок будем считать, что скорости всех молекул одинаковы и равны некоторому значению v. Число молекул dN, пересекающих площадку в положительном направлении оси х, очевидно, пропорционально площади S, числу молекул п в единице объёма, их скорости v, а также времени dt:
|
(15.1) |
Заменим теперь воображаемую площадку S стенкой сосуда. При ударе молекулы о стенку направление её скорости изменяется на противоположное, поэтому изменение импульса молекулы
|
(15.2) |
Импульс, сообщённый стенке за счёт dN ударов, найдём перемножением выражений (15.1) и (15.2):
|
(15.3) |
Сила давления,
возникающая за счёт ударов молекул о
стенку сосуда, находится по второму
закону Ньютона
![]() ,
а давление
,
а давление
![]() .
.
В результате получим:
|
(I5.4) |
Если учесть, что молекулы движутся с различными скоростями, то в формуле (15.1) v нужно заменить на среднюю скорость vср:
![]() ,
,
а в формуле (15.4) v2 на среднюю квадратичную скорость
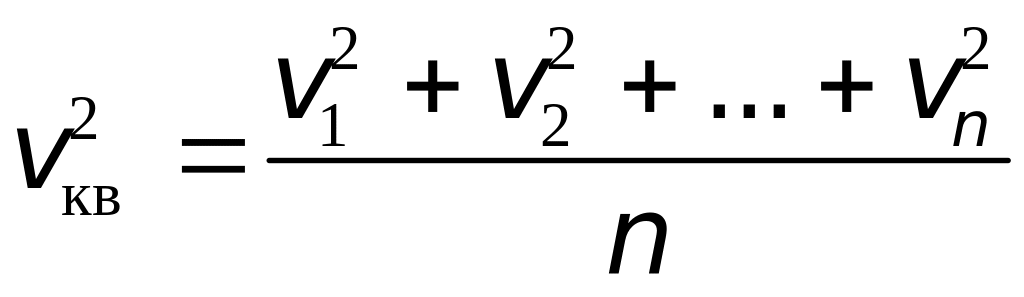 .
.
В результате получим:
|
(15.5) |
|
(15.6) |
Введём в рассмотрение среднюю кинетическую энергию хаотического движения молекул
|
(15.7) |
С учётом (15.7) выражение (15.6) можно переписать в виде:
|
(15.8) |
Формула (15.8) есть основная формула молекулярно-кинетической теории газов для давления. Видно, что давление газа пропорционально средней энергии хаотического движения молекул.
Заменив в формуле (15.8) число молекул в единице объёма n на общее число молекул в объёме N=nV, получим:
|
(15.9) |
Правая часть этого выражения остаётся величиной постоянной, если температура газа Т =const, поэтому PV=const.
Таким образом, получен закон Бойля-Мариотта, который, как известно, является частным случаем уравнения Менделеева-Клапейрона при Т = const. Для одного моля газа это уравнение имеет вид:
PV0=RT, |
(15.10) |
где V0 — объём одного моля газа; R — универсальная газовая постоянная.
Если теперь записать уравнение (15.9) для одного моля:
![]() ,
,
где NA — число Авогадро, и сравнить его с уравнением Менделеева-Клапейрона (15.10), то
![]() .
.
Из последнего уравнения следует
 .
.
Отношение двух универсальных констант R и NA есть также универсальная постоянная. Эта постоянная обозначается буквой k и называется постоянной Больцмана: k=R/NA.
Таким образом, средняя кинетическая энергия хаотического движения молекул пропорциональна температуре
|
(15.11) |
Формула (15.11) есть основная формула молекулярно-кинетической теории газов для энергии молекулы. С помощью этой формулы можно дать молекулярно-кинетичеcкое толкование температуры. Поскольку T wср, то можно сказать, что температура есть величина, пропорциональная средней кинетической энергии хаотического теплового движения молекул. Заметим, что понятие температуры справедливо для равновесных систем, состоящих из очень большого числа частиц.
В заключение параграфа найдём связь между давлением газа и температурой. Подставляя (15.11) в (15.8), получаем:
P=nkT. |
(15.12) |


