
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Залежність ентальпії реакції від температури. Рівняння кірхгофа
Закон Гесса і висновки з нього дозволяють розрахувати теплові ефекти реакцій за стандартних умов, тоді як на практиці часто потрібно знати тепловий ефект для температури, при якій та чи інша хімічна реакція проходить найбільш повно. Для цих розрахунків використовують рівняння Кірхгофа:
![]()
![]()
де ΔСV – зміна теплоємкості системи при сталому об'ємі, ΔСр – зміна теплоємкості системи при сталому тиску.
Ці рівняння є рівняннями Кірхгофа в диференціальному вигляді. Отже, температурний коефіцієнт теплового ефекту реакції дорівнює зміні теплоємності в результаті перебігу реакції.
Якщо ΔСР > 0, то при підвищенні температури тепловий ефект ендотермічної реакції збільшується (тобто тепла поглинається більше), а екзотермічної – зменшується (тобто тепла виділяється менше). Якщо ΔСР < 0, то підвищення температури чинить протилежну дію, якщо ΔСР = 0, тепловий ефект реакції не залежить від температури.
Для кількісної оцінки використовують інтегральну форму рівняння Кірхгофа
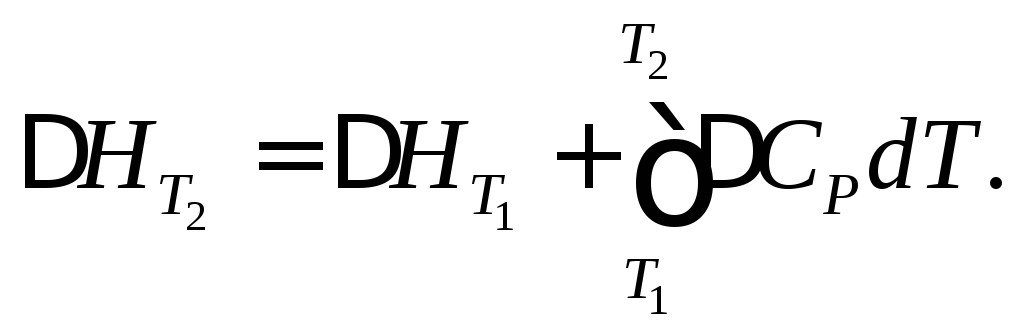
У вузькому інтервалі температур вважають ΔСр сталою величиною. Тоді:
![]()
Приклади розв'язування задач
Задача 1. Знайти зміну внутрішньої енергії при випаровуванні 0,150 кг води при 308 К, якщо пара води підлягає законам ідеальних газів. Об'ємом рідини знехтувати. Приведена теплота пароутворення води дорівнює 2428 кДж/кг.
Розв'язування. Обчислюємо роботу проти зовнішнього тиску:
W = nRT = (0,150/18)∙8,314∙308 = 21,33 кДж.
Зміну внутрішньої енергії визначаємо з математичного виразу першого закону термодинаміки:
ΔU = Q – W.
ΔU = 0,150 2428 – 21,33 = 342,87 кДж.
Відповідь: ΔU = 342,87 кДж.
Задача 2. Яку кількість роботи виконано при ізотермічному розширенні 2,5 м3 ідеального газу, взятого при 373 К і тиску 1,01325·105 Па, якщо об'єм його збільшився в 4 рази?
Розв'язування.
При
збільшенні об'єму газу в 4 рази він
дорівнюватиме 4·2,5 = 10 м3.
Користуючись рівнянням
![]() для
ізотермічного процесу обчислимо
величину виконаної роботи:
для
ізотермічного процесу обчислимо
величину виконаної роботи:
![]() ;
;
![]()
Відповідь: W = 4294,53 кДж.
Задача 3. Розрахувати тепловий ефект реакції:
СН4 (г) + 2С12 (г) → СН2Сl2 (г) + 2НСl(г)
за стандартними теплотами утворення: ΔН°f(СН4) = –74,85 кДж/моль, ΔН°f(СН2Сl2) = –95,39 кДж/моль, ΔН°f(НСІ) = – 92,31 кДж/моль.
Розв'язування. Відповідно до першого висновку з закону Гесса тепловий ефект цієї реакції дорівнює різниці між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин (з врахуванням стехіометричних коефіцієнтів). Теплота утворення хлору (проста речовина) дорівнює нулю:
ΔН°= ΔН°f(СН2СІ2)+ 2ΔН°f(НСІ) – Н°f(СН4).
Після підставлення числових значень одержимо:
ΔН° = –95,39 + 2 (–92,31) – (–74,85) = –205,16 (кДж/моль).
Задача 4. Розрахувати тепловий ефект реакції за стандартних умов:
2СН4 (г) → С2Н2 (г) + 3Н2 (г)
за стандартними теплотами згоряння: ΔН°С(СН4) = – 802,32 кДж/моль, ΔН°С(С2Н2) = –1299,63 кДж/моль, ΔН°С(Н2) = –285,83 кДж/моль.
Розв'язування. Відповідно до другого висновку з закону Гесса тепловий ефект цієї реакції дорівнює різниці між сумою теплот згоряння вихідних речовин та сумою теплот згоряння продуктів реакції (з врахуванням стехіометричних коефіцієнтів):
ΔН° = 2ΔН°С(СН4) – [ΔН°С(С2Н2) + 3ΔН°С(Н2)]. Після підставлення числових значень одержимо:
ΔН° = 2(–802,32) – [–1299,63 + 3(–285,83)] = 552,48 (кДж/моль).
Задача 5. Визначити теплоту нейтралізації 5 кг 20 %-го розчину КОН розчином сульфатної кислоти.
Розв'язування. При нейтралізації 1 г-екв лугу 1 г-екв кислоти виділяється 57,30 кДж теплоти. Визначимо, скільки г-екв КОН міститься в 5 кг 20 %-го розчину. Для цього знайдемо масу КОН в розчині:
ткон = 5·0,20 = 1 кг або 1000/56,1 = 17,8 г-екв.
ΔНн = 17,82·57,30 = 1026,20 кДж/моль.
Відповідь: ΔНн = 1026,20 кДж/моль.
