
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Приклади розв'язування задач
Задача 1. Обчислити тиск пари 10 %-го розчину сечовини CO(NН2)2 при 50 °С. Тиск пари води при 50 °С дорівнює 12320 Па.
Розв'язування. За умови задачі в 100 г розчину сечовини міститься 10 г сечовини і 90 г води. Обчислюємо кількість молів сечовини (nb) і води( nа):
![]() ,
,
![]() .
.
Із
формули
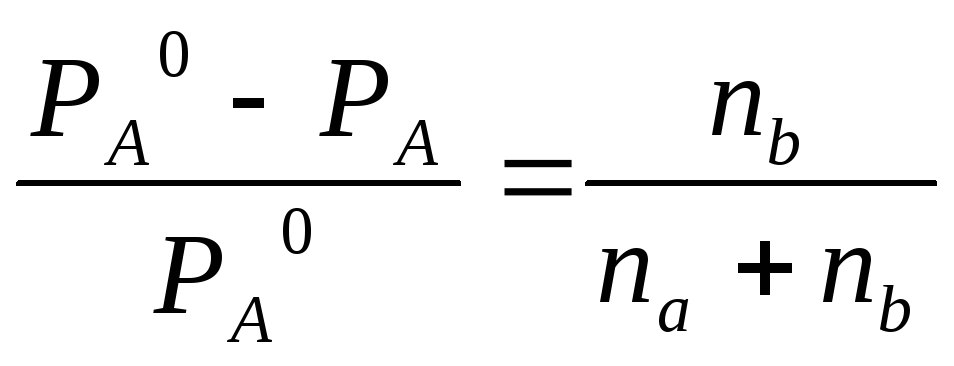 визначаємо тиск пари розчину сечовини:
визначаємо тиск пари розчину сечовини:
![]() .
.
Відповідь: 11922 Па.
Задача 2. Яка температура замерзання розчину цукру, виготовленого розчиненням 50 г цукру в 200 г води?
Розв'язування. Обчислюємо зниження температури замерзання розчину за формулою:
![]() ,
,
де
![]() – молекулярна маса сахарози, дорівнює
342 г/моль.
– молекулярна маса сахарози, дорівнює
342 г/моль.
![]() .
.
Тоді, Tзам. р-ну = Tзам. роз-ка – ΔTзам = 0 – 1,36 = –1,36 0С.
Відповідь: –1, 36 0С.
Задача 3. Розчин, що містить 1,7 г цинк хлориду в 250 г води, замерзає при –0,23 0С. Визначити уявний ступінь дисоціації цинк хлориду в цьому розчині.
Розв'язування. Обчислюємо моляльність розчину цинк хлориду:
![]()
Із
формули
![]() обчислюємо ізотонічний коефіцієнт:
обчислюємо ізотонічний коефіцієнт:
![]() .
.
Використовуючи формулу і = 1 + α(n–1), обчислюємо уявний ступінь дисоціації цинк хлориду (n=3):
![]() .
.
Відповідь: 73,65 %.
Задача 4. Обчислити осмотичний тиск 2 %-вого розчину глюкози при 0 °С. Густину розчину прийняти рівною одиниці.
розв'язування.
Згідно умови задачі в 100 кг 2 %-вого
розчину міститься 2 кг глюкози. Густина
даного розчину 1 г/см3.
Отже, в 1000 дм3
або в 1 м3
міститься 20 кг глюкози, що складає
![]() .
.
Осмотичний
тиск обчислюємо за формулою
![]() .
.
![]() .
.
Відповідь: 2,52∙105 Па.
Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
Актуальність: Усі фізіологічні рідини в організмі людини, тварин, рослин є розчинами. Майже всі лікарські засоби чинять лікувальну дію на організм у розчиненому стані. Синтез і виробництво основної маси ліків здійснюється у розчинах. Розчини використовуються майже у всіх технологічних процесах.
Навчальні цілі:
Знати:
загальну характеристику розчинів;
способи вираження концентрації розчинів;
закон Рауля для ідеальних розчинів;
визначення "реальний розчин";
причини відхилення реальних розчинів від закону Рауля;
колігативні властивості розчинів;
основи методів кріоскопії, ебуліоскопії та осмометрії;
застосування методів кріоскопії, ебуліоскопії та осмометрії у фармації.
Вміти:
готувати розчини заданої концентрації;
проводити визначення температури замерзання розчинів;
визначати молярну масу досліджуваної речовини методом Раста;
проводити математичну обробку експериментальних результатів.
Завдання для самостійної позааудиторної роботи
І. Засвоїти основний матеріал навчальної програми
Розчини. Теорії розчинів. Загальна характеристика розчинів. Способи вираження концентрації розчинів.
Пониження тиску насиченої пари розчинника для ідеальних розчинів. Закон Рауля. Різні форми закону Рауля. Графічне представлення закону Рауля.
Колігативні властивості. Підвищення температури кипіння розчинів. Ебуліоскопія. Зниження температури замерзання розчинів. Кріоскопія. Осмос. Осмотичний тиск. Осмометрія.
Реальні розчини. Причини їх відхилення від закону Рауля.
Застосування ебуліоскопії, кріоскопії та осмометрії у фармації.
Залежність між складом рідкого розчину та рівноважної з ним пари. Ізотерми та ізобари Коновалова. Закони Коновалова.
Практичне значення законів Коновалова. Дистиляція сумішей. Фракційна перегонка, пояснення цього процесу за допомогою кривих Коновалова.
Взаємна розчинність рідин. Обмежена взаємна розчинність рідин. Верхня та нижня критичні температури розчинності. Типи діаграм, застосування до них правила важеля.
Взаємно нерозчинні рідини. Перегонка з водяною парою. Принцип одержання рідких лікарських форм (ароматних вод).
