
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Іі. Дати письмові відповіді на контрольні запитання
Як зв'язані між собою питома і молярна електропровідності розчину електроліту?
Напишіть рівняння залежності молярної електропровідності розчину сильного електроліту від концентрації.
Накреслити графік залежності питомої електропровідності електроліту від розведення.
Накреслити графік залежності молярної електропровідності від розведення для сильних і слабких електролітів.
Написати два закони, виведені Кольраушем для електропровідності розчинів електролітів.
Що називається числом переносу йона? Напишіть зв'язок між числами переносу катіонів і аніонів і швидкостями їхнього руху.
Які йони мають найбільшу рухливість у водних розчинах? Чому?
Ііі. Розв’язати задачі
Яка буферна ємність сироватки крові за лугом, якщо після титрування 5 см3 її затрачено 2,1 см3 0,1 М розчину NaOH при зміні рН з 7,4 до 9,4?
2. Якою повинна бути концентрація розчину глюкози, щоб цей розчин був при 18 °С ізотонічним розчину, що містить 0,5 моль/л кальцій хлориду, якщо уявна ступінь дисоціації останнього при вказаній температурі дорівнює 65,4 %?
Чому дорівнює йонна сила розчину, що містить в 1 л 0,1 моль Na2HPO4 та 0,1 моль NaH2PO4?
Молярна електрична провідність бензойної кислоти при розведенні 512 м3/кмоль дорівнює 6,44 См·м2·кмоль-1. Визначте концентрацію розчину бензойної кислоти, в якому а = 0,3, якщо
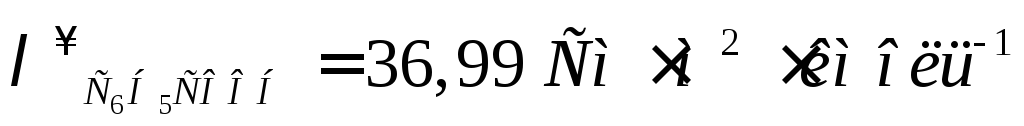 .
.
Самостійна робота на занятті
Виконання тестових завдань (перевірка домашньої самопідготовки).
Змістовий модуль №1: “Закони термодинаміки. Термодинаміка хімічної і фазової рівноваги. Розчини неелектролітів”.
3. Виконання лабораторної роботи.
4. Обговорення та математична обробка експериментальних результатів.
Обговорення висновків та оформлення протоколу (залік лабораторної роботи).
Перелік питань, які виносяться на змістовий модуль 1
Основні поняття термодинаміки. Теплота і робота. Розрахунок роботи в термодинамічних процесах.
Перший закон термодинаміки. Внутрішня енергія та ентальпія як функції стану системи. Застосування першого закону термодинаміки до різних процесів.
Закон Гесса та висновки з нього. Використання закону Гесса до різних фізико-хімічних процесів: хімічні реакції, розчинення, нейтралізація. Залежність теплового ефекту від температури. Рівняння Кірхгофа.
Другий та третій закони термодинаміки. Характеристичні функції та термодинамічні потенціали. Рівняння Гіббса-Гельмгольца.
Закон дії мас. Константа рівноваги. Різні способи вираження константи рівноваги.
Рівняння ізотерми хімічної реакції. Хімічна спорідненість.
Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції.
Вплив різних факторів на положення хімічної рівноваги. Принцип Ле-Шательє та його термодинамічне обґрунтування.
Фазові рівноваги. Основні поняття та визначення. Правило фаз Гіббса.
Фазові перетворення в однокомпонентних системах. Рівняння Клапейрона-Клаузіуса. Практичне застосування рівняння Клапейрона-Клаузіуса до процесів плавлення, випаровування та сублімації.
Використання правила фаз Гіббса для аналізу діаграм стану однокомпонентних (на прикладі діаграми стану води) та двокомпонентних (на прикладі діаграми стану системи з простою евтектикою) систем. Поняття про термічний аналіз.
Трикомпонентні системи. Розподіл речовини між двома рідинними фазами. Екстракція.
Загальна характеристика розчинів. Способи вираження концентрації розчинів.
Закон Рауля ідеальних розчинів нелетких речовин. Дві форми закону Рауля.
Колігативні властивості розчинів. Основи методів ебуліоскопії, кріоскопії та осмометрії.
Тиск насиченої пари в ідеальних розчинах, утворених леткими компонентами. Відхилення від закону Рауля.
Закони Коновалова. Діаграми стану систем розчин-пара. Азеотропні суміші.
Фракційна перегонка. Теоретичні основи процесу фракційної перегонки. Методи розділення азеотропних сумішей.
Обмежена розчинність рідин. Діаграми стану систем з верхньою та нижньою критичними температурами розчинення, без критичних температур розчинення.
Взаємна нерозчинність рідин. Перегонка з водяною парою. Вакуумна перегонка.
