- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Експериментальна частина
Прилади та реактиви: магнітна мішалка; хімічна склянка на 800 мл з теплоізоляцією; секундомір; технічні терези; термометр; розчин хлоридної кислоти 0,5 Н; натрій гідроксид гранульований (попередньо висушений).
Методичні вказівки
Дослід 1: Визначення калориметричної сталої.
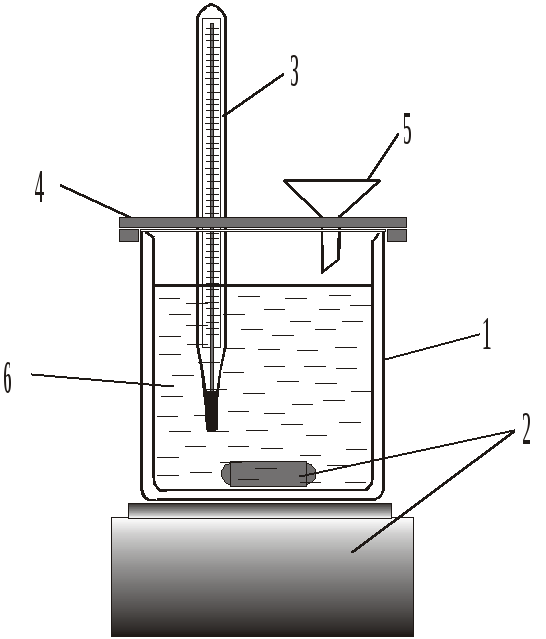
Дослідження процесу нейтралізації проводять в установці, зображеній на рис. 1.1. Сталу калориметричної установки (К), зображеної на рис. 1.1, можна визначити за відомою теплотою розчинення будь-якої солі чи лугу, наприклад, за відомою теплотою розчинення натрій гідроксиду – 112,1 кДж/моль.
У склянку 1 наливають 500 см3 дистильованої води, включають магнітну мішалку і спостерігають за температурою, значення якої можуть коливатись за рахунок теплообміну з навколишнім середовищем. Відмічають температуру з точністю 0,1 0С кожних півхвилини. З точністю 0,01 г на технічних терезах зважують 5 г попередньо висушеного гранульованого натрій гідроксиду. Після стабілізації температури системи, через отвір 5 вносять наважку твердого натрій гідроксиду, продовжуючи відмічати зміну температури з часом.
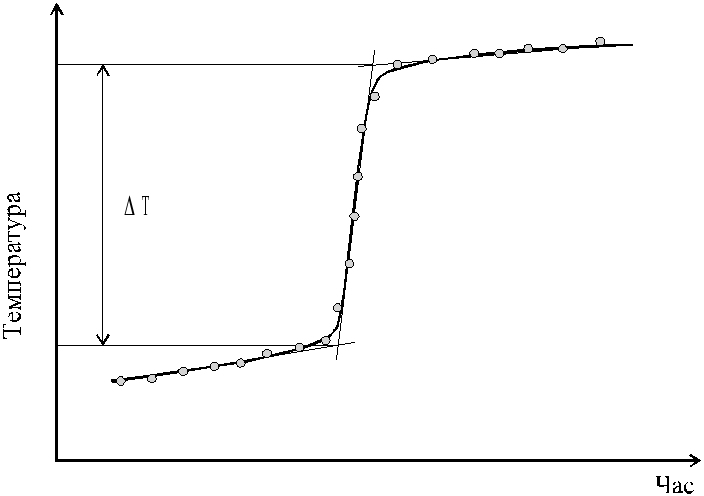
В результаті розчинення натрій гідроксиду температура системи зростатиме (екзотермічний тепловий ефект процесу), а стабілізація температури в часі на деякій позначці свідчитиме про завершення процесу розчинення. Зміну температури в процесі розчинення натрій гідроксиду ілюструє рис. 1.2.
|
|
Час |
|
Рис. 1.1. Схема калориметричної установки: 1 – хімічна склянка з теплоізоляцією; 2 – магнітна мішалка; 3 – термометр; 4 – кришка; 5 – отвір для внесення твердих речовин; 6 – дистильована вода |
Рис. 1.2. Схематичне зображення часової залежності температури системи в ході екзотермічного процесу |
На міліметровому папері будують експериментально одержану залежність температура – час: Т = f(τ), і визначають величину скачка температури Т графічним способом, як показано на рис. 1.2. Визначивши Т, обчислюють калориметричну сталу за рівнянням:
![]() ,
(1.1)
,
(1.1)
де ΔНp – теплота розчинення натрій гідроксиду (112,1 кДж/моль); n – кількість молів лугу.
Дослід 2: Визначення теплового ефекту нейтралізації.
В склянку наливають 500 см3 0,5 Н розчину хлоридної кислоти і витримують при кімнатній температурі деякий час. Як і в досліді 1 включають мішалку і спостерігають за температурою, відмічаючи її кожні півхвилини. Після стабілізації температури вносять наважку 5 г гранульованого натрій гідроксиду (попередньо висушеного), продовжуючи відмічати значення температури з часом до моменту її стабілізації. Графічним способом (рис. 1.2, дослід 1) визначають скачок температури в ході процесу.
Спостережуваний тепловий ефект процесу (ΔН) є сумою ефектів розчинення (ΔНp) та нейтралізації (ΔНн):
ΔН = ΔНp + ΔНн.
Враховуючи цей момент, тепловий ефект нейтралізації обчислюють, виходячи із наступної формули:
![]() ,
(1.2)
,
(1.2)
де К – калориметрична стала; n – кількість молів натрій гідроксиду, взятого для нейтралізації; Т – сумарний скачок температури за рахунок екзотермічного розчинення та екзотермічного теплового ефекту нейтралізації. Результати досліджень вносять у таблицю 1.1.
Таблиця 1.1
Результати калориметричних досліджень процесу нейтралізації
хлоридної кислоти натрій гідроксидом
|
Калориметрична постійна, К, кДж/К |
Кількість молів взятого лугу, n, моль |
Скачок температури, Т, К |
Теплота розчинення лугу,
|
Теплота нейтралізації, ΔНн, кДж/моль | ||
|
|
|
|
112,1 |
| ||
|
Табличне значення Qн , кДж/моль |
– 55,9 |
| ||||
|
Відносна похибка, % |
|
| ||||
Оформлення протоколу: У протоколі наводять графічні залежності T = f(τ), з яких визначають скачок температури при розчиненні натрій гідроксиду та нейтралізації хлоридної кислоти натрій гідроксидом. Проводять розрахунки калориметричної сталої та теплового ефекту нейтралізації, вказуючи розмірності в одиницях СІ. Порівнюють одержане значення теплового ефекту нейтралізації з табличним. Розраховують відносну похибку. Роблять відповідні висновки.