
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
Якщо при розчиненні речовина розпадається на йони, то число частинок у розчині збільшується. Тому величина пониження температури замерзання в розчині електроліту більша, ніж у розчині неелектроліту з тією ж молярною концентрацією. За величиною пониження температури замерзання можна судити про ступінь дисоціації розчиненого слабкого електроліту, якщо ця величина не надто мала (не менше 0,1).
Якщо – ступінь йонізації електроліту, тобто частка речовини, що розпалася на йони у водному розчині, а n – число йонів, що утворилося із однієї молекули, то із N0 молекул розчиненої речовини утворюється N0n йонів і залишається в недисоційованому стані N0(1 – ) молекул. Загальне число всіх частинок у розчині рівне:
N0(1 – ) + N0n = N0[1 + (n – 1)] = N0i, (5.1)
де i = 1 + (n – 1) – ізотонічний коефіцієнт Вант-Гоффа, який показує, у скільки разів збільшиться число частинок в розчині, внаслідок дисоціації. У відповідності з цим, спостережуваний ефект пониження температури замерзання (Tзам) повинен збільшитись в i раз, порівняно з теоретичним, тобто:
Tзам = ikкрСm. (5.2)
Виміривши Tзам, і знаючи моляльну концентрацію розчиненої речовини Cm, можна обчислити коефіцієнт Вант-Гоффа і, а відповідно ступінь йонізації :
i = Tзам/(kкрСm). (5.3)
= (i – 1)/(n – 1). (5.4)
Для сильних електролітів у розбавлених розчинах ступінь йонізації = 1, тобто при розчиненні число частинок збільшується в n раз (i = n). Розчин електроліту в даному випадку є ідеальним. Однак, в дійсності коефіцієнт Вант-Гоффа і завжди менший n, оскільки йони в розчині зв’язані силами електростатичної взаємодії і не можуть проявляти себе як повністю вільні частинки. Чим більша сила міжйонної взаємодії, тим більше відхиляється реальний розчин від ідеального розчину електроліту, і тим менше значення ізотонічного коефіцієнту.
Мірою відхилення реального розчину від ідеальної поведінки служить осмотичний коефіцієнт g:
g = i/n`, (5.5)
де n` – граничне значення n при умові повної дисоціації і відсутності сил взаємодії між йонами. По мірі розбавлення розчину електроліту осмотичний коефіцієнт наближається до одиниці: і 1 при с 0.
Експериментальна частина
Обладнання та реактиви: термометр Бекмана; кріоскопічна установка; аналітичні терези; дистильована вода; натрій сульфат х.ч.; піпетки на 10 см3.
Методичні вказівки
Д
Рис.
5.1.
Схема установки для кріоскопії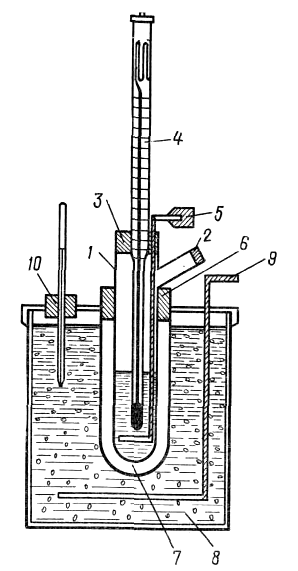
Настроювання термометра Бекмана. Термометр Бекмана відрізняється від звичайного, по-перше, більш точною шкалою, яка дозволяє спостерігати зміну температури до 0,002 С; по-друге, додатковим запасним ртутним резервуаром, за допомогою якого можна змінювати кількість ртуті, в основному, в нижньому резервуарі, і значно розширити діапазон визначення температури. Шкала такого термометра, яка має довжину 25-30 см, поділена всього на 5 (іноді на 6) поділок з відмітками між ними десятих і сотих часток. Перевівши деяку кількість ртуті з нижнього резервуару в верхній, або додаючи з верхнього в нижній, завжди можна настроїти термометр так, щоб температура замерзання даного розчинника попадала б на середину цієї умовної шкали (тобто між 4 і 2).
Щоб настроїти термометр, необхідно привести в контакт ртуть двох резервуарів. Для цього, підігріваючи рукою (а якщо цього недостатньо, то опустивши в теплу воду), викликають розширення ртуті в нижньому резервуарі для того, щоб заповнити весь капіляр доверху. Потім швидко перевертають головкою вниз і злегка постукуючи по головці, добиваються того, щоб ртуть у запасному резервуарі підійшла щільно до верхньої частини капіляра, наповненого ртуттю із нижнього резервуару і злилася з нею. Після цього термометр обережно (щоб не розірвати ртуть) повертають в попереднє вертикальне положення. Нижній резервуар з ртуттю відразу занурюють в попередньо підготовлену склянку з водою, температура якої повинна дорівнювати температурі замерзання чистого розчинника. Металічну головку термометра закріплюють в штативі. При цьому, термометр не повинен торкатися стінок склянки і дна. Охолоджувальну воду, впродовж 3–5 хв, перемішують скляною паличкою, додаючи до неї невеличкі кусочки снігу. У процесі охолодження ртуть з нижнього резервуару зливається з ртуттю верхнього резервуару (через капіляр) і перетягує деяку кількість ртуті із верхнього резервуару в нижній. Через 5 хв, звільнивши із штатива головку термометра, беруть основний стержень термометра однією рукою посередині, швидко його виймають із води і енергійно стукнувши руку з затисненим термометром до другої, викликають відрив верхньої ртуті від капіляра. Таким чином, закінчується основне, але ще не повне настроювання термометра, оскільки в робочій частині його (нижньому резервуарі з капіляром) є деякий надлишок ртуті. Таким надлишком є та невелика кількість ртуті, яка знаходиться у верхній половині капіляра, між потрібними поділками шкали і місцем, де був здійснений розрив ртуті. Легко підігрівши рукою нижній резервуар, викликають розширення ртуті, яке помічають за невеличкою крапелькою ртуті, яка появиться біля кінця капіляра в верхньому резервуарі. Цю крапельку слід струсити в верхній резервуар. Необхідно перевірити, чи достатньо цієї кількості скиненої ртуті, чи ні, повторним зануренням термометра в склянку з водою. Якщо температура, що відповідає температурі замерзання розчинника, попадає на шкалу вище бажаної поділки (тобто вище, ніж середина між 2 і 4), то струшування крапельки ртуті слід повторити і ще раз перевірити покази термометра, опустивши його в ту ж склянку з водою. Після цього необхідно записати, яка температура в 0 С відповідає градусам шкали термометра Бекмана.
З настроєним термометром Бекмана потрібно поводитися особливо обережно: його не можна класти на стіл або залишати довго при кімнатній температурі. В неробочий час термометр повинен бути закріплений вертикально за головку в штативі, а нижній резервуар повинен бути опущений або безпосередньо в рідину або в сухий повітряний кожух, який обов’язково занурений в охолоджувальну суміш.
Послідовність проведення дослідження. Настроєний термометр Бекмана ставлять у прилад і починають спостерігати за температурою. Для рівномірного охолодження рідини її повільно перемішують мішалкою. Перемішування припиняють, коли температура опуститься на 0,5 С вище очікуваної температури кристалізації. Після цього уважно слідкують за пониженням температури. Без перемішування рідина легко переохолоджується, про що свідчать покази термометра. Для чистого розчинника переохолодження допустиме на 0,5–1 С, подальше перемішування переохолодженої суміші призводить до кристалізації. При кристалізації виділяється прихована теплота і температура починає помітно підвищуватися. Не припиняючи рівномірного перемішування, слідкують за температурою, відмічаючи максимальну температуру підняття (із переохолодженого стану), яка і буде істинною температурою кристалізації даної рідини. Після цього пробірку виймають із повітряного кожуха і, підігріваючи її рукою, розчиняють утворені кристали. Потім все повторюють декілька разів, поки останні два визначення температури кристалізації будуть відрізнятися не більше, ніж на 0,001 С.
Визначивши температуру кристалізації розчинника, приступають до визначення температури замерзання розчину досліджуваної речовини (натрій сульфату). У пробірку з розчинником кількісно переносять наважку натрій сульфату, зважену на аналітичних терезах з точністю 0,0002 г. Наважку необхідно брати такою, щоб одержати не надто концентрований розчин (0,1–0,2 моль на 1000 г розчинника – води). Коли введена речовина повністю розчиниться, поміщають пробірку з розчином в охолоджувальну суміш і проводять процес охолодження в такій послідовності як із чистим розчинником. Температуру кристалізації розчину визначають 3–4 рази. З отриманих даних обчислюють середню температуру кристалізації, а також різницю середніх температур кристалізації розчинника і розчину. Одержані величини вносять у таблицю 5.1.
Таблиця 5.1
Результати кріоскопічного визначення пониження температури
замерзання розчину натрій сульфату
|
№ п/п |
Температура замерзання розчинника, поділок |
Температура замерзання розчину Na2SO4, поділок |
Пониження температури замерзання (Тзам), С | ||
|
1. |
|
|
| ||
|
2. |
|
|
| ||
|
3. |
|
|
| ||
|
Середнє значення (Тзам), С |
|
| |||
|
Ізотонічний коефіцієнт (і) |
|
| |||
|
Осмотичний коефіцієнт (g) |
|
| |||
За одержаним середнім значенням величини пониження температури замерзання розчину натрій сульфату, використовуючи формули (5.3 і 5.5), визначають ізотонічний та осмотичний коефіцієнти. На основі одержаних значень і та g роблять відповідні висновки.
