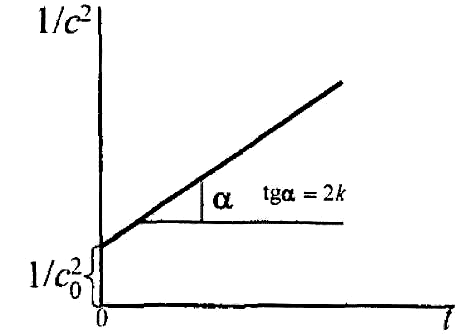- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Розділ 5 хімічна кінетика і каталіз
Хімічна кінетика – це розділ фізичної хімії, в якому вивчають швидкості та механізми хімічних перетворень, а також фактори, що впливають на них.
Дослідження залежності швидкості реакцій від різних факторів дає можливість інтенсифікувати технологічні процеси фармацевтичних виробництв. Експериментальне вивчення впливу температури та інших параметрів на швидкість розкладання біологічно- активних речовин дозволяє науково обґрунтовувати й визначати терміни придатності лікарських препаратів і парфумерно-косметичних засобів, знаходити фактори, що сприяють їх стійкості, обирати раціональну технологію їх виготовлення. Знання кінетичних законів хімічних процесів лежить в основі оптимізації пошуку біологічно активних речовин, оскільки дає можливість вивчати реакційну спроможність, установлювати механізми хімічної взаємодії і, таким чином, обирати оптимальні умови синтезу та аналізу. Фармакокінетичні дослідження, зв'язані з вивченням швидкості засвоєння і виведення лікарських препаратів в організмі, дозволяють інтерпретувати механізми їх фізіологічної дії.
Швидкість хімічної реакції є число елементарних актів хімічної реакції, які відбуваються в одиницю часу в одиниці об'єму (для гомогенних реакцій) або на одиниці поверхні (для гетерогенних реакцій).
Швидкість хімічної реакції є зміна концентрації реагуючих речовин в одиницю часу. Математичне визначення середньої швидкості реакції в проміжок часу ∆τ записують наступним чином:
![]()
В різні проміжки часу середня швидкість хімічної реакції має різні значення; істинна (миттєва) швидкість реакції визначається як похідна від концентрації за часом
![]()
Швидкість хімічної реакції залежить від багатьох факторів: природи реагуючих речовин, їх концентрації, температури, природи розчинника і т.д.
В основі хімічної кінетики знаходиться основний постулат хімічної кінетики: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, підведених до певних степенів.
Тобто для реакції
aA + bB + dD + … → продукти
вираз для швидкості реакції буде таким
= k ∙ CAn1 ∙ CBn2 ∙ CDn3 ...
Коефіцієнт пропорційності k називається константою швидкості реакції. Константа швидкості чисельно дорівнює швидкості реакції за умови, що концентрації всіх реагуючих речовин дорівнюють одиниці. Константа швидкості залежить від природи реагентів, температури, каталізатора, але не залежить від концентрації. Її називають питомою швидкістю.
Залежність швидкості реакції від концентрацій реагуючих речовин визначають експериментально і має назву кінетичного рівняння хімічної реакції. Для того, щоб мати повний вигляд цього рівняння, експериментально визначають константу швидкості і показники степенів при концентраціях реагуючих речовин. Показники степенів n1, n2, n3 називаються порядком реакції за речовинами А, В, D, а їх сумарне значення n = n1 + п2 + п3 +... – загальним порядком реакції.
Порядок хімічної реакції – це формально-кінетичне поняття, фізичний сенс якого для елементарних (одностадійних) реакцій полягає в наступному: порядок реакції дорівнює кількості концентрацій, які одночасно змінюються. У випадку елементарних реакцій порядок реакції може дорівнювати сумі коефіцієнтів в стехіометричному рівнянні реакції; однак в загальному випадку порядок реакції визначається лише в експерименті і залежить від умов проведення реакції (порядок реакції може мати як цілочисельні так і дробові та від’ємні значення у складних реакціях).
Молекулярність реакції – число частинок, які, згідно експериментально встановленому механізму реакції, приймають участь в елементарному акті хімічної взаємодії.
Мономолекулярні – реакції, в яких відбувається хімічне перетворення однієї молекули (ізомеризація, дисоціація і т. д.):
![]()
Бімолекулярні – реакції, елементарний акт яких відбувається при зіткненні двох частинок (однакових або різних):
СН3Вr + KOH CH3OH + KBr.
Гідроліз сахарози на глюкозу і фруктозу (бімолекулярна, псевдопершого порядку):
С12H22O11 + HOH C6H12O6 + C6H12O6.
Тримолекулярні – реакції, елементарний акт яких відбувається при зіткненні трьох частинок:
O2 + NO + NO → 2NO2
Реакції з молекулярністю більше, ніж три, невідомі.
Для елементарних реакцій, які відбуваються при приблизно рівних концентраціях вихідних речовин, величини молекулярності і порядку реакції співпадають. Але не існує чітко визначеного зв'язку між поняттями молекулярності і порядку реакції, оскільки порядок реакції характеризує кінетичне рівняння реакції, а молекулярність – механізм реакції.
Розглянемо реакції, для яких молекулярність і порядок збігаються і дорівнюють нулю, одиниці, двом, трьом.
Реакції нульового порядку. Частіше всього до реакцій нульового порядку належать реакції, які відбуваються на поверхні твердих тіл (гетерогенні реакції) за умови, що швидкість дифузії реагентів до поверхні є меншою за швидкість їх хімічного перетворення, тобто саме хімічна реакція є лімітуючою стадією процесу. Також до реакцій нульового порядку належать ферментні реакції, де кількість ферменту обмежена, а субстрат перебуває в надлишку.
Швидкість реакцій нульового порядку не залежить від концентрації реагуючої речовини в певному її інтервалі і визначається рівнянням:
υ = kc = k,
де k – константа швидкості реакції нульового порядку.
Константу швидкості реакції нульового порядку визначають за рівнянням:
![]()
Розмірність k збігається з розмірністю швидкості реакції – моль/(дм3∙с).
Період напівперетворення, тобто час, за який прореагує половина реагенту:
![]()
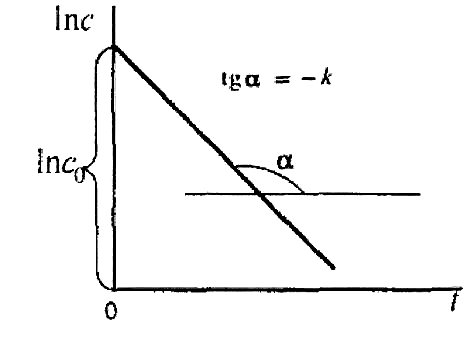
Реакції першого порядку. Швидкість реакції першого порядку визначається рівнянням:
![]()
![]() Значення
константи швидкості можна визначити
графічним способом, побудувавши графік
в координатах ln
c – τ, значення k
чисельно дорівнює тангенсу кута нахилу
прямої, взятому з протилежним
знаком:
Значення
константи швидкості можна визначити
графічним способом, побудувавши графік
в координатах ln
c – τ, значення k
чисельно дорівнює тангенсу кута нахилу
прямої, взятому з протилежним
знаком:
|
0 τ |
Пряма відсікає на осі ординат відрізок, рівний ln с0. Відповідно формула для розрахунку k:
![]()
Розмірність константи швидкості – зворотній час – [k] = τ-1 (с-1, хв-1 тощо).
Період напівперетворення для реакції першого порядку описується рівнянням:
![]()
Тобто, для реакцій першого порядку період напівперетворення не залежить від початкової концентрації реагенту. Це характерна ознака таких реакцій.
Реакції другого порядку. Для реакції другого порядку швидкість визначається рівнянням:
![]()
Вираз для розрахунку поточної концентрації в довільний момент часу:
![]()
Експериментальні дослідження реакції другого порядку вказують на лінійну залежність величини зворотної концентрації реагентів від часу:
|
τ |
К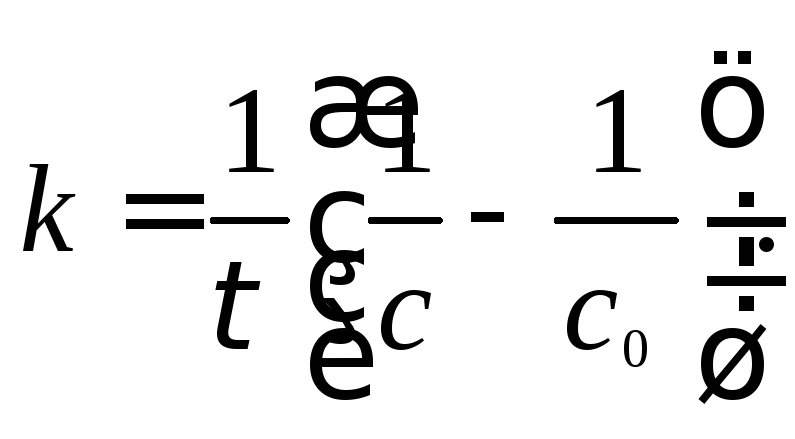 онстанта
швидкості реакції дорівнює тангенсукута
нахилу прямої і визначається за
рівнянням:
онстанта
швидкості реакції дорівнює тангенсукута
нахилу прямої і визначається за
рівнянням:
Розмірність константи швидкості реакції другого порядку [k] = л ∙ моль-1 ∙ с -1 .
Період напівперетворення для реакцій другого порядку обернено пропорційний початковій концентрації:
![]()
Реакції третього порядку. Для реакції третього порядку швидкість залежить від концентрації реагуючих речовин у третій степені:
![]()
Вираз для обчислення концентрації реагенту в довільний момент часу:
![]()
Отже, одержали лінійне рівняння в координатах 1/с2 – τ:
|
0 τ
|
Константа швидкості дорівнює tg/2 і визначається за рівнянням:
![]()
Розмірність константи швидкості реакції другого порядку [k] = л2 ∙ моль-2 ∙ с -1.
Період напівперетворення розраховують за формулою:
![]()
Тобто, період напівперетворення обернено пропорційний квадрату початкової концентрації.