- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Методи визначення порядку реакції
Інтегральний метод підбору кінетичного рівняння. Експериментальні значення поточної концентрації і часу підставляють в рівняння для констант швидкостей реакцій різних порядків. Рівняння, за яким одержують сталі значення константи швидкості, описує кінетику досліджуваного процесу.
Іншим варіантом цього методу є подання експериментальних значень с і τ у координатах, що дають лінійні залежності. Для реакції першого порядку графік буде лінійним в координатах lnс – τ, другого порядку – в координатах 1/с – τ, третього порядку – в координатах 1/с2 – τ.
Інтегральний метод періоду напівперетворення. Вивчають залежність періоду напівперетворення від початкової концентрації реагуючої речовини. Для реакцій першого порядку τ1/2 не залежить від с0, для реакцій другого порядку він обернено пропорційний с0, для реакцій третього порядку – обернено пропорційний со2.
|
τ |
υ = k cn
одержимо lnυ = lnk + nlnc рівняння прямої в координатах ln υ – ln c, тангенс кута нахилу якої дорівнює порядку реакції n. Отже, визначаючи швидкість реакції при різних концентраціях реагуючої речовини, можна знайти порядок реакції.
Для визначення швидкості реакції будують кінетичну криву в координатах с – τ (рис). Швидкість реакції дорівнює тангенсу кута нахилу дотичної до кривої в даній точці, яка відповідає певній концентрації.
Приклади розв’язування задач
Задача 1. Перетворення пероксиду бензоілу на диетиловий ефір (реакція першого порядку) при 333 К пройшла за 10 хв на 75,2 %. Обчисліть константу швидкості реакції.
Розв’язування. Запишемо рівняння константи швидкості першого порядку і підставимо в нього відповідні значення:
![]()
Відповідь: k = 0,140 хв-1.
Задача 2. При збільшенні концентрації речовини А в 1,6 рази швидкість хімічної реакції зростає в 2,56 рази. Який порядок реакції?
Розв’язування. У рівняння швидкості реакції підставляємо дані значення:
υ = k∙Cn ,
2,56 = 1,6n.
З одержаного рівняння визначаємо, що n = 2. Отже, реакція другого порядку.
Задача 3. Визначити час, за який прореагує 90 % мурашиного альдегіду, якщо змішати певну його кількість з еквімолярною кількістю розчину пероксиду водню, якщо константа швидкості цієї реакції k = 0,7544 л/(моль∙год).
Розв’язування.
Із розмірності константи швидкості
реакції видно, що реакція відноситься
до реакції другого порядку і константа
швидкості реакції описується рівнянням:
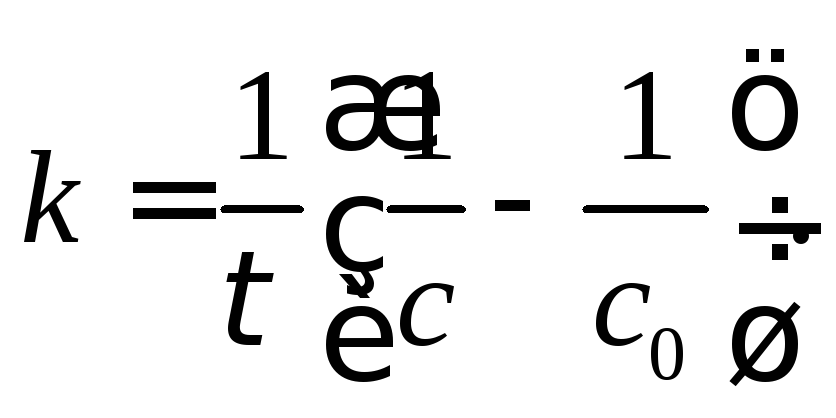
Із даного рівняння виводимо формулу для визначення часу:
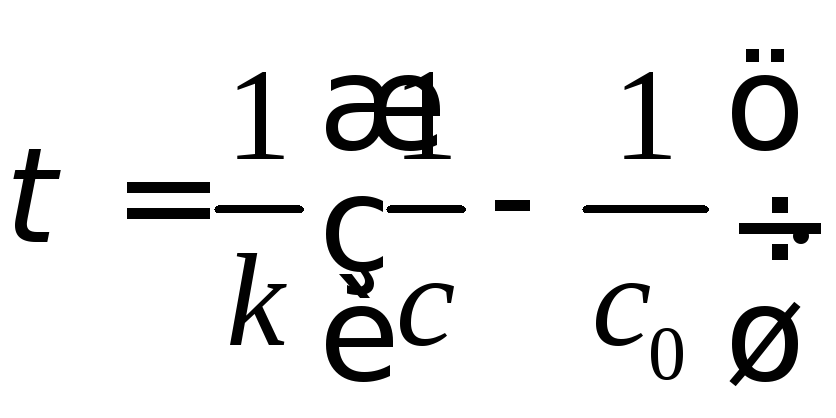
Визначаємо час за який прореагує 90 % мурашиного альдегіду, тобто поточна його концентрація буде: с = 0,1с0:
![]()
Відповідь: τ = 11,93 год.
Заняття № 8
Тема: Хімічна кінетика реакцій. Вплив чинників на швидкість хімічних процесів. Визначення константи швидкості реакції йодування ацетону.
Актуальність: Більшість процесів у біології і медицині розвиваються в часі і характеризуються своєю динамікою проходження (обмін речовин у живих організмах, процеси розмноження та загибелі бактерій і вірусів, клітин тощо). Основна задача в таких випадках – з’ясувати можливість регульованого впливу різних факторів (середовища, ліків, лікувальних прийомів та методик) на динаміку проходження подібних процесів. Кінетика – це розділ фізичної хімії, який дозволяє кількісно описати проходження хімічної реакції та процесу в цілому і є інструментом, який дозволяє контролювати перебіг реакції чи процесу та підібрати необхідні умови для сприятливого їх проходження.
Навчальні цілі:
Знати:
визначення молекулярності та порядку реакцій, закон дії мас;
принцип незалежності в кінетиці реакцій складних типів;
принцип лімітуючої стадії в кінетиці послідовних реакцій;
основні формули для розрахунку кінетичних констант реакцій простих та складних типів.
Вміти:
приготувати вихідну реакційну суміш;
провести правильний відбір та аналіз проби реакційної суміші;
розрахувати константу швидкості реакцій, вказавши її розмірність;
провести статистичну обробку експериментальних результатів.