
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Рівняння ізотерми хімічної реакції
З термодинамічних позицій стан рівноваги можна характеризувати також зміною термодинамічних потенціалів (ΔG, ΔF) або величиною максимальної роботи хімічної реакції.
Максимальна робота хімічної реакції при постійній температурі складається з алгебраїчної суми усіх робіт, що виконують компоненти системи при переході від вихідних парціальних тисків або концентрацій до рівноважних:
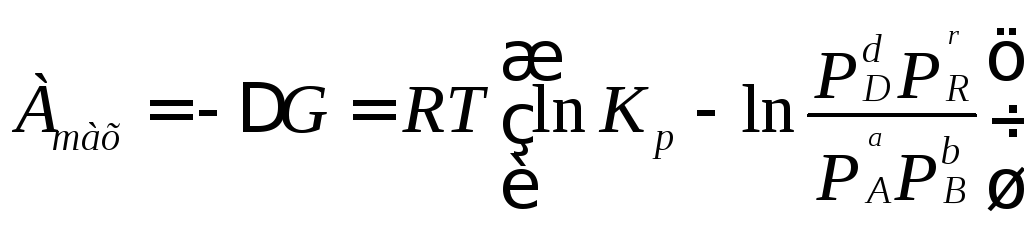 .
.
При постійних V і Т дане рівняння набуває такого вигляду
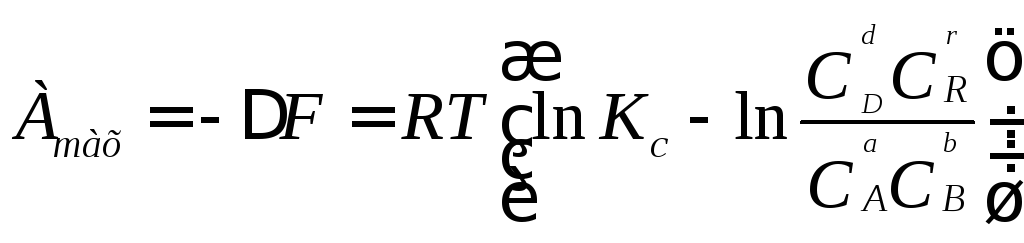 .
.
Дані рівняння називають рівняннями ізотерми хімічної реакції, або рівняннями Вант-Гоффа. Вони показують залежність між зміною термодинамічного потенціалу (ΔG або ΔF), константою хімічної рівноваги (Кр або Кс) і величиною парціальних тисків (концентрацій) складових реакції у вихідному стані.
За рівнянням ізотерми хімічної реакції можна розрахувати зміну енергій Гіббса і Гельмгольца і відповідно з'ясувати можливість, напрямок і межу перебігу довільного процесу.
При значеннях концентрацій або парціальних тисків компонентів, рівних одиницям, рівняння ізотерми хімічної реакції дають відповідно вирази для стандартного ізохорного потенціалу реакції
∆F0 = – RT ln Kc
і стандартного ізобарного потенціалу реакції
∆G0 = – RT ln Kр.
Величини стандартних потенціалів відображають властивість речовин вступати у взаємодію і є мірою хімічної спорідненості. Хімічні реакції здійснюються самочинно при позитивних значеннях максимальної роботи.
Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
Константа рівноваги залежить від температури. Для ізобарних процесів цей зв'язок можна виразити рівнянням, яке має назву ізобари хімічної реакції
![]()
для ізохорних процесів у вигляді ізохори хімічної реакції
![]()
З цих рівнянь можна зробити висновок, що для екзотермічної реакції (ΔН < 0) підвищення температури зменшує константу рівноваги, тобто зменшує вміст продуктів реакції у рівноважній суміші. Якщо реакція ендотермічна (ΔН > 0), то при підвищенні температури константа рівноваги збільшується, тобто вміст продуктів реакції у реакційній суміші збільшується. Таким чином, підвищення температури зміщує рівновагу в бік ендотермічної реакції.
Приклади розв'язування задач
Задача 1. Визначити сумарну зміну ентропії ΔS при нагріванні 1 моль води від температури плавлення до повного випаровування при температурі кипіння. Теплота плавлення льоду 335,2 Дж/г, теплота пароутворення води 2260 Дж/г питома теплоємність води 4,188 Дж/г∙град.
Розв'язування. Сумарна зміна ентропії ΔS рівна сумі зміни ентропії при плавленні ΔS1, зміні ентропії при нагріванні ΔS2 і ентропії ΔS3 – випаровування.
Визначаємо зміну ентропії при плавленні:
ΔS1 = L/T = (335,2∙18)/273 = 22,1 Дж/(моль·К).
Зміна ентропії при нагріванні:
ΔS2 = 2,303∙Сп lg (T2/T1) = 2,303∙4,188∙18∙lg(373/273) = 23,64 Дж/(моль·К).
Зміна ентропії при пароутворенні:
ΔS3 = (2260∙18)/273 = 109,06 Дж/(моль·К).
Тоді, ΔS = ΔS1 + ΔS2 + ΔS3 = 22,1 + 23,64 + 109,06 = 154,8 Дж/(моль·К).
Задача 2. Визначити зміну ентропії при розширенні 70 г азоту з 0,200 (тиск 506625 Па) до 0,056 м3 (тиск 101325 Па). Ср прийняти таким, що дорівнює 29,43 Дж/(моль·К).
Розв'язування.
Зміну
ентропії обчислюємо за рівнянням
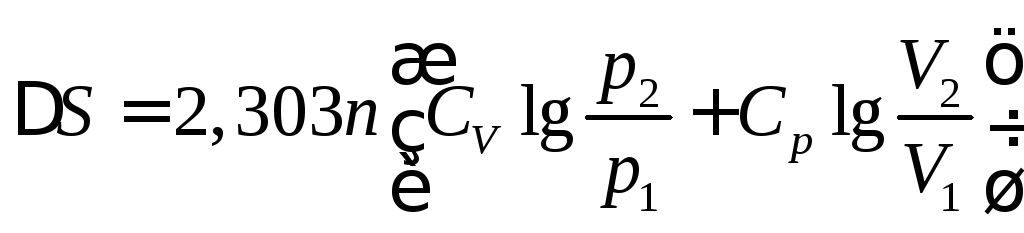 попередньо обчисливши кількість молів
азоту n і CV:
попередньо обчисливши кількість молів
азоту n і CV:
![]() .
.
CV = CP – R = 29,43 – 8,3736 = 21,06 Дж.
Тоді,
![]()
Відповідь: ΔS = 8,919 Дж/К.
Задача 3. Визначити стандартну спорідненість водню до кисню при 1000 К, якщо ступінь дисоціації водяної пари при цій температурі під тиском 1,0133·105 Па дорівнює 7·10-7.
Розв'язування. Стандартну енергію Гіббса знаходимо за формулою:
∆G0 = 2,303Δn RT lg1,0133·105 – 2,303RT lgKр = 2,303∙8,314·103∙1000(0,5 lg1,0133·105 – lg7·10-7) = 179,04 Дж/моль.
Відповідь: ∆G0 = 179,04 Дж/моль.
