
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Самостійна робота на занятті
Виконання тестових завдань (перевірка домашньої самопідготовки).
Аналіз та обговорення основних питань теми, корекція вихідного рівня знань.
Аналіз та обговорення типових помилок при розв’язуванні розрахункових задач.
Виконання тестових завдань (перевірка домашньої самопідготовки).
Виконання лабораторної роботи.
Обговорення та математична обробка експериментальних результатів.
Обговорення висновків та оформлення протоколу (залік лабораторної роботи).
Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
Хімічні реакції поділяють на гомогенні та гетерогенні. Хімічна реакція, що протікає у межах однієї фази – гомогенна. Хімічна реакція, що протікає на межі поділу фаз – гетерогенна. Будь-яка оборотна хімічна реакція (гомогенна чи гетерогенна) може протікати самочинно до тих пір, поки в системі не буде досягнуто хімічної рівноваги між речовинами, що реагують. Умови хімічної рівноваги можуть бути визначені як з точки зору термодинаміки, так і з точки зору молекулярної кінетики.
Термодинамічна хімічна рівновага визначається співвідношенням концентрацій вихідних речовин та продуктів реакції при якому ентропія системи максимальна, а вільна енергія Гіббса – мінімальна.
Молекулярно-кінетична хімічна рівновага визначається, як такий стан, при якому швидкості прямої та зворотної реакцій рівні і склад системи при певних зовнішніх умовах не змінюється. Так, для оборотної хімічної реакції:
k1
аА
(р) + вВ
(р)
![]() f
F
(р) + d
D
(р)
f
F
(р) + d
D
(р)
k2
швидкості прямої (1) та зворотної (2) реакцій рівні:
1 = k1CAa CBb 2 = k2CF f CDd,
де k1 , k2 – константи швидкості прямої та зворотної реакцій відповідно; CA, CB, CF, CD – біжучі концентрації речовин А, В, F та D.
В умовах рівноваги (1 = 2):
k1 [CA]a [CB]b = k2 [CF] f [CD]d
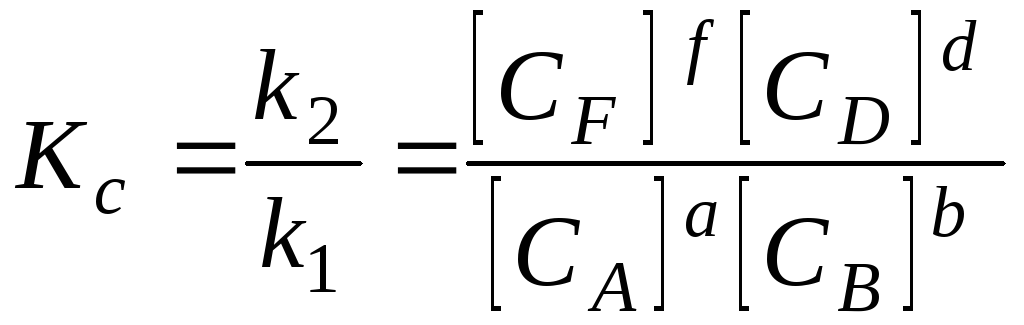 ,
,
де [CA], [CB], [CF], [CD] – рівноважні концентрації речовин А, В, F та D; Кс – константа рівноваги, виражена через рівноважні концентрації учасників реакції.
Залежність константи рівноваги від температури описується рівнянням Вант-Гоффа:
![]() ,
,
де
Н
–
зміна ентальпії системи; R
– універсальна газова стала; Т
–
температура. Використовуючи наведене
рівняння в інтегральній формі:
![]() за експериментальною залежністю
константи рівноваги від температури
можна визначити тепловий ефект оборотної
реакції. З цією метою можна використати
графічний метод визначенняН,
який полягає у побудові лінійної
залежності lnKc
– 1/T
(не менше трьох точок) і визначенні її
кутового коефіцієнта (tg):
за експериментальною залежністю
константи рівноваги від температури
можна визначити тепловий ефект оборотної
реакції. З цією метою можна використати
графічний метод визначенняН,
який полягає у побудові лінійної
залежності lnKc
– 1/T
(не менше трьох точок) і визначенні її
кутового коефіцієнта (tg):
![]() .
.
Експериментальна частина
Обладнання та реактиви: розчин FeCl3 0,03 М; розчин KI 0,03 M; розчин Na2S2O3 0,02 Н; установка для титрування; конічні колби на 100 мл – 9 шт; конічні колби на 200 мл – 6 шт; піпетки на 20 мл – 2 шт; термостат; розчин крохмалю; ванна з льодом.
