
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Самостійна робота на занятті
Виконання тестових завдань (перевірка домашньої самопідготовки).
Аналіз та обговорення основних питань теми, корекція вихідного рівня знань.
Виконання лабораторної роботи.
Обговорення та математична обробка експериментальних результатів.
Обговорення висновків та оформлення протоколу (залік лабораторної роботи).
ЛАБОРАТОРНА РОБОТА
Визначення температурного коефіцієнту та енергії активації розкладу
тіосульфатної кислоти
Інформаційна частина
Зі збільшенням температури швидкості хімічних реакцій у значній мірі зростає (зростає константа швидкості реакції). Як розглядалося вище, у більшості випадків при підвищенні температури на 10С швидкість реакції зростає в 2-4 рази (правило Вант-Гоффа):
![]() ,
(1)
,
(1)
де - температурний коефіцієнт швидкості реакції.
При збільшенні температури від Т1 до Т2 (Т1 – Т2=10n, де n=1,2,3...) правило Вант-Гоффа можна представити наступним виразом:
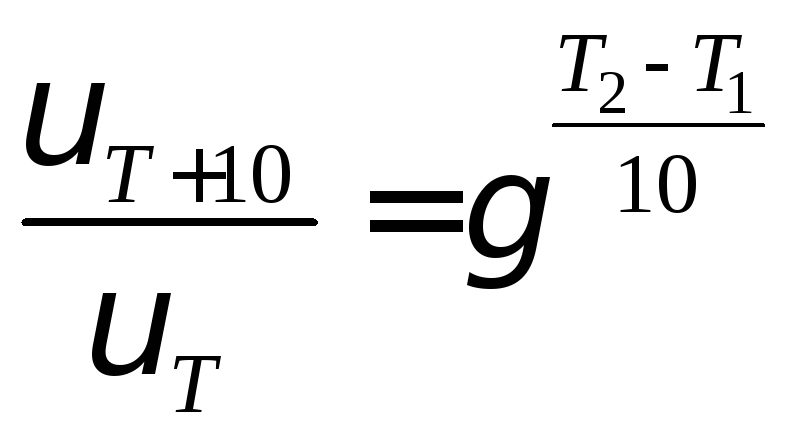 .
(2)
.
(2)
Швидкість реакції в першому наближенні можна представити:
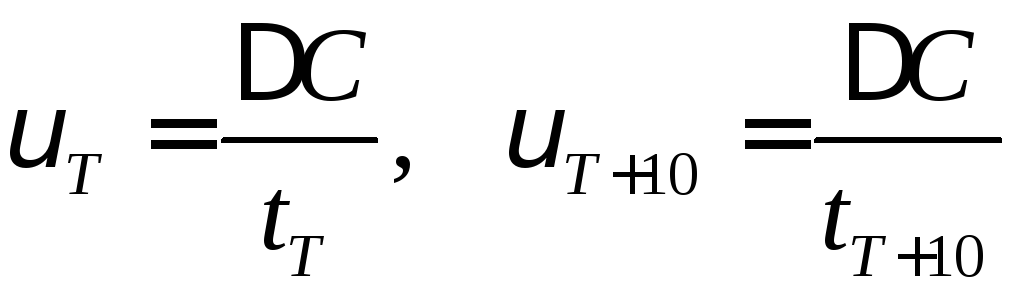 ,
(3)
,
(3)
де
С
– фіксована кількість речовини, що
реагує (утворюється) протягом часу
![]() при температурі Т та протягом часу
при температурі Т та протягом часу![]() при температурі Т+10.
при температурі Т+10.
З урахуванням (3) величину температурного коефіцієнту можна представити:
 ,
(4)
,
(4)
а для інтервалу температур Т1Т2 (Т1- Т2=10n, де n=1,2,3...):
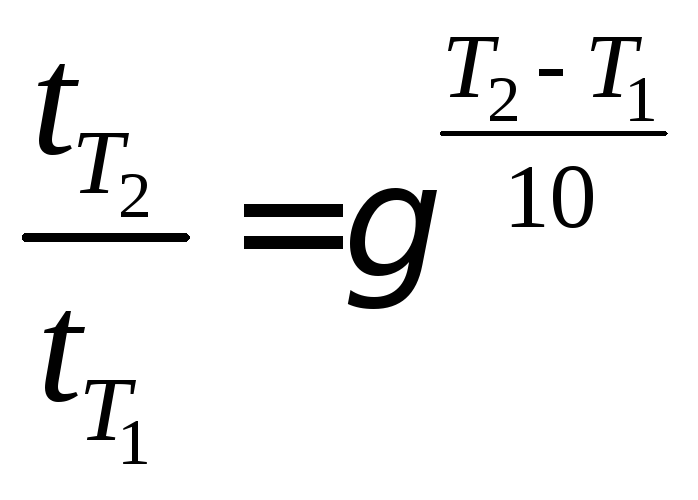 .
(5)
.
(5)
На практиці для визначення величини температурного коефіцієнту реакції зростання є рівняння (4). Використовуючи величину температурного коефіцієнту, експериментально визначеного в інтервалі температур Т1Т2 можна обчислити величину енергії активації, яка є важливою кінетичною та термодинамічною характеристикою реакції:
![]() ,
(6)
,
(6)
де R – універсальна газова стала.
В даній лабораторній роботі досліджується вплив температури на протікання реакції розкладу тіосульфатної кислоти: H2S2O3H2SO3+S. Згідно з літературними даними, енергія активації цієї реакції становить 65,96 кДж/моль, температурний коефіцієнт – 2,44. Мета лабораторної роботи – визначити температурний коефіцієнт та енергію активації реакції та перевірити правомірність виведених формул (4) та (5), зіставивши експериментальні дані з літературними.
Експериментальна частина
Прилади та реактиви: натрію тіосульфат (124 г в 1 дм3 Н2О); сульфатна кислота (50 см3 (конц.) в 1 дм3 Н2О).
Методичні вказівки
В склянку наливають 10,0 см3 розчину Na2S2O3 і 5,0 см3 води, в ІІ – 5,0 см3 розб. H2SO4. Нагрівають обидва розчини на 10 С вище кімнатної і зливають розчини, включивши секундомір. Те ж саме виконують при температурах на 20 і 30 С вище кімнатної, а також при кімнатній температурі.
Після зливання розчинів в склянках появляється біла каламуть, що вказує на протікання реакції:
Na2S2O3+H2SO4Na2SO3+H2SO3+S.
При чому помутніння наступає тим швидше, чим вища температура розчинів.
Будують графік залежності часу помутніння від температури. Експериментальні дані заносять в таблицю 9.1.
Таблиця 9.1
Результати досліджень впливу температури на швидкість розкладу тіосульфатної кислоти
|
Темпе- ратура (Т, С) |
Час
помутніння ( |
Температурний інтервал, С |
Температурний коефіцієнт, |
Енергія активації (Еа, кДж/моль) |
|
17 |
|
|
|
|
|
27 |
|
1727 |
|
|
|
37 |
|
2737 |
|
|
|
47 |
|
3747 |
|
|
|
|
|
Середнє значення енергії активації (Еа) |
| |
|
|
|
Середнє значення температурного коефіцієнта () |
| |
Зауваження. При проведенні цих дослідів важко відмітити момент появи осаду, оскільки розчин мутніє поступово, особливо після розбавлення. Полегшити завдання може смужка чорного паперу, приклеєна з протилежного боку скалки. Відлік часу закінчують при помутнінні розчину.
