
- •Дмитрів а. М., Стецьків а. О., Сав’як о. Л. Фізична хімія Навчальний посібник
- •Івано-Франківськ – 2013
- •Передмова
- •Загальні правила роботи у лабораторії фізичної і колоїдної хімії
- •Правила техніки безпеки при виконанні робіт у лабораторії фізичної та колоїдної хімії
- •Основні правила надання першої допомоги при нещасних випадках
- •Розділ 1 Хімічна термодинаміка
- •Перший закон термодинаміки
- •1. Ізотермічний процес:
- •2. Ізохорний процес:
- •3. Ізобарний процес:
- •Термохімія
- •Залежність ентальпії реакції від температури. Рівняння кірхгофа
- •Приклади розв'язування задач
- •Заняття №1
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення теплового ефекту нейтралізації Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №2
- •Теоретична частина другий закон термодинаміки. Ентропія
- •Статистичний характер другого закону термодинаміки
- •Обчислення ентропії. Зміна ентропії у різних процесах
- •Третій закон термодинаміки. Абсолютне значення ентропії
- •Характеристичні функції
- •Термодинаміка хімічної рівноваги хімічний потенціал
- •Закон дії мас та константи рівноваги
- •Рівняння ізотерми хімічної реакції
- •Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Дослідження рівноваги оборотної хімічної реакції Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Вміст колб № 1-6
- •Питання для самоконтролю
- •Розділ 2 фазові рівноваги
- •Приклади розв'язування задач
- •Заняття №3 Тема: Термічний аналіз. Фазові перетворення в одно- і дво компонентних системах. Розподіл речовини між двома рідинами. Екстракція. Побудова діаграми стану бінарної системи.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Побудова діаграми стану бінарної системи нафталін-фенол
- •Експериментальна частина
- •Методичні вказівки
- •Склад зразків
- •Питання для самоконтролю
- •Розділ 3 розчини
- •ОсМотичний тик розчинів. Зниження температури замерзання і підвищення температури кипіння розбавлених розчинів неелектролітів
- •Приклади розв'язування задач
- •Заняття №4 Тема: Колігативні властивості розчинів. Визначення молярної маси розчиненої речовини методом кріоскопії.
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення молярної маси розчиненої речовини методом Раста Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Заняття №5 Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
- •Теоретична частина
- •Приклади розв'язування задач
- •Електропровідність розчинів електролітів
- •Приклади розв'язування задач
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Перелік питань, які виносяться на змістовий модуль 1
- •Лабораторна робота Визначення ізотонічного коефіцієнту розчину електроліту Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 4 електрохімія
- •Заняття №6 Тема: Електродні потенціали та електрорушійна сила гальванічних елементів. Окисно-відновні електроди. Потенціометричне визначення рН розчину.
- •Теоретичні відомості
- •Гальванічні елементи, їх класифікація
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Потенціометричне визначення рН водних розчинів Інформаційна частина
- •Експериментальна частина
- •Методичні вказівки
- •Результати вимірювань ерс хлорсрібно-скляного кола
- •Питання для самоконтролю
- •Поясніть, чому потенціал хлорсрібного електрода при даній концентрації кСl є сталим?
- •Заняття №7
- •Теоретичні відомості
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання для самоконтролю
- •Розділ 5 хімічна кінетика і каталіз
- •Методи визначення порядку реакції
- •Приклади розв’язування задач
- •Заняття № 8
- •Завдання для самостійної позааудиторної роботи
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Самостійна робота на занятті
- •Лабораторна робота Визначення константи швидкості реакції йодування ацетону
- •Експериментальна частина
- •Методика виконання роботи
- •Вивчення швидкості реакції йодування ацетону
- •Використовуючи рівняння (8.2) та значення Сац,0, сн,0, Сx і τ розраховують константу швидкості k.
- •Питання для самоконтролю
- •Заняття № 9
- •Теоретична частина вплив температури на швидкість реакції
- •Рівняння Арреніуса
- •Каталіз
- •Характерні особливості каталізаторів
- •Гомогенний каталіз
- •Кислотно-основний каталіз
- •Ферментний каталіз
- •Гетерогенний каталіз
- •Приклади розв’язування задач
- •Завдання для самостійної позааудиторної роботи і. Засвоїти основний матеріал навчальної програми
- •Іі. Дати письмові відповіді на контрольні запитання
- •Ііі. Розв’язати задачі
- •Перелік питань, які виносяться на змістовий модуль 2
- •Самостійна робота на занятті
- •Експериментальна частина
- •Методичні вказівки
- •Питання, які виносяться на модуль 1 «фізична хімія»
- •Банк тестів з фізичної хімії
- •1. Хімічна термодинаміка
- •2. Фазові рівноваги
- •3. Загальна характеристика розчиНів
- •4. Електрохімія
- •5. Хімічна кінетика
- •Засоби контролю знань студентів
- •Значення найважливіших фундаментальних сталих
- •Кріоскопічні та ебуліоскопічні константи деяких розчинників
- •Константи дисоціації деяких слабких електролітів при 25 °с
- •Стандартні ентальпії утворення ∆н0298, ентропії ∆s0298 та енергії Гіббса ∆g0298 деяких речовин при 298 к
- •Стандартні електродні потенціали деяких металів у водних розчинах
- •Перелік літератури Основна література
- •Додаткова література
Рівняння Арреніуса
Взаємодія частинок відбувається при їх зіткненнях, але кількість зіткнень молекул є дуже великою і, якби кожне зіткнення вело б до хімічної взаємодії частинок, всі реакції відбувались би практично миттєво. Арреніус постулював, що зіткнення молекул будуть закінчуватися реакцією лише в тому випадку, коли ці молекули матимуть певний запас енергії – енергію активації.
Енергія активації – це мінімальна енергія, яку необхідно надати молекулам, щоб їх зіткнення вело до хімічної взаємодії.
Хімічна взаємодія частинок пов'язана з розривом старих хімічних зв'язків і утворенням нових, вважають, що будь-яка елементарна реакція проходить через утворення нестабільної проміжної сполуки, яку називають активним комплексом.
Оскільки температура є мірою середньої кінетичної енергії частинок, збільшення температури веде до збільшення кількості частинок, енергія яких дорівнює або більша енергії активації, що веде до збільшення константи швидкості реакції.
Залежність константи швидкості реакції від температури більш точно виражає рівняння Арреніуса:
![]()
де Еа – енергія активації.
Для виведення рівняння Арреніуса було використано рівняння ізохори хімічної реакції
![]()
де К – константа рівноваги, ∆U – тепловий ефект реакції при V = const.
Як відомо, константа рівноваги дорівнює:
K = k1/k2,
де k1 та k2 – константи швидкості прямої та зворотної реакцій. Запишемо тепловий ефект як різницю: ∆U = Е1 – Е2, тоді передостаннє рівняння приймає вигляд:
![]()
звідси:![]()
![]()
Якщо Еа = const то інтегрування цього рівняння дає інтегральну форму рівняння Арреніуса:
![]()
![]()
де А – передекспоненційний множник.
Розрахунок енергії активації та передекспоненційного множника
Для розрахунку енергії активації за експериментальними даними використовують інтегральне рівняння Арреніуса, логарифмування якого дає:
![]()
Отже, lnk лінійно залежить від зворотної температури 1/Т, збільшення температури веде до збільшення швидкості реакції:
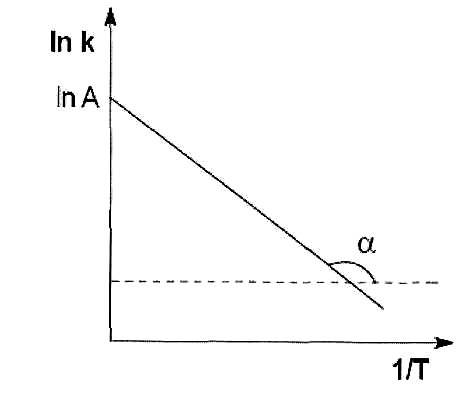
Передекспоненційний множник А визначається відрізком, який відсікає пряма на осі ординат при 1/T = 0.
Значення Еа знаходять за тангенсом кута нахилу, оскільки:
![]()
Якщо визначено константи швидкості реакції при двох різних температурах, то одержуємо:
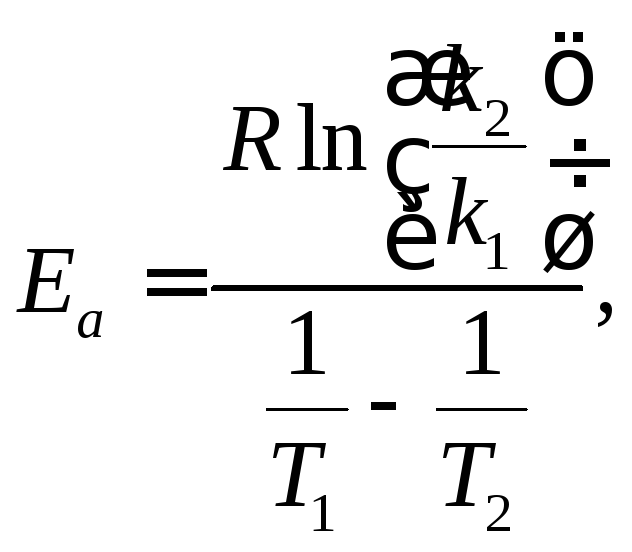
де k1 та k2 – константи швидкості при Т1 і Т2. Енергію активації вимірюють у Дж/моль. Розмірність параметру А збігається з розмірністю константи швидкості. Еа і А не залежать від температури в достатньо вузькому температурному інтервалі.
Каталіз
Каталіз – вплив речовини на реакцію, який вибірково змінює її кінетику, але зберігає її стехіометрію і термодинамічні умови. Цей вплив полягає в заміні одних елементарних процесів іншими, циклічними, в яких приймає участь ця речовина. Каталізатор в кінцевому результаті в ході реакції не змінюється та не зсуває рівновагу.
Каталітичні реакції дуже поширені в природі. Швидкість всіх біохімічних процесів регулюється біологічними каталізаторами – ферментами.
За фазовою ознакою розрізняють:
гомогенний каталіз – реакції в газах і розчинах, коли каталізатор і реагенти утворюють одну фазу;
гетерогенний каталіз – реакції на межі поділу фаз принципова відмінність якого від гомогенного полягає в тому, що стадії перетворення передує адсорбція, а властивості каталітично активних ділянок залежать від властивостей поверхні твердого тіла;
мікрогетерогенний каталіз – каталіз ферментами і колоїдами. Особливість мікрогетерогенного каталізу полягає в тому, що реакційна система є розчином, але розміри молекул реагентів набагато менше розмірів макромолекул каталізатора і має місце адсорбція як в гетерогенних системах.
Активність каталізаторів часто визначають числом обертів. Для гомогенних систем це швидкість каталітичної реакції, віднесена до концентрації каталізатора, а для гетерогенних – до числа центрів на одиниці поверхні (а оскільки кількість активних центрів визначити важко, то просто до одиниці поверхні) каталізатора. В гомогенному каталізі ця величина приблизно дорівнює одиниці або менше, в комплексному і гетерогенному – до 104 , а в ферментному – до 105. Швидкість реакції за наявності каталізатора дорівнює сумі швидкостей каталітичної і некаталітичної стадій. Оскільки швидкість останньої звичайно суттєво менше, тому її не враховують.
