
- •Болезни в трех томах
- •Общая часть
- •8 Список сокращений
- •Основные сведения об инфекционных болезнях
- •Классификация инфекционных болезней
- •2 Ж. Возианова
- •Принципы лечения инфекционных болезней
- •Характер взаимодействия с микро-и макроорганизмом
- •Возможные побочные реакции
- •II. Аминогли-козиды
- •III. Тетрацик-лины
- •Специфическая профилактика инфекционных болезней
- •Заболевания преимущественно с воздушно-капельным механизмом передачи
- •1Ейраминидаза
- •Действие на факторы клеточного и гуморального иммунитета
- •Формирование антитоксического иммунитетаСтимуляция местных факторов защиты, в том числе завершенного фагоцитоза
- •Функциональные нарушения
- •Механизмов защиты
- •Внедрение микоплазм в слизистую оболочку дыхательных путей
- •Заболевания преимущественно с фекально-оральным механизмом передачи
- •Размножение сальмонелл в тонкой кишке
- •Вегетативная нс
- •Заболевания, вызываемые иерсиниями
- •Желудке (высвобождение эндотоксина при этом незначительное)
- •Непосредственное повреждающее действие шигелл на слизистую оболочку толстой кишки
- •Серогруппа 01 (холерные)
- •Всасывание фрагментов вибрионов в кровь Образование различных факторов агрессии
- •Выработка вибриоцидных антител
- •Структура и функции печени
- •Методы диагностики, использующиеся при обследовании больных вг, и их оценка
- •21 Ж. Возианова
- •Особенности лечения больных вирусным гепатитом с затяжным течением
- •Заболевания, вызываемые вирусами
- •Энтеровирусами Паралитические формы (полиомиелитоподобные заболевания)
- •Асептический серозный менингит
- •Энтеровирусный энцефалит
- •Синдром Гийена—Барре (полирадикулоневрит)
- •Острые респираторные заболевания («летний грипп»)
- •Лихорадка с экзантемой
- •Везикулярный стоматит с экзантемой (ящуроподобный синдром)
- •Герпетическая ангина (герпангина)
- •Эпидемический конъюнктивит
- •Энтеровирусная диарея (летние гастроэнтериты)
- •Энтеровирусный гепатит
- •Эпидемическая миалгия (плевродиния, борнхольмская болезнь)
- •Энтеровирусная инфекция у новорожденных
- •Бессимптомная инфекция
- •Лечение нематодозов
- •Лечение цестодозов
- •Протозойные заболевания
- •1Нфекц1йн1 I паразитарн1 хвороби
21 Ж. Возианова
Осложнения. ВГВ протекает более тяжело, чем ВГА, осложнения при этом заболевании регистрируются чаще и они более тяжелые. Так, значительно чаще возникают фульминантные формы, летальность при которых достигает 30—50%.
При ВГВ могут возникать такие же осложнения, как и при ВГА, но возможны и осложнения другого характера. ^
У людей, уже имеющих хроническое заболевание печени, возможно появление отеков, асцита (отечно-асцитическая форма). Основная причина — нарушение синтеза альбуминов, изменения онкотического давления, портальная гипертензия. Они встречаются при подостром гепато-некрозе. Кроме асцита, отеков при этом выявляют резко выраженную спленомегалию, расширение вен на передней брюшной стенке.
Повреждение костного мозга ИК приводит к развитию апластичес-кой анемии. Это довольно редкое осложнение, но прогноз всегда неблагоприятен.
Отложения в почках комплемента и иммунных комплексов с НВеАд у лиц с длительным течением ВГВ, длительной циркуляцией в крови НВеАд сопровождаются развитием мембранозного гломерулонефрита, в сосудах — узелкового периартериита. Описывают и более редкие осложнения — синдром Гийена — Барре, поражение эндокринных желез (поджелудочной, щитовидной, половых), миокардит, перикардит, фиброзирующий альвеолит и др. В основе большинства внепеченочных поражений лежат аутиммунные процессы, хотя возможность внепече-ночной репликации вируса не исключает непосредственного действия вируса и ИК.
Исходы. Циклическое течение ВГВ с нормальной реконвалесценци-ей наблюдается у 80—85 % больных. У подавляющего большинства из них болезнь заканчивается полным выздоровлением.
Особенностью ВГВ является вероятность формирования носительства HBsAg как при легком и бессимптомном течении, так и при тяжелом. Вероятность формирования носительства даже больше при легком течении, что обусловлено недостаточным иммунным ответом и как следствие — неполной элиминацией возбудителя. Кроме того, HBV содержит пептиды, которые способны защищать инфицированную вирусом клетку от лизиса, что способствует сохранению HBV в печени. При носительстве вирус персистирует в гепатоцитах, не разрушая их. Хроническое носительство формируется у 6—15 % лиц, перенесших ВГВ. К носительству HBsAg отношение неоднозначное. В настоящее время все большее подтверждение находит мнение, что «здоровое носительство» — это наиболее доброкачественно протекающий вариант хронического ВГВ—НВеАд-негативного.
У 15—20 % больных ВГВ с затяжным течением нередко формируется хронический гепатит. Переходу в хроническую форму способствуют алкоголизм, нарушение питания, наличие сопутствующих заболеваний и другие факторы, в том числе генетические, при этом существенную роль играют не только генетические особенности вируса (его генотип, субтип), но и человека. Велика роль и вирусов-мутантов, которые не распознаются специфическими противовирусными антителами. Особенности течения инфекционного процесса на раннем этапе развития болезни определяются цитотоксичностью Т-лимфоцитов: если они перестают контролировать этот процесс, создаются условия для хронизации.
Вероятность хронизации иногда можно предсказать. Ее возможными предшественниками являются:
длительная (до 50—90 дней) HBs-антигенемия с высокими титрами HBsAg;
персистирование НВеАд более 6—8 нед после острой фазы, позднее появление анти-НВе.
До последнего времени хронический ВГВ было принято делить на хронический активный гепатит (ХАГ) и хронический персистирующий гепатит (ХПГ). В 1994 р. Международная рабочая группа (IWP) и Всемирный конгресс гастроэнтерологов (WCOG) признали эти термины неприемлемыми, заменив их общим термином «хронический гепатит В». По определению WCOG, «хронический вирусный гепатит — воспалительное заболевание печени, вызываемое HBV, длящееся 6 мес или более и способное привести к циррозу или быть ассоциированным с циррозом».
Выражение «быть ассоциированным с циррозом» наиболее вероятно означает следующие возможности:
хронический гепатит В присоединяется к уже имеющемуся циррозу другой этиологии;
хронический гепатит В протекает параллельно с формирующимся циррозом одноименной природы и определяет степень активности процесса (не стадию!).
О степени активности процесса можно судить по уровню и динамике специфических печеночных ферментов, белка, наличию и соотношению маркеров ВГВ, однако эти показатели сейчас не считаются достаточно убедительными. Оценить активность процесса в печени поможет исследование пунктатов печени с определением индекса гистологической активности.
При хроническом ВГВ в крови появляются специфические антитела к клеткам печени, отдельным фрагментам клеток печени, а также к другим тканям (щитовидной железы, клеткам костного мозга и т.д.). Быстрота прогрессирования процесса определяется множеством факторов.
Присоединение аутоиммунного компонента к хроническому ВГВ приводит к более тяжелому течению заболевания, быстрому прогрес-сированию патологического процесса.
Хронический ВГВ может приводить к развитию цирроза печени, а наслоившись на уже имеющийся цирроз, усиливать деструктивные процессы в печени и таким образом ухудшать прогноз.
При циррозе печень становится плотной, нередки отеки, асцит, появляются «сосудистые звездочки», пальмарная эритема. Периоды ремиссии при этом практически отсутствуют. Заболевание протекает с выраженными признаками нарушения функции печени (в том числе почти постоянно регистрируется высокая активность АлАТ), селезенки (вплоть до явлений гиперспленизма), эндокринными расстройствами, васкулитом, аллергическими реакциями, отчетливо выявляется полисистемность поражений. Такие больные умирают обычно от острой печеночной недостаточности, кровотечений, осложнений со стороны других органов (например, агранулоцитоз), сепсиса.
Заболевание благоприятнее протекает у мужчин. Большая тяжесть течения у женщин обусловлена, как полагают, особенностями гормональной функции (наличием эстрогенов).
Первичный рак печени (гепатоцеллюлярная карцинома) может быть исходом ВГВ (острый ВГВ-»хронический гепатит-»цирроз-»рак), но иногда возникает, не проходя все эти стадии. Этот патологический процесс может развиваться и при легком течении ВГВ и даже у вирусоно-сителей. Наиболее высокая группа риска — дети, родившиеся от инфицированных матерей. К развитию гепатоцеллюлярной карциномы предрасполагает длительное персистирование вируса в гепатоцитах, чаще она развивается на фоне цирроза, но особая роль принадлежит Х-белку HBV, индуцирующему мутацию в ядре инфицированного гепатоцита с последующим развитием опухолевых клеток. В свою очередь, в ткани гепатоцеллюлярной карциномы происходит мутация HBV, а это затрудняет распознавание HBV-инфекции, спровоцировавшей развитие опухоли. Заболевание характеризуется быстро прогрессирующими симптомами общей интоксикации, быстрым увеличением печени, ее плотностью. Однако степень увеличения печени, наличие или отсутствие болевого синдрома, желтухи и прочих признаков, позволяющих думать о раке печени, в значительной мере определяются локализацией рака, его размерами, быстротой прогрессирования процесса. Полагают, что опухоль более 2—3 см в диаметре практически уже неоперабельна. Особым признаком гепатокарциномы является заметное повышение уровня ЩФ даже при отсутствии желтухи. Активность других ферментов может быть увеличена незначительно. Характерны быстрое похудание, диспепсические явления, тупая ноющая боль в правом подреберье.
Летальность при ВГВ достигает 1—3 %, наиболее высока она при фульминантных формах и развитии ОПЭ.
Специфическая диагностика ВГВ. Диагноз ВГВ подтверждают обнаружением его антигенов в сыворотке крови или антител к различным антигенам. Сроки появления и длительность циркуляции отдельных антигенов и антител, их сочетания позволяют определить остроту процесса, а в отдельных случаях прогнозировать дальнейшее течение и исход заболевания.
Для выявления антигенов и антител при ВГВ наиболее широко используют РИА и РФА.
HBsAg появляется в крови рано — уже через 1—2 нед после инфицирования. Однако концентрация его столь мала, что вышеназванными методами он не определяется еще очень долго, у большинства больных его удается обнаружить лишь спустя несколько месяцев после заражения. Закономерно HBsAg появляется в значительных количествах в сыворотке крови перед началом заболевания (за неделю и ранее), достигает максимальной концентрации в разгар болезни, исчезая в период реконвалесценции. При неосложненном среднетяжелом течении длительность HBs-антигенемии обычно не превышает 6—8 нед. Чем дольше выявляется у больных HBsAg, тем больше вероятность перехода острого ВГВ в хронический ВГВ, носительства. Таким образом, обнаружение у больного HBsAg не является абсолютно достоверным доказательством острого ВГВ: это может быть признаком носительства HBV и даже гепатоцеллюлярной карциномы. Но и отсутствие HBsAg не может служить основанием для снятия диагноза острого ВГВ. Причинами отрицательной реакции могут быть малая, не улавливаемая стандартными методами, концентрация HBsAg в крови, «серологический пробел», потребление HBsAg D-вирусом. Кровь при этом своей инфекционности не теряет. Не следует забывать и о pre-s-мутантах.
Анти-HBs появляются на 4—12-й неделе после заражения, но быстро связываются с циркулирующим HBsAg, поэтому в крови инфицированного антитела можно обнаружить после исчезновения HBsAg. Период между исчезновением HBsAg и появлением в крови анти-HBs называется «серологическим пробелом», он может составлять 1—2 нед и более. При этом в крови не определяются ни HBsAg, ни анти-HBs. Несмотря на отсутствие HBsAg, кровь в это время своей инфекциозности не теряет. Титры антител растут медленно, достигая наиболее высоких показателей через 6—12 мес после исчезновения HBsAg. Наиболее высокие титры анти-HBs обнаруживают у лиц с кратковременной антиге-немией. Анти-HBs — долгоживущие антитела. Сохраняясь в достаточно высоких титрах у реконвалесцента до 5 лет, они защищают его от повторного заражения. Но анти-HBs в относительно невысоких титрах можно обнаружить и спустя 10 лет после перенесенного заболевания. Существуют данные о том, что у подавляющего большинства больных хроническим ВГВ анти-HBs не обнаруживаются.
Наличие анти-НВс в крови — наиболее надежный показатель активной вирусной репликации. В крови их обнаруживают с первыми клиническими проявлениями болезни, хотя появляются они уже через 3—5 нед после заражения. Титры анти-НВс растут, пока в крови обна
руживают HBsAg, после его исчезновения они начинают снижаться. Субклинические формы ВГВ дают низкие титры анти-НВс.
В первые месяцы болезни сначала выявляют анти-НВс класса IgM, затем — анти-НВс IgG. На 4—6-м месяце болезни у некоторых больных можно обнаружить как IgM, так и IgG.
Анти-НВс IgG у реконвалесцентов сохраняются годами, а при хроническом ВГВ их можно обнаружить практически постоянно. При обострении процесса в печени, сопровождающегося репликацией вируса, снова могут выявляться наряду с анти-НВс IgG и анти-НВс IgM.
НВеАд — показатель интенсивной вирусной репликации. Появляется в крови обычно одновременно с HBsAg. Концентрация НВеАд определяет в значительной мере степень инфекционности крови.
Определить в крови больного НВеАд можно с первых дней болезни. Если НВеАд сохраняется более 10 нед, можно думать о возможности формирования хронического гепатита. Обычно НВеАд перестает определяться раньше, чем HBsAg. Но НВеАд может не определяться при инфицировании рге-соге-мутантами.
Анти-НВе появляются в крови после исчезновения НВеАд (наступает сероконверсия). Раннее появление их свидетельствует о благоприятном течении ВГВ, в крови они сохраняются до 2 лет (рис. 28).
Продром
ж
Клинические проявления
Желтуха
Пороговый
уровень в крови
Месяцы
после
заражения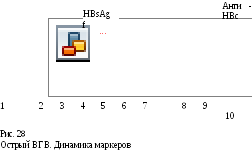
Основным недостатком всех вышеперечисленных методов является недостаточная чувствительность тест-систем, позволяющих определять соответствующие маркеры лишь при достаточно высокой их концентрации в крови. В последние годы все более широкое распространение получает ПЦР-полимеразная цепная реакция (PCR — polymerase chain reaction), отличающаяся не только очень высокой чувствительностью, но и очень высокой специфичностью. Это — маркер активной репликации вируса, позволяющий определять вирусную ДНК даже при отсутствии других маркеров в крови. Еще одним маркером активности процесса является фермент ДНК-полимераза, который информативен при исследовании больных с острым и хроническим ВГВ.
Если раньше пункционную биопсию печени производили редко, главным образом с целью уточнения этиологии гепатита при хронической патологии печени, то сейчас это — одно из обязательных исследований, помогающих решить вопрос об активности процесса при хронических гепатитах. Так, гистологический индекс активности Knodell (HAI) рассчитывают по соотношению частоты перипортальных мосто-видных некрозов, фокальных некрозов, портального воспаления и фиброза. Такой метод дает значительно более надежную информацию о характере процесса в печени, тем более что полученные данные не всегда коррелируют с биохимическими показателями.
Примерная формулировка диагноза. 1. Острый вирусный гепатит В (HBsAg+ ), желтушная форма, циклическое среднетяжелое течение.
Затяжной вирусный гепатит В (НВеАд +), ациклическое (с рецидивами) среднетяжелое течение.
Холестатическая форма ВГВ (HBsAg +, анти-НВе + ), затяжное среднетяжелое течение.
4. Фульминантный острый ВГВ. ОПЭ III степени. Профилактика. Общая профилактика ВГВ включает :
своевременное выявление больных с различными формами ВГВ и вирусоносителей (особое внимание необходимо уделять группам риска), изоляцию и санацию больных ВГВ;
контроль за службой крови, регулярное обследование доноров на наличие HBsAg и других маркеров; ограничение показаний к переливанию крови и ее препаратов;
использование систем разового пользования для парентеральных манипуляций;
ограничение показаний к парентеральным манипуляциям;
использование специалистами, работающими с инфицированным материалом, индивидуальных средств защиты (перчатки, очки).
Специфическая профилактика ВГВ делится на активную и пассивную.
Активная профилактика заключается в проведении вакцинации. Многие вакцины созданы еще в 70-е годы.
Используют два типа вакцин — плазменную и рекомбинантную.
Плазменную вакцину готовят из высокоочищенного HBsAg, полученного из крови вирусоносителей с высоким его содержанием.
Рекомбинантная вакцина произведена на основе HBsAg из рекомби-нантных штаммов, культивируемых на дрожжах. Наиболее известны Recombivax НВ, Engerix-B.
Взрослых (группы риска) вакцинируют троекратно: вторую дозу вводят через 1 мес после первой, третью — через 6 мес после первой. Дозировки приводятся в соответствующих инструкциях, так как свойства вакцин различны. Если после окончания полного курса вакцинации контрольные исследования показывают, что уровень антител ниже 100 МЕ/л, вводят еще одну бустерную дозу. При правильно проведенной вакцинации и хорошей реактивности организма уровень антител 100—1000 МЕ/л сохраняется до 2 лет, затем постепенно начинает снижаться.
Полагают, что бустерная доза должна быть назначена, если уровень антител падает ниже 10 МЕ/л. В большинстве случаев такая необходимость возникает через 4 года — 6 лет, иногда — позже.
Особого внимания заслуживает вакцинация детей, особенно в регионах с высоким уровнем заболеваемости ВГВ. Таких детей вакцинируют троекратно (на первом месяце жизни, через 1 мес, а затем через 6 мес после первой вакцинации). Дети, родившиеся от матерей — носителей HBV или больных ВГВ, подвержены высокой степени риска заболеть ВГВ. Поэтому такому ребенку профилактические мероприятия (активно-пассивная иммунизация) проводят еще в родзале: сразу после рождения или в течение первого часа вводят 0,5 мл иммуноглобулина против ВГВ (HBIg) с высокой концентрацией антител. С интервалом в несколько часов вводят HBV-вакцину. В дальнейшем вакцину вводят через 1 и 6 мес после первой дозы, но существует мнение, что эффективность профилактических мероприятий у детей, рожденных от инфицированных матерей, повышается, если специфический иммуноглобулин будет введен не только при рождении ребенка, но и в трех- и шестимесячном возрасте.
В Украине вакцинация детей против ВГВ была включена в график вакцинопрофилактики в 1996 г. Однако контингента для вакцинации и предложенные схемы введения вакцин нуждаются в уточнении.
Отношение к вакцинации пока неоднозначное, несмотря на отчетливо выраженный протекторный иммунитет. Существуют, например, данные, что у привитых чаще обнаруживается мутантный HBV, а мутация может быть причиной того, что не вырабатывается иммунитет после прививки.
Показана вакцинация:
в группах риска по ВГВ (см. эпидемиологию ВГВ);
детям, родившимся от матерей, инфицированных HBV;
пациентам и персоналу отделений гемодиализа;
лицам, часто получающим различные инъекции;
— медицинскому персоналу, имеющему контакт с кровью и другими биологическими жидкостями различных больных, в том числе с ВГВ.
Для пассивной иммунизации используют гипериммунный иммуноглобулин, получаемый из плазмы крови доноров с высоким уровнем антител к HBsAg. Контактным из групп риска его вводят в дозе 0,06 мл/кг массы тела, желательно в течение первых 24—48 ч после контакта. Эффективность действия иммуноглобулина сомнительна при его введении через 7 дней и позже после предполагаемого инфицирования.
Порядок выписки из стационара. Реконвалесцентов выписывают из стационара не ранее чем через 3 нед от начала заболевания при условии клинического выздоровления. Умеренная гепатомегалия может сохраняться, но желтуха должна отсутствовать (у некоторых больных уровень билирубина в крови может превышать норму не более чем в 1,5—2 раза). НВеАд в крови не должен определяться, уровень цитоли-тических ферментов не должен превышать норму более чем в 1,5—2 раза. В течение 1-го месяца после выписки реконвалесцента наблюдает врач стационара (1 раз в 10—14 дней), затем — врач КИЗа. Контрольные осмотры проводят каждые 3 мес, при необходимости чаще. С диспансерного учета больного можно снимать при отсутствии HBsAg в крови и признаков хронизации.
Реконвалесцентов допускают к работе не ранее чем через 4—5 нед после выписки из стационара, независимо от тяжести течения. Все реконвалесценты освобождаются от тяжелых работ и физкультуры на 6—12 мес. В течение 6 мес противопоказаны любые прививки, плановые операции.
Сочетанное течение ВГА и ВГВ. В последнее время участились случаи, когда у больного одновременно диагностируют ВГА и ВГВ. Особенности течения такого сочетанного патологического процесса изучают, но уже в настоящее время существуют разные точки зрения на патогенез гепатитов-микст. Основные гипотезы оппонентов такие:
Одновременное инфицирование не сказывается на тяжести течения гепатитов, а обе инфекции развиваются как бы независимо друг от друга.
На высоте ВГА происходит временное угнетение размножения HBV. Это явление пытаются объяснить действием эндогенного интерферона, в результате чего такая инфекция-микст может протекать легче.
Для того чтобы достоверно можно было судить о характере взаимного влияния HAV и HBV, нужно знать, одновременно произошло заражение или речь идет о суперинфекции HAV, произошло инфицирование HAV носителя HBsAg или больного с активным процессом (возможны и другие варианты).
Достоверные сведения могут быть получены только при использовании во время обследовния больных всех маркеров HAV и HBV в динамике.
вирусный гепатит d
Вирусный гепатит D, син. — дельта-гепатит (англ. — hepatitis D).
Этиология. Возбудитель — HDV ■— представитель нового вида вирусов. Он занимает промежуточное положение между вирусами и вирои-дами, его классифицируют как рибозим. Это — дефектный «голый» вирус, не имеющий оболочки. HDV —простая частица, имеющая размеры 35—37 нм, содержащая в ядре кольцевидную одноцепочечную РНК. Свою оболочку вирус строит из HBsAg HBV. Эта оболочка необходима для проникновения вируса через мембрану гепатоцита.
В настоящее время вирус активно изучают, благодаря чему постоянно поступает новая информация. Доказано, что HDV существует в двух формах •— малой и большой, которые различаются по активности репликации, степени патогенности. Малая форма обладает большей пато-генностью.
Течение ВГО в значительной мере определяется генотипом вируса. В настоящее время-определяется три генотипа HDV: I (субтипы 1а и lb), И, III. I генотип встречается у жителей России, он нередко сочетается с гепатоцеллюлярной карциномой и циррозом печени. У жителей Южной Америки чаще обнаруживают HDV III генотипа. Второй генотип чаще встречается у жителей Тайваня. Он вызывает менее тяжелое течение заболевания, реже возникает и хронизация процесса.
Не случайно, по-видимому, более чем у 40% больных, у которых возникали фульминантные формы ВГВ, обнаруживают и HDV.
Особенностью HDV является способность неблагоприятно воздействовать на CD4 клетки и Т-лимфоциты.
Вирус устойчив к действию высоких температур и кислот, но разрушается в щелочной среде.
Эпидемиология. Источником инфекции является больной острым или хроническим ВГО или носитель HDV.
Основной путь передачи — парентеральный, как и при ВГВ. Вертикальный путь существенной роли не играет. Не исключают возможности передачи вируса с помощью кровососущих насекомых. Часто вирус выявляют у больных болезнью Дауна, убедительного объяснения этому феномену пока нет.
Факторы передачи HDV — кровь и другие биологические жидкости. Широкое использование иммуноглобулинов увеличивает риск распространения ВГО.
Группы риска по BTD те же, что и при ВГВ. Но заболевание развивается лишь у лиц, имеющих HBsAg (больных или носителей), хотя вирус инфицирует и HBsAg-отрицательных лиц.
Наиболее распространено носительство HDV в некоторых регионах Среднего Востока, в Венесуэле, на юге Италии, в Сибири. Во многих странах не предусмотрена обязательная регистрация ВГО, поэтому об истинной распространенности этой патологии судить трудно. Тем не менее, есть регионы, где ВГО встречается даже в виде эпидемий с высокой летальностью (лабрийская лихорадка в Бразилии, гепатит Сан-Марта в Колумбии).
Как выяснилось в последние годы, ВГО не относится к числу «новых» заболеваний: в США антитела к HDV обнаружены в препаратах иммуноглобулинов, приготовленных еще в 1944 г.
Патогенез. Путь внедрения вируса в организм такой же, как при ВГВ. Током крови вирус заносится в печень, где проникает в ядро гепатоцита. РНК вируса имеет кольцевую или нитчатую структуру, однако репликация 'полноценного вируса возможна только при наличии HBsAg, то есть только при острой или хронической ВГВ-инфекции, при которой HBsAg синтезируется в цитоплазме гепатоцита, попадая затем в кровь. HDV ингибирует синтез генома и генетических продуктов HBV в ядре, но использует HBsAg для построения своей оболочки. Таким образом, при ВГО угнетается репликация HBV. Образование новых вирусных частиц идет до тех пор, пока есть «строительный материал» — HBsAg. HDV без HBsAg не способен вызвать заболевание, но он может сохраняться в ядре гепатоцита и даже реплицироваться в небольших количествах за счет своего HBsAg. Аутоиммунными процессами сопровождается лишь 50% случаев хронического ВГО. Отсутствие эффекта от применения иммуносупрессивных препаратов при ВГО можно объяснить отсутствием иммунного воспаления. В результате непосредственного цитопатогенного действия вируса в печени возникают обширные поля некроза уже в начальный период заболевания в сочетании с признаками портального и лобулярного воспаления. В ходе болезни формируются и имунные реакции — появляются специфические антитела — анти-HDV. При одновременном инфицировании HBV и HDV чаще возникает острая инфекция. Это обусловлено действием на клетку одновременно двух вирусов с различным механизмом повреждения, это же является причиной частого развития тяжелых и фуль-минантных форм. При суперинфицировании HDV чаще формируются хронические формы. ВГО, таким образом, по своей сути — инфекция-микст.
Иммунные к ВГВ лица, у которых в сыворотке обнаруживают ан-ти-HBs и анти-НВе, невосприимчивы к HDV, как и те, у кого отсутствуют все маркеры HBV.
Клиника. Течение острого ВГИ протекает в двух вариантах.
Первый вариант (коинфекция) возникает при одновременном заражении HBV и HDV. От ВГВ возникшее при этом заболевание отличается прежде всего более коротким инкубационным периодом.
Уже в преджелтушный период у 60% больных бывает повышение температуры (иногда до высокой), у 30% больных лихорадка сохраняется и в желтушный период. Возможно и постепенное начало с выраженным диспепсическим синдромом (тошнота, рвота), артралгиями.
Характерным признаком этого варианта течения острого ВГО является рано появляющаяся боль в правом подреберье и надчревной области, сохраняющаяся иногда в течение всего периода болезни.
Остальные клинические проявления и течение заболевания типичны для ВГВ, но при сочетании с ВГО обычно наступает вторая волна клинических проявлений заболевания, которая, как правило, без проведения специальных исследований с использованием маркеров расценивается как рецидив ВГВ. Кроме того, в желтушный период может длительно (до 2 нед) сохраняться субфебрилитет, нередко появляется полиморфная сыпь.
Почти у половины больных заболевание протекает тяжело, чаще, чем при других ВГ, возникают фульминантные формы с высокой летальностью. Чаще, чем при других способах заражения, фульминантные формы развиваются при внутривенном инфицировании (при переливании крови и ее компонентов), что, вероятно, связано с поступлением большого количества HBV и HDV. Длительность антигенемии коррелирует с тяжестью течения ВГО.
Затяжное течение для коинфекции, однако, не характерно, хронический гепатит после перенесенного заболевания формируется редко.
Второй вариант (суперинфекция) характеризуется наслоением HDV-инфекции на ВГВ, протекающий в форме острого или хронического гепатита, а также в форме носительства. Тяжесть течения заболевания обусловлена при этом главным образом длительностью предшествовавшего самостоятельного воздействия на печень HBV.
Обычно начинается заболевание как ВГВ, но в дальнейшем болезнь характеризуется волнообразным течением (периодические клинические и ферментативные обострения) и быстрым нарастанием неблагоприятных признаков, свидетельствующих о хронизации: плотная печень, "сосудистые звездочки", пальмарная эритема и т.д. Часто развивается отечно-асцитическая форма. Для этого варианта течения острого ВГО характерна триада симптомов: озноб, повышение температуры, отечно-асцитический синдром. Ему свойственен и быстрый исход в хронический гепатит, а затем в цирроз печени (ранний). Выздоровление без остаточных явлений наблюдается лишь у 10 % больных. Фульминантные формы возникают нередко.
Примерно у 6—7 % больных острый ВГО протекает в безжелтушной форме, а у отдельных больных может проявляться только повышением активности цитолитических ферментов.
При легком течении ВГВ HDV выявляют примерно у 1—2 % больных, среднетяжелом — у 3—5 %, тяжелом — до 30 %, при фульминант-ных формах — наиболее часто.
HDV-суперинфекция у здоровых носителей HBV может привести к тяжелому поражению печени.
Хронический ВГИ клинически полиморфен, похож на хронические гепатиты другой этиологии. У 1/3 больных длительно сохраняются желтуха, астеновегетативный синдром. Характерно снижение аппетита, прогрессирующее снижение массы тела. Рано обнаруживаются вторичные печеночные знаки (пальмарная эритема, "сосудистые звездочки"). Нередко возникают геморрагический и отечно-асцитический синдромы. Основная особенность хронического ВГО — быстрое (в течение 1 года — 2 лет) прогрессирование с исходом в цирроз печени.
Процесс протекает волнообразно, с короткими неполными ремиссиями, периоды обострений характеризуются выраженной диспротеине-мией, гиперферментемией, повышенной тимоловой пробой, но даже в короткие периоды ремиссий полная нормализация этих показателей не наступает. Возможны кратковременные повышения температуры, желтуха. Увеличение селезенки может быть значительным и сочетаться с признаками гиперспленизма.
Особенно активно хронический процесс протекает в первые месяцы и годы после инфицирования HDV.
Осложнения, исходы. Осложнения, исход при ВГО такие же, как и при ВГВ, что не случайно, так как, по существу, имеет место инфекция-микст (ВГВ + ВГО), HDV усиливает некрогенное действие HBV. Чаще при такой микст-патологии возникает цирроз печени.
Специфическая диагностика. Для выявления антигенов HDV используют те же методы, что и при ВГВ.
В течение 1-й недели заболевания в сыворотке крови можно обнаружить HDV, затем быстро наступает сероконверсия. HDV длительно (пока больной жив) обнаруживают в крови лишь при фульминантных формах.
Анти-HDV класса IgM в крови появляются сразу после исчезновения HDV и сохраняются обычно до 4 нед. Более длительное выявление IgM обычно свидетельствует о явной угрозе хронизации, так как иммуноглобулины этого класса отражают активность вирусной репликации. Анти-HDV класса IgG появляются несколько позже, а после 4—5 нед полностью сменяют IgM. Но при суперинфекции в крови довольно длительное время можно обнаружить иммуноглобулины обоих классов одновременно. При хроническом ВГО длительное время (годы) обнаруживают в высоких титрах анти-HDV IgG, а при обострениях одновременно появляются и анти-HDV IgM.
При ВГО в крови могут одновременно обнаруживаться и различные маркеры HBV — HBsAg, НВеАд, анти-НВс и другие (их сочетание оп
ределяется периодом и тяжестью болезни). При всех вариантах течения BTD в период активной репликации вируса методом ПЦР можно обнаружить HDV — РНК. Поэтому этот метод может использоваться для контроля эффективности лечения и прогнозирования исходов.
При сочетании ВГВ с ВГО из крови может исчезать HBsAg. Поэтому во всех случаях, когда у больного с явными признаками ВГВ отсутствует HBsAg или обнаруживается только анти-НВс, необходимо исключить наличие сопутствующей D-инфекции либо pre-S-мутант ВГВ. Маркеры HDV следует искать в сыворотке крови и у всех больных с фульминантными формами ВГВ.
У больных с циррозом персистирование HDV и HBV свидетельствует о большой вероятности возникновения гепатоцеллюлярной карциномы в ближайшие годы.
Примерная формулировка диагноза. 1. Острый вирусный гепатит D (анти-HDV IgM + ), желтушная форма, затяжное среднетяжелое течение. Носительство HBsAg.
2. Микст-гепатит (ВГВ + ВГО; HBsAg+ , анти-HDV IgM-f).
Следует, однако, помнить, что далеко не всегда, особенно если нет возможности использовать все необходимые маркеры, можно решить вопрос о том, имеет ли место носительство HBsAg или острый ВГВ. Поэтому чаще в тех случаях, когда у больного на фоне острого ВГ обнаруживают HBsAg и анти-HDV IgM, ставят диагноз:
Гепатит-микст (вирусный гепатит В + вирусный гепатит D). Конечно, очень ценно, если удается установить, протекает ВГО в этом случае по типу коинфекции или суперинфекции, поскольку это позволяет уточнить давность процесса, прогнозировать течение и исход заболевания, но удается это пока редко.
Профилактика. Общая профилактика аналогична таковой при ВГВ. Так как широкое применение иммуноглобулинов увеличивает риск возникновения ВГО, следует ограничить показания к их применению (далеко не во всех странах тестирование на HDV обязательно).
В настоящее время изучают перед широким внедрением в практику рекомбинантную вакцину против ВГО. Поскольку для возникновения ВГО необходим HBsAg, специфическая профилактика ВГВ является одновременно и защитой от ВГО.
вирусный гепатит с
Вирусный гепатит С (англ. — hepatitis С).
Этиология. Возбудитель ВГС — HCV, он относится к роду Flavi-viridae, куда также входит возбудитель желтой лихорадки. Это представитель «новых» вирусов, так как лишь в 1989 г. Choo и соавторы описали его, выделив из группы ни А, ни В гепатитов с парентеральным механизмом передачи (геном HCV был первоначально выделен из плазмы искусственно инфицированных шимпанзе, больных хроническим гепатитом) .
HCV содержит однонитевую линейную РНК, имеет липидную оболочку, размеры его 30—50 нм. Геном HCV состоит из 10 ООО нуклеоти-дов. Еще не все протеины изучены, не известна и их роль в патогенезе. Наиболее изучены нуклеокапсидный протеин (С) и вирусные оболоче-чные гликопротеины (Ej, Е2).
HCV обладает наибольшей вариабельностью среди всех вирусов — возбудителей ВГ. Мутации происходят под действием самых различных факторов -— медикаментов, других вирусов, бактерий и т.д. Такая способность HCV обеспечивает его наибольшую защищенность в организме инфицированного человека, прежде всего от антител, которые не в состоянии распознать мутантные вирусы. Результатом этого является неспособность HCV-инфекции к самолимитированию. Вирус обладает способностью поражать не только гепатоциты, но и клетки крови (нейтрофилы, моноциты, В-лимфоциты), мнение о возможном воздействии на Т-лимфоциты неоднозначно.
В настоящее время выделено и изучается не менее 6 генотипов и множество субтипов вирусов, которые различаются по степени вирулентности, эффективности взаимодействия с лекарственными препаратами и другим факторам. И среди этих субтипов существуют различные варианты, значительно различающиеся между собой.
Как выяснилось, в различных регионах земного шара геномы вируса имеют свои различия, что сказывается на результатах серологических исследований. Более того, имеются данные, что различные субтипы вирусов не дают перекрестного иммунитета. Антигенные варианты (квазивиды) различаются и по степени чувствительности к интерферону.
Эпидемиология. При ВГС соотношение клинически выраженных (желтушных) форм и безжелтушных составляет 1:4. Поэтому больные с безжелтушной и субклинической формами, а также вирусоноси-тели являются основной группой риска передачи инфекции, особенно если они становятся донорами. Так, по данным Мс Farlane (1993), в Северной Англии обследование доноров выявило носительство HCV у 0,18 % из них, тогда как в Саудовской Аравии — у 19,2 %. В других регионах инфицированность доноров составляет 2—5 %. Но эти данные еще нуждаются в уточнении, тем более, что еще не во всех странах ВГС подлежат обязательной регистрации.
Применительно к ВГС термин «носительство» звучит еще не достаточно четко и убедительно, поскольку у лиц с наличием анти-HCV и нормальной активностью цитолитических ферментов, отсутствием клинических проявлений нередко (почти у 1/3 из них) при исследовании биоптатов печени выявляют признаки хронического гепатита.
Основной путь передачи вируса парентеральный, главным образом при переливании инфицированной крови и ее компонентов. В 1989 г. было доказано, что большая часть ВГ, возникающих после переливания крови, вызвана HCV. Поэтому основная группа риска — реципиенты крови. Велика инфицированность среди лиц, подвергшихся гемодиализу хотя бы однократно (до 20%), больных гемофилией (более 70%). Больные гемофилией — особая группа риска, так как они регулярно получают факторы свертывания крови, которые изготовлены из сыворотки крови большого числа (2000 и более) доноров. Если среди этих доноров окажется хотя бы один больной ВГС или вирусоноситель, этого может оказаться достаточно, чтобы инфицировать всю партию препаратов. Велика (до 70%) инфицированность HCV среди наркоманов. Маркеры HCV у них при развитии ВГ обнаруживают значительно чаще, чем маркеры других ВГ. HCV часто находят у ВИЧ-инфицированных (у 16% и более умерших от СПИДа).
Возможен половой путь передачи инфекции, но он имеет меньшее значение, чем парентеральный.
Заболевание протекает в основном в виде спорадических случаев.
Отсутствие стойкого иммунитета после перенесенного заболевания, невысокая защитная роль циркулирующих антител, выявленные различия в структуре вируса в разных регионах не исключают возможности повторного заражения.
Патогенез — изучается. Предположительно он сходен с таковым при ВГВ, но имеет особенности: прежде всего вирус не способен встраиваться в геном инфицированной клетки.
Механизмы повреждения печени при ВГС еще недостаточно известны. Если на начальных этапах изучения этой патологии ведущим признавали непосредственное цитопатогенное действие вируса, то сейчас пришли к выводу, что роль его весьма скромна. Это подтверждается и фактами, свидетельствующими об отсутствии корреляции между выраженностью вирусемии и тяжестью повреждения гепатоцитов у больных ВГС.
Предполагают, что важную роль в развитии заболевания и затем хронизации играют аутоантитела к печеночному липопротеиду. Показано, что HCV ингибирует цитотоксический иммунный ответ. Отсутствует корреляция между выраженностью морфологических изменений и инфицированностью HCV гепатоцитов.
В экспериментах на шимпанзе показано, что серьезные изменения в печени появляются через 14 нед после заражения и даже позже, не всегда сопровождаясь выраженным цитолитическим процессом.
При ВГС отмечаются особые взаимоотношения между вирусом и антителами. Так, циркуляция вируса может сочетаться с наличием ан-ти-HCV и антител к различным пептидам HCV. Как полагают, особенностью ВГС является то, что противовирусные антитела не способны нейтрализовать вирус в отличие от других вирусных инфекций, при которых антитела способствуют элиминации вируса, освобождению организма от инфекции и защите его от повторного заражения. При ВГС эти механизмы не срабатывают. Связывают это с самыми различными причинами: множество существенно различающихся между собой в антигенном отношении субтипов, генетическая нестабильность с повышенной способностью к мутациям, многообразие антител, образующихся к различным фрагментам вируса и отличающихся при острой и хронической инфекции, и т.д. Все это способствует длительной пер-систенции вируса в организме и слабому иммунному ответу. Сроки появления антител варьируют в широких пределах (от 4 до 40 нед и более), таким образом, возможна даже длительная персистенция вируса без наличия антител.
Механизмы хронизации, персистенции вируса, роль аутоиммунных реакций в патогенезе уточняются, но имеющиеся данные уже сейчас свидетельствуют о том, что ВГС ассоциирован с иммунокомплексными и гематологическими заболеваниями (нейтропения, криоглобулине-мия, пернициозная анемия, лимфома).
При ВГС чаще, чем при ВГ другой этиологии, появляются криогло-булины (почти в 54 % случаев). Криоглобулины, вызывая васкулиты, способствуют усилению поражений печени, почек (гломерулонефрит), способствуют хронизации и малигнизации. Современный уровень диагностических возможностей по распознаванию ВГС еще далек от совершенства, и большое число ложноположительных и ложноотрица-тельных результатов, которые получают при определении маркеров ВГС у больного, требует очень осторожной интерпретации данных о патогенезе, клинических особенностях, исходах ВГС.
Клиника. При заражении HCV чаще возникают безжелтушная и стертая формы заболевания. Манифестная форма по клинике сходна с клиникой ВГВ, но заболевание обычно протекает легче, тем не менее, и при ВГС могут возникать фульминантные формы.
Острый ВГС — вариант течения гепатита, при котором клинические проявления не отражают остроту и характер процессов в печени, часто приводящих к хронизации.
Преджелтушный период в большинстве случаев настолько незаметен, что первыми признаками развивающегося заболевания больные считают изменившийся цвет мочи или желтушность склер, кожи. На фоне нарастающей желтухи состояние больных остается в большинстве случаев вполне удовлетворительным. Небольшая общая слабость, снижение работоспособности — основные жалобы больного.
При первичном обращении к врачу больного ВГС нередко трудно бывает провести дифференциальный диагноз между острым ВГС и обострением хронического. Пожалуй, только тщательно собранный анамнез в сочетании с такими признаками, как небольшая мягковатая печень, отсутствие увеличения селезенки, отсутствие внепеченочных знаков, незначительная интоксикация, позволят заподозрить острый процесс.
Чаще больные приходят к врачу в период обострений. Недоумение врача при таком первичном обращении вызывают несоответствие размеров и плотности печени (значительно увеличена, плотновата) и увеличенной селезенки давности процесса и тяжести состояния больного, незначительная интоксикация в сочетании с яркой желтухой. Не случайно ВГС получил название «ласковый убийца», так как хронизация, цирроз, гепатоцеллюлярная карцинома при ВГС возникают чаще, чем при других ВГ, а фульминантные и тяжелые формы развиваются реже. Чаще, чем при ВГ другой этиологии, обнаруживают и внепеченочные проявления — гломерулонефрит, артралгии, кожные высыпания, анемию, асцит, особенно при затяжном течении.
Уменьшение интенсивности желтухи или даже ее полное исчезновение далеко не всегда сопровождается нормализацией активности АлАТ, АсАТ, этот процесс может затягиваться на месяцы и даже годы. Периодическое обострение процесса в печени, сопровождающееся повышением активности этих ферментов, не всегда сопровождается и какими-либо неприятными субъективными ощущениями. Больные, как правило, не замечают процесса перехода острого ВГС в хронический, и часто бывает трудно установить длительность заболевания, особенно если острый ВГС протекал субклинически или в безжелтушной форме. В таких случаях ставить диагноз «хронический гепатит» очень сложно и ответственно, и, пожалуй, лишь пункционная биопсия печени может помочь определить степень активности процесса, провести дифференциальную диагностику между хроническим ВГС (портальный гепатит) и исходом его в цирроз (признаки перипортального гепатита). У 20—60% больных с хроническим ВГС формируется цирроз печени. Особенностью ВГС является очень медленное прогрессирование заболевания: в большинстве случаев хронический гепатит формируется спустя 8—10 лет после острой фазы, а цирроз печени и гепатоцеллюлярная карцинома и того позже — спустя 1,5 и 2—2,5 десятилетия соответственно. Однако на этот процесс могут существенное влияние оказывать доза и тип вируса, попавшего в организм, фоновая патология и т.д.
Выявлено неблагоприятное влияние алкоголя на течение и исход ВГС: у алкоголиков ВГС протекает более злокачественно, быстрее формируются ХГ и цирроз. У лиц, не злоупотребляющих алкоголем, хронический ВГС протекает менее бурно, иногда с минимальными симптомами, но, тем не менее, исход в цирроз не исключается и у них.
В последние годы клинику ВГС начали изучать как бы заново, поскольку, как выяснилось, больные хроническим алкогольным гепатитом очень часто дают ложноположительные серологические реакции с диагностикумами, применяющимися для распознавания ВГС, что привело к ряду ошибочных выводов.
Специфическая диагностика. Специфическую диагностику начали разрабатывать с 1989 г.
Уже через 10—12 дней после заражения в сыворотке крови и печени можно обнаружить РНК HCV. Позже (примерно через 1 мес) появляются и антитела к HCV.
Первый серологический тест был основан на определении с помощью ИФА циркулирующих антител к рекомбинантному пептиду (С 100-3). Однако, как показали дальнейшие исследования, этот тест дает большое количество ложноположительных результатов, особенно при различных гнойно-воспалительных заболеваниях, гипергаммагло-булинемии, аутоиммунных и алкогольных гепатитах, к тому же антитела появлялись лишь спустя 5—6 мес после заражения, а нередко и значительно позднее.
Позже был разработан новый тест — методом рекомбинантного им-муноблота определяли отдельные компоненты и короткие пептиды HCV, но этот метод имел те же недостатки, что и определение ан-ти-HCV с помощью РФА и РИА. Существующие стандартные методы диагностики способны обнаружить антигены HCV и антитела к ним лишь при достаточно высоких концентрациях их в крови. Кроме того, особенности формирования иммунного ответа при HCV-инфекции приводят к тому, что антитела выявляют не у всех больных.
В последнее время внимание исследователей привлекает ПЦР, обладающая очень высокой чувствительностью: она позволяет обнаруживать менее 100 вирусных РНК в 1 мл сыворотки крови. Метод особенно ценен в связи с тем, что вирусемия при ВГС обычно малоинтенсивна. Наличие вирусной РНК является доказательством активности процесса. Ее можно обнаружить у больных в самые ранние сроки, еще до повышения активности АлАТ. Однако и этот метод дает иногда ложно-положительные результаты. Кроме того, он доступен лишь крупным вирусологическим лабораториям. Тем не менее, пока это, пожалуй, наиболее признанный тест, используемый для выявления HCV как этиологического фактора ВГ и уточнения степени активности процесса, вызванного этим вирусом. Однако надежные методы, позволяющие проводить четкую дифференциальную диагностику между острым ВГС и обострением хронического ВГС, пока отсутствуют.
В настоящее время создаются и изучаются тесты нового поколения, основанные на определении антител к ядру, оболочке и различным фрагментам генома HCV.
Таким образом, несмотря на все свои недостатки, пока еще метод ИФА для выявления анти-HCV продолжают применять в клиниках для диагностики ВГС как основной. При хроническом ВГС анти-HCV обнаруживают не только в свободной форме, но и в составе ИК.
При использовании этого теста следует помнить о возможности как ложноположительных, так и ложноотрицательных результатов. Поэтому оценивать полученные данные следует очень осторожно, внимательно анализируя все факторы, которые могли бы оказать влияние на результат исследования. Иногда в дифференциальной диагностике с алкогольным гепатитом (а именно он чаще всего дает ложноположи-тельную реакцию) помогает определение соотношения активности АлАТ : АсАТ. При ВГ оно больше единицы, при алкогольных гепатитах активность АсАТ в 2 раза (и более) может превышать активность АлАТ.
В тех случаях, когда дифференциальная диагностика затруднительна, существенную помощь оказывает пункционная биопсия печени с последующим гистохимическим исследованием биоптатов. Этот метод иногда оказывается единственным, способным подтвердить наличие хронического гепатита или даже цирроза печени у больных, у которых отсутствуют анти-HCV, а активность цитолитических ферментов незначительно повышена или даже близка к норме.
Примерная формулировка диагноза. 1. Острый вирусный гепатит С (анти-HCV-f), безжелтушная форма, легкое течение.
2. Хронический вирусный гепатит С (анти-HCV +), период ремиссии.
Всегда следует помнить о возможности ложноположительных результатов, поэтому исследование на наличие анти-HCV необходимо проводить не менее 2—3 раз.
Профилактика. Большое значение в проведении общей профилактики имеет выявление больных ВГС, особенно среди доноров, наркоманов, изоляция и лечение их. Необходима тщательная проверка крови доноров с использованием тест-систем для выявления маркеров ВГС, определение у всех доноров активности ферментов цитолиза. Следует ограничить показания к переливанию крови и ее компонентов.
Специфическая профилактика не разработана. Изучают возможность создания и использования рекомбинантных вакцин.
вирусный гепатит е
Вирусный гепатит Е (англ. — hepatitis Е).
Это заболевание, которое до 1990 г., пока не был выделен возбудитель, фигурировало под названием «ВГ ни А, ни В с фекально-ораль-ным механизмом передачи». Впервые возбудитель был обнаружен в фекалиях больных желтухой лишь в конце 80-х годов, однако существование этого вируса было предсказано гораздо раньше и даже доказано в опытах по самозаражению (М.С.Балаян, 1983). Уже после того, как вирус был выделен и изучен, удалось доказать, что именно он был причиной крупной водной эпидемии ВГ в Индии (1955 г.) и многих вспышек в странах Азии и Африки.
Этиология. Возбудитель — HEV, это РНК-содержащий вирус, напоминающий вирус животных. Его место в классификации еще четко не определено. Полагали, что это Picomavirus, однако в последнее время получены данные, что по своим свойствам он ближе к Calicivirus, но, тем не менее, имеет и существенные отличия. Обнаруживает свойства, общие с альфавирусами.
Размеры вирусной частицы — 32—34 нм, она имеет сферическую форму, шипы и вдавления на своей поверхности. Не имеет липидной мембраны. Наряду с полноценными (инфекционными) вирусными частицами имеются дефектные, с неполным вирусным геномом.
Полный вирусный геном содержит 3 отдельных открытых фрагмента. Полагают, что основным иммунодоминантным антигеном HEV является ORF2 (Open reading frame 2), антитела к этому фрагменту способны инактивировать вирус. ORF2 считается наиболее перспективным «материалом» для создания специфической вакцины. В геномах вирусов, выделенных от больных в различных регионах земного шара, выявлены отличия в отдельных фрагментах, в результате чего, вероятно, заболевания, вызываемые ими, имеют некоторые клинические различия. Однако при заражении формируется перекрестный иммунитет за счет общности основных структур.
Особенности репликации вируса еще не изучены, но полагают, что имеются сходства с репликацией альфавирусов.
HEV не очень устойчив в окружающей среде, он чувствителен к перепаду температур. При температуре —70 °С он разрушается в течение 1 мес, плохо переносит чередование замораживания и оттаивания. Чувствителен к высокой концентрации соли, быстро разрушается в фекалиях под действием ферментов, хорошо сохраняется в пресной воде (этим объясняется то, что основной фактор передачи — вода).
Кроме человека, восприимчивы к инфекции, вызываемой HEV, некоторые приматы, поросята (у них возникает желтушная форма гепатита), они и служат экспериментальной моделью для изучения ВГЕ.
На клеточных культурах вирус не размножается.
Эпидемиология. Заболевание регистрируют в регионах с жарким климатом и низким уровнем санитарной культуры — это, прежде всего, страны Азии, Африки, Южной Америки, где на долю ВГЕ приходится около 50 % всех случаев острых ВГ. В наших климатических условиях ВГЕ регистрировали преимущественно в виде завозных спорадических случаев, однако в последние годы возникали вспышки заболеваний и в некоторых регионах Украины.
Источник инфекции — больной человек. В желчи и фекалиях больного вирус начинает обнаруживаться рано, еще в преджелтушный период, когда только начинает повышаться активность аминотрансфераз, однако концентрация его в фекалиях невелика из-за быстрого разрушения кишечными протеазами, поэтому непосредственный контакт с больным существенной эпидемиологической роли не играет. Так как вирусоносительства нет, с момента нормализации активности цитолитических ферментов человек может считаться незаразным.
Механизм передачи инфекции — фекально-оральный. Основной фактор передачи — вода, где HEV может сохраняться длительное время. Спорным остается вопрос о возможности вертикальной передачи инфекции. Кратковременная вирусемия, возникающая в начальный период и не всегда распознающаяся клинически, не исключает теоретически возможности трансфузионной передачи.
В эндемичных по ВГЕ регионах заболевание регистрируется как в виде эпидемий (преимущественно в сезон дождей), повторяющихся каждые 5 лет, так и в виде спорадических случаев. Водный фактор передачи объясняет взрывной характер эпидемий.
Восприимчивость к ВГЕ всеобщая, но чаще болеют люди в возрасте от 15 до 40 лет, то есть те, кто уже успевает в эндемичных по ВГЕ регионах переболеть ВГА. В некоторых географических зонах чаще болеют мужчины, чем женщины (3:1).
Формирование перекрестного иммунитета к различным штаммам вируса у человека, перенесшего острый ВГЕ, защищает его от повторного заражения в течение ближайших нескольких лет. Отсутствие длительного носительства, персистенции вируса создает, тем не менее, впоследствии возможность повторного заражения. В последние годы вероятность персистенции обсуждается.
Патогенез. Полагают, что патогенез ВГЕ сходен с таковым при ВГА. Гистологические находки также соответствуют в основном классическому острому ВГА. Однако холестазы и железистую трансформацию печеночных клеток выявляют чаще (у 30—50 % больных), холестатические изменения сохраняются в течение всей острой фазы. Дегенеративные изменения в гепатоцатах и фокальные некрозы встречаются реже. Но в отдельных случаях обнаруживают субмассивный или даже массивный некроз. Особенно тяжело ВГЕ протекает у беременных (преимущественно в III триместре), часто у них развивается ДВС-синдром, а летальность достигает 40—60 %. Причина этого пока неизвестна.
При инфицировании заболевание возникает не всегда. Полагают, что различные болезни (особенно кишечные инфекции) способствуют активации вируса. Вирусемия, возникающая при ВГЕ, не всегда проявляется клинически, нередко она проходит бессимптомно. Репликация вируса, проникшего в клетку, происходит в цитоплазме, следствием этого является гибель клетки (то есть вирус оказывает непосредственное цитопатогенное действие). Но повреждающее влияние на гепатоцит оказывают также Т-лимфоциты, циркулирующие ИК. Действием последних объясняют возможность возникновения гломерулонефрита при остром ВГЕ, но не исключают и возможности непосредственного действия HEV на почки.
Антитела появляются поздно, обычно после второго подъема активности аминотрансфераз (5—6-я неделя болезни), когда уже идут активные репаративные процессы в печени.
Вопросы формирования иммунитета, особенностей патогенеза и другие проблемы, касающиеся ВГЕ, только начинают, по существу, изучать.
Клиника ВГЕ очень сходна с клиникой ВГА, но имеется ряд существенных отличий:
инкубационный период несколько длинее, чем при ВГА, — 5—6 нед, но может варьировать от 2 до 8 нед;
у 70 % больных имеется выраженный болевой синдром, появляющийся еще в преджелтушный период (боль в правом подреберье и эпи-гастрии);
в преджелтушный период нередко бывает диарея, чаще возникают артралгии; лихорадка — признак непостоянный;
с момента появления желтухи общее состояние больного не улучшается, как при ВГА, а интоксикация сохраняется или даже нарастает;
характерно двухфазное повышение активности цитолитических ферментов: первая фаза — высокая активность АлАТ и АсаТ на 6—12-й день болезни с дальнейшим быстрым ее снижением, затем, через 1—2 нед, — очередное повышение активности ферментов (вторая фаза), иногда без клинических признаков обострения. Первую фазу повышения активности цитолитических ферментов связывают с непосредственным цитолитическим действием вируса на печень в результате размножения вируса в гепатоцитах, вторую — с токсическим действием на печень различных метаболитов;
тимоловая проба повышается нерезко или даже остается нормальной;
особенно тяжело ВГЕ протекает у беременных, сопровождаясь высокой летальностью.
Как и ВГА, ВГЕ не дает хронизации, реконвалесценция лишь у отдельных больных может затягиваться до б мес. Соотношение желтушных и безжелтушных форм во время эпидемических вспышек 1:5.
Как уже упоминалось, течение ВГЕ в различных регионах имеет свои клинические особенности. Так, например, сибирский вариант ВГЕ, в отличие от вышеописанного среднеазиатского, характеризуется тем, что:
— протекает легче, чем ВГА; даже у беременных редко приобретает тяжелое течение;
имеет длительность желтушного периода до 1 нед;
регистрируют его в основном у мужчин.
ВГЕ протекает преимущественно легко, но возможно тяжелое и даже фульминантное течение, особенно при наличии хронической патологии печени. В большинстве случаев желтуха кратковременна, длительность желтушного периода не превышает 1—2 нед, но бывают и холестатические варианты течения. У беременных женщин, находящихся в III триместре беременности, летальность достигает 30 %. Смерть может наступить на фоне ДВС-синдрома с энцефалопатией и ОПН.
Специфическая диагностика. Вирусные частицы можно обнаружить в фекалиях и в желчи больных в разгар болезни с помощью электронной микроскопии. Метод сложен, к тому же низкая концентрация вируса в кале затрудняет его выявление.
При ВГЕ вирус может обнаруживаться в крови, поэтому метод диагностики ВГЕ путем выявления вирусной РНК имеет особое значение. Наиболее надежна ПЦР. Кроме того, существуют тест-системы, позволяющие выявлять ORF3 HEV. Однако разная чувствительность применяющихся тест-систем затрудняет интерпретацию и сопоставление данных.
В полученном при пункционной биопсии печени материале можно обнаружить антиген HEV в цитоплазме гепатоцитов в течение всего периода болезни. В биоптатах выявляют инфильтрацию портальной зоны полиморфноядерными лейкоцитами, баллонную дистрофию гепатоцитов, канальцевый холестаз, псевдожелезистые образования.
Антитела против HEV появляются в острую фазу болезни уже на фоне желтухи, для их обнаружения чаще используют РФА. Анти-HEV IgM обнаруживают примерно у 70 % больных в сроки до 4 нед от начала желтухи, в период реконвалесценции выявляют только анти-HEV
IgG, сохраняющиеся у отдельных больных до 15 лет. Различные серологические варианты вируса дают перекрестный иммунитет. В настоящее время разрабатывают и апробируют новые, более чувствительные диагностикумы.
Примерная формулировка диагноза. Острый вирусный гепатит Е, желтушная форма, течение средней тяжести.
Диагноз ВГЕ достоверен, если обнаружены анти-HEV IgM или вирусная РНК (указывают в диагнозе). Но диагноз может быть поставлен и при их отсутствии, если имеется соответствующий эпидемиологический анамнез, клиника и отсутствуют анти-HAV IgM.
Профилактика. Общая профилактика предусматривает те же меры, что и при ВГА. Велика роль мероприятий, направленных на улучшение бытовых условий, повышение санитарной культуры населения, выявление и лечение больных, защиту источников водоснабжения от загрязнения.
Специфическая профилактика еще не разработана. Изучается эффективность рекомбинантной вакцины, которая особенно необходима для вакцинации женщин детородного возраста в эндемичных районах.
Еще сравнительно мало изучены «новые» вирусные гепатиты — ВГБ и BrG и их возбудители.
, , , СПЕЦИАЛЬНАЯ ЧАСТЬ ООО
вирусный гепатит f
Вирусный гепатит F (англ. — hepatitis F).
Новое заболевание, еще практически не изученное. Лишь в 1994 г. появилось сообщение французских исследователей о том, что ими обнаружены новые вирусы гепатита, передаваемого энтеральным путем. Новый вирус получил название HFV. HFV по своей структуре близок к аденовирусам. Имеет размеры 50—100 нм, содержит ДНК.
Механизм передачи — фекально-оральный (в эксперименте обезьян удавалось заразить фильтратами фекалий больного BTF). Факторы передачи — инфицированные пищевые продукты, поэтому заболевание может возникать в виде вспышек, но пока еще регистрируется в виде спорадических случаев.
Репликация вируса происходит в цитоплазме пораженного гепатоцита с последующим его разрушением. Однако до сих пор еще остается неясным, оказывает цитопатогенное действие на клетку сам вирус или он усиливает действие других вирусов. В пользу последней гипотезы свидетельствует тот факт, что HFV обнаруживают главным образом в сочетании с другими гепатотропными вирусами (так, его выявляют почти у 50 % больных ВГЕ). Так как HFV обнаруживают у больных как острыми, так и хроническими ВГ, остается неясным также, может ли сам HFV способствовать переходу острого ВГ в хронический. Клинические проявления BTF сходны с таковыми при ВГА.
Надежные методы специфической диагностики разрабатывают. Наиболее надежный из них — обнаружение в кале специфических вирусных частиц. Считалось, что таковым является протеин FV, но последующие исследования показали, что он неспецифичен и обнаруживается при многих заболеваниях печени, связь которых с HFV убедительно не доказана. FV-протеин с помощью РФА выявляют в фекалиях 30—70 % всех больных ВГ. Таким образом, диагностическая ценность метода, связь HFV с острым и хроническим патологическим процессом в печени, частота возникновения и особенности течения гепатитов-микст с участием HFV нуждаются еще в очень серьезном изучении.
С учетом вышеизложенного, в том случае, если у больного имеется явная клиника острого ВГ, доказана возможность передачи инфекции фекально-оральным путем, но отсутствуют маркеры HAV, HBV, HCV, HDV, HEV (исследования должны проводиться в динамике), допустима следующая формулировка диагноза: «острый вирусный гепатит ни А, ни Е с фекально-оральным механизмом передачи». Пока еще BTF как отдельная нозологическая форма признается не всеми.
Методы общей профилактики при BTF те же, что при ВГА.
вирусный гепатит g
Вирусный гепатит G (англ. — hepatitis G).
Тоже относится к числу новых, активно изучаемых заболеваний.
Впервые о «новом вирусе» — возбудителе парентерального гепатита человека — заговорили в середине 90-х годов, когда в крови больного гепатитом, хранившейся в банке крови почти 30 лет, был обнаружен прежде неизвестный науке вирус — GB-вирус. Название вирусу дано по инициалам больного, у которого он был обнаружен. Этот вирус вызывал желтуху при инокуляции его мармозетам. Дальнейшие исследования показали неоднородность этого вируса, сходные, но не абсолютно идентичные вирусы выделяли из крови больных сывороточным гепатитом, а вновь выделенный инфекционный агент получил общее название HGV/GBV-C. Наряду с этим встречается и название менее громоздкое — HGV, им мы и будем пользоваться при дальнейшем изложении материала.
Этиология. HGV относят к флавивирусам. Это РНК-содержащий вирус, в его структуре имеется около 3000 различных аминокислот.
Вирус неоднороден, уже сейчас выделено 5 генотипов HGV, имеется много различных штаммов.
HGV неустойчив в окружающей среде, моментально погибает при кипячении, через 20 с — при температуре +90 °С.
Сведений о географическом распространении HGV мало, но почти у 20 % африканцев в возрасте 16—20 лет в крови с помощью ПЦР удавалось обнаружить РНК HGV. Различные гепотипы HGV неравномерно распределены в разных регионах земного шара.
Механизм передачи — парентеральный. Особые группы риска — реципиенты крови и ее препаратов, больные отделений гемодиализа, реципиенты различных органов. В этой группе HGV обнаруживали чаще, чем других представителей гепатотропных вирусов. Существует вероятность вертикальной передачи инфекции. Не исключается половой путь передачи — почти у 30 % гомосексуалистов обнаружена РНК HGV. Обращает на себя внимание то, что HGV часто обнаруживают при других ВГ: у больных ВГА — до 15 %, ВГВ — до 20 %, HGV — наиболее частый спутник HCV, он обнаруживается у 20—90 % больных ВГС. Недостаточно изучены вопросы, касающиеся длительности и особенностей постинфекционного иммунитета при ВГС
Репликация вируса происходит в цитоплазме гепатоцита, возможность репликации HGV в других клетках не доказана. При BTG отсутствует корреляция между активностью АлАТ и концентрацией вируса в крови: активность АлАТ после кратковременного повышения быстро снижается, а концентрация HGV продолжает расти. HGV в крови выявляют и на фоне нормальной активности АлАТ. Вирус в крови обнаруживают обычно с 4-й до 40-й недели после начала клинических симптомов, иногда даже — годы, причем нередко вирусемия носит перемежающийся характер, это и определяет необходимость многократных исследований для обнаружения вируса.
HGV обнаруживают при ХГ, гепатоцеллюлярной карциноме, циррозе печени, но является он основной причиной этой патологии или только вирусом-спутником, пока неизвестно.
Полагают, что HGV особенно влияет на течение ВГС, выполняя функцию вируса-помощника. При этом репликация вирусов идет как бы независимо друг от друга, но при сочетании ВГС и ВГС чаще формируется ХГ и возникают фульминантные формы.
Освобождение организма от вируса наступает не всегда, причем у отдельных больных HGV может персистировать годы, но ХГ при этом не формируется, т.е. HGV значительно в меньшей степени, чем HBV, HCV, HDV, ответственен за хронизацию процесса.
Клинические проявления ВГС мало чем отличаются от других острых ВГ с парентеральным механизмом передачи, особенно они сходны с ВГС. Основные отличия скорее биохимические, чем клинические, отсутствует корреляция между концентрацией вируса и активностью АлАТ в крови, активность АсАТ обычно выше АлАТ(т.е. АлАТ/АсАТ <1), наблюдают две волны повышения активности АлАТ.
Протекает ВГС, если он не ассоциирован с другим ВГ, нередко в виде безжелтушных и легких форм, но может быть причиной развития фульминантных гепатитов. В том случае, если ВГС протекает в сочетании с другим ВГ (то есть как гепатит-микст), клиника гепатитов существенно не изменяется, т.е. отсутствует эффект суммации клинических признаков, хотя хронизация наступает чаще. Более того, HGV резистентен к интерферону, и существует даже мнение, что эта резистентность может служить одной из причин неэффективности интерферо-нотерапии при ВГС, протекающем в виде инфекции-микст.
Специфическая диагностика разрабатывается. В настоящее время наиболее приемлемо определение генома вируса и отдельных его фрагментов в сыворотке крови с помощью ПЦР. Специфические антитела появляются поздно. Так, антитела к одному из оболочечных белков HGV-анти Е2 появляются лишь тогда, когда из крови исчезает вирусная РНК, т.е. это — маркер выздоровления.
Поскольку диагностические тест-системы еще несовершенны и доступны далеко не всем клиническим лабораториям, в тех случаях, когда подозревается парентеральный механизм заражения и в сыворотке крови больного острым ВГ отсутствуют маркеры HAV, HBV, HCV,
HDV, HEV, правомочен диагноз «вирусный гепатит ни А, ни Е с парентеральным механизмом передачи».
Как полагают, этиология ВГ не исчерпывается названными в этой главе возбудителями. Вполне вероятно, что в группе гепатитов ни А, ни Е будут обнаружены и другие гепатотропные вирусы, как это произошло в свое время с ГНАНВ. Вероятность обнаружения новых вирусов тем более велика, что в группе больных ни А, ни Е гепатитами HGV обнаруживают лишь в 7,5 % случаев, несколько чаще — HFV. Таким образом, немало ВГ остаются этиологически нерасшифрованными.
По мере изучения ВГ, выявления новых гепатотропных вирусов все чаще приходится иметь дело с вирусными ассоциациями, особенностями течения ВГ и исходов, которые определяют эти ассоциации. Это требует очень серьезного подхода к изучению, интерпретации данных, лечению. Кроме того, пока еще врачами не учитываются генетические особенности человека, которые оказывают существенное влияние на течение и исход ВГ.
дифференциальная диагностика желтух
По механизму развития желтухи условно можно разделить на 3 группы:
надпеченочные; подпеченочные; печеночные.
Надпеченочная приобретенная (гемолитическая) желтуха обусловлена повышенным распадом эритроцитов. Причины ее могут быть самыми различными, основные из них такие:
переливание несовместимой крови;
действие паразитов на эритроциты (малярия);
токсическое действие на эритроциты алкоголя, некоторых медикаментов, химических веществ;
токсическое действие на эритроциты факторов патогенности микроорганизмов и метаболитов при тяжелых инфекциях (сепсис), токсикозе беременных и т.д.
Во всех этих случаях повреждаются и разрушаются эритроциты, находящиеся в кровяном русле. Однако эритроциты могут разрушаться и вне сосудистого русла при наличии обширных гематом, инфаркта легкого.
Основными общими признаками, позволяющими отличить надпече-ночную желтуху, являются:
— лимонно-желтый оттенок кожи;
анемия различной степени;
тахикардия (часто носит компенсаторный характер);
очень темный кал за счет избыточного поступления в кишечник связанного билирубина и как следствие — избытка стеркобилина;
светлая моча (так как непрямой билирубин не проникает через почечные канальцы);
отсутствие диспепсических явлений, тяжесть состояния и особенности клиники обусловлены степенью анемии и вызвавшей ее причиной;
может наблюдаться увеличение селезенки без увеличения печени.
Существенную помощь (иногда решающую) в распознавании надпе-ченочной (гемолитической) желтухи оказывают некоторые биохимические тесты:
уровень билирубина повышен умеренно, преимущественно за счет непрямого;
активность ферментов АлАТ и АсАТ остается нормальной или незначительно повышается;
— активность ЩФ нормальная.
Подпеченочная желтуха может быть обусловлена нарушением оттока желчи из печени в результате действия таких внепеченочных факторов, как:
— обтурация желчного протока камнем, опухолью, эхинококковым пузырем;
— абсцесс печени с локализацией его в области ворот печени;
тяжелое течение сепсиса, протекающего по типу септикопиемии с наличием множественных метастатических гнойных очагов в области ворот печени;
наличие опухоли, рубцующейся язвы в желудке и двенадцатиперстной кишке в месте выхода общего желчного протока;
поражение поджелудочной железы, особенно ее головки (острый панкреатит, опухоль);
увеличение регионарных лимфатических узлов, сдавливающих желчный проток, при различных гематологических заболеваниях и т.д.
Для всех этих состояний, как и для ВГ, характерны яркая желтуха, повышение уровня билирубина (преимущественно за счет прямого), темная моча, частично или полностью обесцвеченный кал. Каждое из перечисленных заболеваний имеет свои клинические особенности — от начала с острейшего приступа (при внезапной обтурации желчного протока) до очень незаметного.постепенного развития болезни (при гематологических заболеваниях, опухолях).
При проведении дифференциальной диагностики следует учитывать основное отличие: активность ферментов АлАТ и АсАТ остается нормальной или незначительно (в 2—3 раза) повышается при длительно существующей желтухе, тогда как при ВГ активность ферментов цитолиза уже в первые дни болезни может повышаться в десятки раз. Если при ВГ нарастание желтухи, как правило, сопровождается постепенным снижением активности этих ферментов, то при механической желтухе цитолитический компонент хотя и медленно, но нарастает на фоне прогрессирующей желтухи. При малейшем подозрении на наличие у больного механической желтухи необходимо определить уровень ЩФ в крови: при ВГ он нормальный или незначительно повышен, при механической желтухе — резко повышается.
Увеличение печени и селезенки для механической желтухи не характерно (исключение составляют гематологические и септические больные). При наличии опухоли в печени она может пальпироваться (в зависимости от локализации и размеров). Если обтурирован общий желчный проток, возможна пальпация резко увеличенного желчного пузыря. Но при обтурации печеночного протока желчный пузырь бывает спавшимся, как и при ВГ.
При постановке диагноза учитывают остроту возникновения процесса, характер изменения в крови (лейкоцитоз, эозинофилия), наличие и тип лихорадки, сроки ее появления. Существенную помощь в диагностике оказывает УЗИ, позволяющее в большинстве случаев определить локализацию и характер механического препятствия.
Печеночная желтуха. Существует группа негемолитических желтух, при которых в крови повышается уровень непрямого билирубина за счет врожденного дефицита фермента глюкуронилтрансферазы, в связи с чем нарушается превращение непрямого билирубина в прямой. К таким желтухам относятся:
синдром Криглера—Наджара, который проявляется с первых дней рождения (выраженная желтуха, поражение ЦНС). Наследуется по аутосомно-рецессивному признаку;
синдром Жильбера (наследуется по рецессивно-доминантному типу).
Существуют различия в клинике, сроках появления таких желтух, но главные отличительные признаки их такие:
преобладание непрямого билирубина;
нормальная активность АлАТ и АсАТ;
печень и селезенка не увеличены;
моча светлая;
анемия не характерна.
Значительно большие сложности возникают при дифференциальной диагностике ВГ с неинфекционными паренхиматозными желтухами, протекающими с явлениями цитолиза.
Общими признаками в этих случаях является желтуха с преобладанием прямого билирубина, появление в моче уробилина и желчных пигментов, в некоторых случаях возможно увеличение печени; активность аминотрансфераз повышается, хотя и не достигает обычно такого уровня, как при острых ВГ. Наиболее частыми причинами развития таких паренхиматозных неинфекционных желтух бывают различные токсические факторы, а патологический процесс, возникающий при этом, расценивают как токсический гепатит.
Медикаменты — одна из наиболее частых причин развития токсического поражения печени. Особой гепатотоксичностью отличаются аспирин, сульфаниламиды, туберкулостатики, некоторые анестетики и кардиоваскулярные средства. Токсичными для печени могут оказаться некоторые комбинации медикаментов. При этом может возникать умеренная желтуха, активность АлАТ превышает норму иногда более чем в 5 раз, и возможны даже фульминантные формы болезни.
В дифференциальной диагностике следует обращать внимание на анамнез (когда, чем, сколько времени лечился больной), динамику симптомов и лабораторных показателей после отмены препаратов (в большинстве случаев желтуха быстро идет на убыль). Селезенка у таких больных обычно не увеличивается.
Токсический гепатит может быть связан с бытовыми отравлениями (фосфором и др.). Помогает поставить диагноз в этих случаях тщательно собранный анамнез. Для токсического гепатита, возникшего при отравлении бледной поганкой, характерно быстрое, не позднее чем через 10—12 ч после употребления грибов, появление желтухи с быстро прогрессирующими признаками печеночной недостаточности (в течение 2—3 сут может наступить смерть). Селезенка не увеличена.
Особого внимания заслуживает поражение печени у беременных. В большинстве случаев желтуха, возникающая у них, расценивается как ВГ. Однако существуют и другие причины, не связанные с инфекцией. Чаще всего в этой группе патологических состояний встречаются холе-стаз беременных и острая жировая дистрофия печени (жировой гепа-тоз беременных).
Холестаз беременных возникает чаще в III, реже — во II триместре беременности. Основные клинические проявления — кожный зуд (иногда мучительный), желтуха, потемнение мочи. Могут появляться или усиливаться слабость, тошнота. Однако печень не увеличивается, активность цитолитических ферментов повышается незначительно. Все симптомы исчезают уже через несколько дней после родов. Врачи-акушеры должны особенно внимательно наблюдать за больными с таким патологическим процессом, поскольку часты преждевременные роды.
Острая жировая дистрофия печени может развиться у беременных в последнем триместре, чаще на фоне токсикоза беременных. Характерно бурное начало (по типу фульминантной формы гепатита) с быстрым развитием печеночно-почечной недостаточности. На этом фоне возможны массивные кровотечения. Печень не увеличена. Уровень билирубина высокий за счет прямого, но активность АлАТ и АсАТ повышается умеренно или бывает нормальной. Повышена в крови концентрация аммиака и мочевой кислоты. Уже в конце 1-й — начале 2-й недели у большинства больных наступает летальный исход.
При многих инфекционных заболеваниях может наблюдаться повышение активности АлАТ в 2—3 раза без желтухи, что связано с общетоксическими реакциями, характерными для большинства инфекционных болезней. Тем не менее, эти изменения могут быть приняты за субклиническую форму ВГ. К таким ошибкам могут привести тяжело протекающая пневмония, бруцеллез, туляремия, легионеллез и др. Такие заболевания, как сифилис, Ку-лихорадка, могут протекать даже с небольшой желтухой, но главный показатель цитолиза — активность АлАТ — не достигает высоких показателей (повышается максимум в 6—8 раз). Для установления правильного диагноза необходимо использовать специфические диагностические тесты, а главное — при обследовании больных обратить внимание на симптомы, не характерные для ВГ. Каждое из вышеперечисленных заболеваний имеет свою характерную клиническую симптоматику, для них желтуха, повышение активности АлАТ — непостоянный, неспецифический, часто случайный признак.
Выраженная желтуха возникает при лептоспирозе. Но для него характерны гепаторенальный синдром с преобладанием в первые дни поражения почек (вплоть до почечной недостаточности), развитие тяжелого геморрагического синдрома. Активность АлАТ и АсАТ начинает нарастать позже, с конца 1-й недели заболевания и прогрессирует в последующие дни. В крови — выраженный лейкоцитоз, значительно увеличенная СОЭ.
Особую группу составляют инфекционные заболевания, при которых гепатоциты, как и при ВГ, являются клетками-мишенями, хотя и не основными. Это заболевания, вызываемые вирусами Эпштейна—Варр, цитомегалии, простого герпеса, герпес-зостер, Коксаки В, аденовирусами, вирусами кори, краснухи, паротита, желтой лихорадки.
При всех этих заболеваниях возможны появление желтухи различной интенсивности (лишь при желтой лихорадке она является обязательным признаком), увеличение печени, а иногда и селезенки, уровень билирубина (за счет прямого) и активность АлАТ и АсАТ повышены. Каждое из этих заболеваний от ВГ отличает то, что:
признаки поражения печени возникают на фоне клинических проявлений, характерных для заболеваний, вызванных одним из названных вирусов, являясь, таким образом, не единственным и далеко не основным признаком болезни, а одним из многих ее проявлений;
увеличение активности АлАТ и АсАТ относительно невелико (лишь в 2—5 раз превышает норму; несколько выше она при цитомега-ловирусной инфекции);
— при желтой лихорадке активность АсАТ с первых дней выше таковой АлАТ.
В сложных случаях вопрос решается окончательно с помощью специфических методов диагностики (выделение возбудителей и их компонентов, выявление специфических антител).
Особую сложность представляет дифференциальная диагностика острых ВГ между собой, тем более что в последние годы участились случаи, когда приходится иметь дело с гепатитами-микст. Общими признаками всех острых ВГ являются следующие:
наличие различной степени выраженности интоксикационного синдрома (слабость, повышенная утомляемость, снижение работоспособности, иногда головокружение, головная боль);
диспепсические явления (отсутствие аппетита, тошнота; при тяжелом течении — отвращение к пище, рвота; чувство тяжести в правом подреберье);
желтушность кожи и склер (при желтушной форме) с красноватым оттенком желтухи;
увеличение печени и селезенки;
темная моча (при исследовании выявляют желчные пигменты);
— светлый или полностью обесцвеченный в разгар болезни кал из-за отсутствия стеркобилина;
относительная брадикардия;
АД может быть несколько сниженным или нормальным;
— уровень билирубина (при желтушной форме) повышается преимущественно за счет прямого;
— активность ферментов цитолиза резко повышена (иногда в 30—50 раз); активность АлАТ значительно выше, чем АсАТ;
активность ЩФ нормальная или (редко) незначительно повышена;
в общем анализе крови — лейкопения, относительный лимфоцитоз, нормальная или замедленная СОЭ.
Но нередко вопрос решается только после изучения в динамике маркеров ВГ. Тем не менее, существуют эпидемиологические и клинические данные, позволяющие с определенной степенью достоверности диагностировать острый ВГ с учетом его этиологии. Такие особенности каждого гепатита следует всегда учитывать при обосновании диагноза.
Особенности ВГА следующие:
сезонность (лето-осень); возможность групповых вспышек;
молодой возраст больных (преимущественно);
острое начало (чаще всего по псевдогриппозному или смешанному типу);
кратковременная лихорадка (1—3 дня) в преджелтушный период;
улучшение самочувствия больных с момента появления желтухи;
у большинства больных — легкое течение заболевания;
отсутствие хронизации;
повышенная тимоловая проба;
наличие в крови анти-HAV IgM. Особенности ВГВ:
обычно имеется указание на различные парентеральные манипуляции за 3—6 мес до развития первых симптомов заболевания (но у 30 % больных такую четкую связь установить не удается);
чаще возникает у пожилых людей (т.е. часто получающих парентеральное лечение), наркоманов, гомосексуалистов;
заболевание обычно возникает в виде спорадических случаев;
начало постепенное;
преджелтушный период чаще протекает по типу артралгического, диспепсического, смешанного (лихорадка не характерна);
в преджелтушный период возможны различные аллергические проявления;
— с момента появления желтухи состояние не улучшается;
— признаки интоксикации обычно сохраняются или даже нарастают до мочевого криза;
возможны затяжное течение, переход в хроническую форму;
бывают не только обострения, но и рецидивы;
— течение заболевания чаще среднетяжелое, но возможны субклинические и фульминантные формы;
— тимоловая проба нормальная;
— доказательством активной репликации вируса является наличие анти-НВс IgM и НВеАд.
Особенности BrD следующие:
— парентеральный механизм заражения (как и при ВГВ);
группа риска — люди, имеющие в крови HBsAg (вирусоносители, больные);
лихорадка в преджелтушный период (у 60% больных), продолжающаяся у части больных даже в желтушный период;
— часто появляется боль в правом подреберье;
нередко возникает вторая волна желтухи, иногда вообще заболевание принимает волнообразное течение с клиническими и (или) ферментативными обострениями;
в крови кроме HBsAg обнаруживают анти-HDV IgM (при отсутствии HBsAg могут выявляться другие маркеры ВГВ);
назначение глюкокортикостероидов отягощает течение заболевания.
Особенности ВГС:
— основная группа риска — больные, которым переливали кровь или ее компоненты (особенно повторно!);
начало заболевания постепенное, часто без выраженного продрома;
течение преимущественно легкое;
степень выраженности желтухи, интоксикационного синдрома, увеличения и плотности печени часто не коррелируют;
хронизация процесса у большинства больных;
заболевание протекает с периодическими ферментативными обострениями;
диагноз подтверждает наличие в сыворотке крови анти-HCV или обнаружение вируса в ПЦР.
Особенности ВГЕ:
заболевание распространено преимущественно в Азии, Африке, Южной Америке. Поэтому особое внимание уделять туристам, приехавшим из этих регионов;
взрывной характер эпидемий, связанный с загрязненными источниками водоснабжения;
возраст больных от 15 до 18 и от 28 до 40 лет (категория риска по возрасту);
начало острое, как при ВГА;
с момента появления желтухи отсутствует улучшение самочувствия больного (отличие от ВГА);
у большинства больных возникает выраженный болевой синдром еще в преджелтушный период (боль в эпигастрии);
двухфазное повышение активности ферментов;
нормальная или незначительно повышенная тимоловая проба;
тяжелое течение у беременных с высокой летальностью;
появление вируса в фекалиях (выявляют при использовании специальных методов);
введение глюкокортикостероидов отягощает течение болезни;
в крови в острую фазу можно обнаружить анти-HEV IgM.
При проведении клинической дифференциальной диагностики следует учитывать не один симптом, а комплекс наиболее характерных признаков.
Изменения биохимических показателей, их динамика помогают в распознавании острых ВГ, оценке их тяжести, но вряд ли всегда могут помочь в дифференциальной диагностике острых ВГ различной этиологии. Решающее слово — за маркерами ВГ.
лечение больных вирусными гепатитами
Общие принципы. Госпитализации подлежат все больные ВГ, независимо от тяжести течения их, в целях предупреждения дальнейшего распространения инфекции. Сложность этиологической расшифровки ВГ только на основании клиники в амбулаторных условиях, непредсказуемость течения, возникающие часто трудности при дифференциации ВГ с желтухами другой этиологии, отсутствие опыта у участковых врачей в лечении больных ВГ увеличивают риск неблагоприятных ис-
ходов и являются достаточным основанием для направления в стационар всех больных ВГ. В большинстве стран Европы и Америки больных ВГА не госпитализируют, лечение проводят амбулаторно, учитывая то, что к моменту появления желтухи больные уже практически незаразны для окружающих, а протекает ВГА в подавляющем большинстве случаев сравнительно легко. Для введения такого правила госпитализации необходимы соответствующий социально-экономический уровень, уровень санитарной культуры населения и подготовки специалистов (участковых врачей).
В стационаре желательно обеспечить раздельное размещение больных ВГ различной этиологии, учитывая возможность суперинфицирования.
При лечении больных следует руководствоваться следующими принципами:
при назначении лечебных средств необходимо строго учитывать период болезни и характер сопутствующих заболеваний (возможно взаимное неблагоприятное влияние ВГ и фоновых заболеваний);
количество назначаемых лекарственных препаратов должно быть минимальным из-за возможного нарушения их метаболизма при ВГ и токсического действия на пораженную печень. Назначают лишь жизненно необходимые препараты. Полностью исключают гепатотоксич-ные средства. Полипрагмазия при ВГ увеличивает вероятность токсических и аллергических осложнений, неблагоприятных исходов;
лечение сопутствующих заболеваний, особенно хронических, в период разгара острого ВГ следует проводить лишь при наличии их обострений или невозможности прервать ранее начатый курс лечения;
соблюдать незыблемый принцип индивидуального подхода к выбору лекарственных средств;
обязательно учитывать этиологию ВГ, так как существуют различия во взаимодействии гепатотропных вирусов с различными лекарственными препаратами.
Режим и диета. Больные должны соблюдать постельный режим при любой тяжести течения болезни вплоть до мочевого криза. При тяжелом течении ВГ назначают строгий постельный режим. Расширение режима начинают с наступления мочевого криза —полупостельный, палатный, свободный в пределах стационара. Если имеются для этого условия, отдельным категориям больных (с холестатической формой, затянувшейся реконвалесценцией) разрешают строго индивидуально более свободный режим: кратковременные прогулки (по 30—60 мин) в пределах территории стационара.
Больному, находящемуся на лечении, необходимо обеспечить не только физический, но и психический покой в течение всего периода пребывания в стационаре.
Больной должен соблюдать диету ( № 5а, 5) в зависимости от периода болезни и тяжести ее течения. Но в последнее время появилось немало сторонников того, что при ВГ нет необходимости в жестком соблюдении диеты, поскольку печень не является строго диетозави-симым органом. Значительно в большей степени соблюдать диету заставляет нарушение функции других органов и систем, развивающееся у больных ВГ, наличие у больных хронической патологии. Диета должна учитывать характер сопутствующих заболеваний (особенно при наличии сахарного диабета, панкреатита, язвенной болезни, почечной недостаточности, холецистита). В любом случае необходимо обеспечить больному не менее 2000 ккал/сут, или 8374 кДж/сут, так как иначе начинается распад эндогенных белков и усиливается интоксикация. Обеспечивается такое количество калорий за счет белков (1,5—2 г/кг массы тела в сутки), жиров (0,8—1,8 г/кг массы тела в сутки), углеводов (4—5 г/кг массы тела в сутки). Половина получаемых с пищей белков должна быть растительного происхождения. Необходимое количество витаминов обеспечивается свежими фруктами, соками и овощами.
Лишь при тяжелом течении ВГ, сопровождающемся неукротимой рвотой, и при развитии у больного ОПЭ II—III степени можно на короткое время (2—5 дней) отказаться от естественного питания, а необходимую энергетическую потребность обеспечить внутривенным введением аминокислотных смесей, растворов глюкозы, фруктозы.
Больной должен получать жидкость в количестве до 40—50 мл/кг массы тела в сутки с обязательным контролем водного баланса, особенно при тяжелом течении и отечно-асцитической форме. В двух последних случаях необходимо временно из рациона исключить соль, обеспечить контроль уровня электролитов в сыворотке крови.
В период реконвалесценции, когда явления интоксикации стихают, у больных обычно усиливается аппетит. В это время необходимо удерживать больных от избыточного приема пищи, энергетическая ценность которой не должна превышать 3000 ккал/сут, или 12560 кДж/сут, так как функциональные возможности органов дигестивной системы еще значительно снижены. Показателями этого являются возникающие после еды тяжесть в надчревной области, вздутие живота, отрыжка, слабость. При грубом нарушении диеты затягивается реконвалес-ценция и даже может наступить обострение ВГ. Препараты, содержащие пищеварительные ферменты (фестал, панкреатин, мезим-форте и др.), в этих ситуациях не решают проблемы, более того, вводимые ферментные препараты могут тормозить синтез собственных.
В период реконвалесценции показано частое (5—6 раз в течение дня, строго в одно и то же время) питание, что оказывает положительное рефлекторное влияние на отток желчи. Недопустимо при не полностью восстановившемся процессе желчеотделения, остаточной непрямой би-лирубинемии (формировании постгепатитной формы синдрома Жильбера), сопутствующем панкреатите, язвенной болезни увлечение продуктами, обладающими выраженным желчегонным свойством (растительные масла, отвар шиповника, яйца с желтком, минеральные воды).
Расширение режима питания после выписки из стационара будет определять в значительной мере сам больной своей индивидуальной реакцией на пищевые нагрузки. При этом необходимо помнить, что одинаково опасны как преждевременный отказ от соблюдения диеты, так и необоснованно длительное ее соблюдение, ограничивающее поступление в организм ценных питательных веществ и создающее значительный психологический дискомфорт. В ряде случаев необходимость соблюдения диеты может быть связана не с сохраняющимся патологическим процессом в печени, а с состоянием других органов — поджелудочной железы, реже — желудка и двенадцатиперстной кишки.
Медикаментозная терапия острых ВГ — сложная проблема. Дело в том, что большинство больных острым ВГ независимо от их этиологии (все больные ВГ с легким течением и большая часть — течением средней тяжести) практически не нуждаются в медикаментозном лечении, но преодолеть сложившийся стереотип — «чем больше назначают лекарств, тем, следовательно, лучше лечат» — бывает очень сложно. Здесь очень многое зависит от умения врача найти общий язык с больным, убедить его строго следовать всем врачебным рекомендациям.
Всегда следует помнить, что метаболизм большинства лекарств происходит в печени, которую следует максимально щадить при развитии в ней патологического процесса.
Надежных этиотропных средств для лечения больных ВГ пока не найдено. Натуральный человеческий а-интерферон применяют главным образом при тяжелом течении ВГ. Вводят его внутримышечно, суточная доза составляет до 4 ООО ООО ЕД, курс лечения 5—7 дней. Однако в отношении целесообразности назначения и эффективности а-интер-ферона при ОВГ мнения неоднозначны, особенно при лечении больных с гепатитами-микст. Применение рекомбинантного а-интерферо-на оказалось неэффективным, к нему быстро появляются антитела с формированием в дальнейшем резистентности к препарату. К натуральному а-интерферону, независимо от дозы препарата и длительности курса лечения, антитела не образуются. Но в последние годы установлено, что взаимоотношения вирусов при острых ВГ различной этиологии с интерфероном достаточно сложны. Так, он оказывает благоприятное действие при ВГА, если назначается рано, слабо действует на HCV, при ВГВ и ВГС у большинства больных лишь временно снижается концентрация вируса в крови, а затем (особенно при длительном применении) снова возрастает, иногда значительно. Кроме того, сам интерферон может вызывать достаточно тяжелые побочные реакции.
В качестве противовирусных препаратов при остром ВГ предлагались видарабин, ацикловир, гелданамицин, олигонуклеотиды, ламиви
ридин и др. Но в последние годы их применяют все с большей осторожностью. Связано это с различными факторами: вирусы различаются по своей чувствительности и резистентности к противовирусным препаратам, на фоне их приема вирусы могут исчезать из крови, но вскоре после их отмены снова появляться, многие препараты оказывают токсическое действие на печень и другие органы, а на вирусы (особенно на HCV и HBV) — мутагенное. Более того, действие ряда противовирусных препаратов проявляется при проникновении их в пораженную вирусом клетку-мишень, где они подавляют синтез вирусной РНК или ДНК. Но при этом возникает и угроза действия на ДНК человека, в связи с чем возможны мутации, создается опасность возникновения опухолей. В настоящее время от назначения противовирусных препаратов при ОВГ различной этиологии и тяжести течения практически отказались.
Поэтому в лечении больных острым ВГ наиболее важная роль принадлежит рациональной грамотной патогенетической терапии.
Лечение больных острым ВГ с циклическим течением. При легком течении ВГ, особенно ВГА, лечение можно ограничить диетой, обеспечением больному физического и психического покоя. Допустимо назначение десенсибилизирующих средств с учетом предрасположенности к аллергическим реакциям, особенно при ВГВ и ВГС. С этой целью обычно применяют тавегил (или диазолин) в общепринятых терапевтических дозах в течение 7—10 дней. Димедрол назначать не следует с учетом весьма нежелательного для больных ВГ его седативного и гепатотоксического действия. Можно назначать аскорбиновую кислоту, аскорутин или галаскорбин. Один из этих препаратов после еды больные принимают в течение 5—7 дней.
Выраженная лейкопения может быть основанием для назначения метилурацила по 0,5 г 4 раза в сутки в течение 5—7 дней.
Даже при легком течении ВГ очень важно следить за функцией кишечника, поскольку даже кратковременная задержка стула приводит к усилению интоксикации вследствие увеличения поступления токсических веществ из кишечника по системе портальной вены. Но в острый период болезни не следует назначать слабительные средства, хороший эффект может быть достигнут при помощи содовых очистительных клизм или даже микроклизм и индивидуальном подборе диеты. В разгар желтухи противопоказаны любые желчегонные средства, как холе-ретики, так и холекинетики, так как они могут усилить желтуху, болевой синдром и интоксикацию.
В этот период для купирования болевого синдрома, обусловленного чаще поражением желчевыводящих путей, поджелудочной железы или пищеварительного тракта, не следует назначать тепловые процедуры (грелку) на живот, противопоказаны физиотерапевтические методы лечения (электро- и ионофорез различных препаратов, поле УВЧ, озо
керит, диатермия, микроволновая терапия) из-за возможности усиления отека не только печени, но и поджелудочной железы. Нужно выяснить причину появления боли, а затем уже назначать при необходимости соответствующее лечение.
Все вышеперечисленные подходы к лечению справедливы в период разгара болезни и при средней тяжести ВГ. Однако у этих больных уже необходимо контролировать уровень электролитов в крови и КОС, так как у них нередко выявляется компенсированный ацидоз с тенденцией к гипокалиемии. У лиц пожилого возраста этому периоду чаще сопутствует метаболический алкалоз. Поэтому характер дезинтоксика-ционной терапии определяют степенью и видом метаболических нарушений. При компенсированном ацидозе у большинства больных достаточно отрегулировать диету, обогатив ее калием, назначить микроклизмы с 2—3 % раствором натрия гидрокарбоната; это приведет к уменьшению содержания аммиака в кишечнике и, как следствие, к уменьшению ацидоза. Если ацидоз не удается ликвидировать с помощью таких методов, то приходится прибегать к введению 2—4 % раствора гидрокарбоната натрия (доза, длительность лечения зависят от степени ацидоза).
Следует помнить, что наряду с имеющимся у лиц пожилого возраста в периферической крови алкалозом, в печени определяют выраженный тканевый ацидоз. Поэтому коррекцию проводят комбинированную: ректально капельно (после тщательной очистительной клизмы) вводят 2—4 % раствор гидрокарбоната натрия (150—200 мл 1 раз в сутки) и внутривенно — глюкозо-калиево-инсулиновую смесь (50—70 мл 3 % раствора хлорида калия на 300—500 мл 5 % раствора глюкозы с инсулином). Но даже при среднетяжелом течении ВГ, если нет рвоты, дезинтоксикацию следует осуществлять преимущественно перорально. Таким больным достаточно назначить обильное питье, включая компоты из сухофруктов (одновременно устраняется и дефицит калия). Однако следует соблюдать осторожность при нарушении функции почек (может возникнуть гиперкалиемия).
Многие годы с целью дезинтоксикации больным ВГ широко назначали гемодез. Препарат вводили многократно, не учитывая множества побочных свойств, которыми он обладает: способность накапливаться в клетках моноцитарно-макрофагальной системы, вызывать аллергические реакции, ожог почечных канальцев, адсорбировать на себе другие, необходимые больному, лекарственные препараты и т.д. Все это обусловливает необходимость полностью отказаться от гемодеза при лечении больных острым ВГ, независимо от тяжести течения заболевания.
Для парентеральной дезинтоксикации в первые 2 нед болезни можно назначать 5 % раствор глюкозы (с 3—4-й недели глюкозу ограничивают, учитывая возможность истощения к этому времени инсулярного аппарата поджелудочной железы), солевые растворы («Ацесоль», «Три-соль»), особенно при наличии рвоты.
Хороший дезинтоксикационный эффект может быть достигнут с помощью энтеросорбентов. Среди множества препаратов этой группы заслуживает внимания энтеросгель. Препарат эффективен также при наличии холестатического компонента, аллергии, сопутствующем панкреатите. Преимуществами энтеросгеля перед известными угольными энтеросорбентами (СКН-2Н, СУГС и др.) являются хорошая переносимость препарата, отсутствие диспепсических явлений при его приеме и «феномена обратной отдачи». Курс лечения обычно длится 5—7 дней, при необходимости его повторяют.
Возникающие у части больных ВГ умеренные нарушения микроциркуляции и кровотока в печени можно уменьшить назначением трента-ла (по 200 мг 3 раза в сутки после еды), особенно в сочетании с троксе-вазином (600 мг/кг в сутки). Длительность применения препаратов — не более 7—10 дней.
Последовательность введения перечисленных препаратов, возможность и целесообразность их сочетания, дозы должны быть строго индивидуализированы в зависимости от конкретных показателей, характеризующих течение заболевания у каждого больного.
Лечение больных острым ВГ с тяжелым течением должно проводиться в условиях реанимационного отделения или в палате интенсивной терапии, где есть возможность более тщательного наблюдения и ухода.
Следует обеспечить постоянный доступ к венам (венесекция), при необходимости ввести назогастральный зонд, произвести катетеризацию мочевого пузыря. Недопустимы обременительные для больного диагностические процедуры, особенно связанные с его транспортировкой, что может послужить «последней каплей», приводящей к бурному прогрессированию печеночной недостаточности. Из-за анорексии, частой рвоты, тяжести состояния, угрозы развития желудочно-кишечного кровотечения возникает необходимость внутривенного введения препаратов в целях коррекции имеющихся нарушений и обеспечения парентерального питания. Лечение осуществляют под строгим контролем водно-электролитного баланса, диуреза, КОС.
В целях дезинтоксикации, а также для улучшения реологических свойств крови, капиллярного кровотока, гемодинамики назначают рео-полиглюкин в количестве 200—400 мл в сутки (3—5 процедур), хотя целесообразность этого признается не всеми. Полиглюкин вообще противопоказан при заболеваниях печени.
У больных ВГ с тяжелым течением чаще бывает алкалоз, чем ацидоз. Коррекцию нарушений при этом осуществляют аналогично таковой при среднетяжелом течении ВГ. Учитывая то, что тяжелое течение ВГ часто сопровождается рвотой с потерей жидкости и электролитов, обосновано назначение растворов типа «Ацесоль», «Квартасоль», «Лакта-соль».
Показано введение слабощелочных растворов в желудок, особенно при сопутствующих гастродуодените, язвенной болезни, так как высокая рН желудочного содержимого усиливает вероятность кровотечения. При повторной рвоте обязательно промывание желудка щелочными растворами через назогастральный зонд. Процедура противопоказана при наличии язвенной болезни и возникновении или даже угрозе кровотечения.
Тяжелое течение ВГ сопровождается нарушением синтеза альбуминов, что вызывает и усиливает различные патологические реакции: возникают изменения реологических свойств крови, уменьшается усвоение витаминов, возрастают интоксикация, протеолитическая активность крови и т.д. Поэтому больным с гипоальбуминемией можно по экстренным показаниям (!) в особых случаях вводить сывороточный альбумин (5—10 % по 100—150 мл в сутки) или нативную плазму крови в той же дозе (но помнить о возможности суперинфицирования HCV, HDV, HGV, HIV).
При выраженной задержке жидкости в организме (отечно-асцити-ческая форма ВГ), угрозе оте?;а-набухания головного мозга необходимо назначать мочегонные препараты. Предпочтительнее внутривенно вводить 40—60 мг лазикса (фуросемида) в конце инфузионной терапии (в шприце). Применение других салуретиков (гипотиазида, триампура) категорически противопоказано из-за их гепатотоксичности. К введению лазикса не следует прибегать при выраженных гипокалиемии и метаболическом алкалозе. Форсированный диурез опасен из-за возможности усиления дисбаланса электролитов.
Уменьшение кишечной аутоинтоксикации достигается исключением приема белков per os, систематическим промыванием желудка и кишечника, приемом энтеросорбентов. Вряд ли оправдано профилактическое назначение антибиотиков для воздействия на кишечную микрофлору: они могут усилить дисбактериоз.
Даже при тяжелом течении ВГ можно отказаться от применения глюкокортикостероидов, не говоря уже о среднетяжелом течении. За кратковременный положительный эффект, возникающий в результате их назначения, приходится нередко тяжело расплачиваться: усугубляются иммунодепрессия, геморрагический синдром, гипокалиемия, гипергликемия, создаются условия для активации вторичной инфекции, увеличивается вероятность формирования хронического гепатита. Лишь при отсутствии эффекта от применения всех вышеперечисленных лечебных средств, прогрессировании тяжести, угрозе развития острой печеночной недостаточности и отека-набухания головного мозга, при выраженных аллергических реакциях как «средство отчаяния» может быть назначен преднизолон или дексаметазон парантерально коротким курсом — 3—5 дней. При BTD применение глюкокортико-стероидов противопоказано из-за возможности быстрого прогрессиро-вания патологического процесса и перехода тяжелого течения гепатита в фульминантную форму.
Больным ВГ очень часто лечащие врачи назначают витамины, особенно группы В. Но сейчас уже установлено, что при остром ВГ избыток витаминов скорее вреден, чем полезен, так как способствует усилению токсических и аллергических реакций, к тому же в подавляющем большинстве случаев гиповитаминоз при остром ВГ не успевает развиться. При развитии ДВС-синдрома иногда возникает необходимость в назначении витамина К, но лишь коротким (не более 5—7 дней) курсом, так как длительное применение его способствует возникновению холестаза.
Отказались сейчас и от гипербарической оксигенации при тяжелом течении острого ВГ, так как установлено, что избыток кислорода может быть более вреден при начинающемся отеке мозга, чем полезен. Не оправдало себя назначение при остром ВГ гепатопротекторов, им-муномодуляторов.
Больные с фульминантными формами ВГ подлежат лечению в условиях реанимационного отделения. Крайне важно своевременное распознавание острой печеночной недостаточности, так как утраченное время может стоить жизни больному.
При фульминантных формах исключительно важное значение приобретает строго индивидуальный выбор лечебной тактики.
Врачу постоянно приходится контролировать и оценивать степень развивающихся у больного гипогликемии, гипоксии, геморрагического синдрома, интоксикации, нарушений КОС. Фульминантные формы ВГ часто сопровождаются отеком мозга, почечной недостаточностью, сердечно-сосудистыми нарушениями, отеком легких. Степень возникших нарушений, их сочетание, сроки появления — все учитывается врачом при выборе лечебной тактики. Контроль за многочисленными функциями организма осуществляют круглосуточно, постоянно внося коррективы. При необходимости (и возможности) применяют плазмаферез (1—3 сеанса), может возникнуть потребность в гипербарической оксигенации.
В период реконвалесценции осуществляют поэтапное расширение режима и диеты, постепенно отменяют все препараты, которые были назначены ранее. При необходимости проводят лечение сопутствующих заболеваний пищеварительного тракта и других органов и систем, которые могут оказывать неблагоприятное действие — приводить к обострениям, рецидивам, затяжному течению ВГ. Особенно часто причиной этого могут быть сопутствующие язвенная болезнь, гастродуоде-нит, поражения поджелудочной железы, желчевыделительной системы. Однако и в этот период при лечении указанных заболеваний сохраняется принцип максимального медикаментозного щажения печени. При боли и тяжести в надчревной области можно назначать спазмолитики (но-шпа). Но при наличии признаков гипотонии желчного пузыря они противопоказаны, так как могут привести к усугублению гипотонии.
В период стойкой реконвалесценции больные уже могут принимать минеральные воды в теплом виде, без газа, мягкие желчегонные препараты, слабый отвар желчегонных трав. Подбирать состав желчегонных трав следует строго индивидуально, с учетом механизма действия трав и состояния гепатопанкреатодуоденальной системы. Каждый сбор можно применять не более 10 дней. Как и другие желчегонные, эти сборы противопоказаны при желчнокаменной болезни, обострении панкреатита, язвенной болезни. Не следует назначать желчегонные средства при сохраняющейся гипербилирубинемии, следует также дождаться нормализации активности АлАТ, АсАТ. От слепых зондирований лучше отказаться из-за вероятности усиления отека печени.
Лечение больных острым ВГ, протекающим с холестазом. При внепеченочном холестазе лечение проводят в каждом случае с учетом конкретной причины. Поэтому всем больным с признаками холестаза должны быть проведены УЗИ, фиброгастродуоденоскопия, при возможности — компьютерная томография (КТ), при необходимости — рентгеноскопия желудка и кишечника. При ВГ любой тяжести не следует прибегать к ретроградной холецистопанкреатографии, поскольку эта диагностическая процедура в большинстве случаев сопровождается обострением процесса в печени и поджелудочной железе. Хирургическое лечение внепеченочного холестаза, возникающего на фоне ВГ, должно проводиться лишь при наличии абсолютных показаний (опухоль, стойкое нарушение оттока желчи вследствие обтурации камнем, стеноз и т.д.).
При лечении внутрипеченочного холестаза главное — режим, покой, полноценное питание с ограничением сладких блюд (они стимулируют выделение желчи, раздражают инсулярный аппарат) и других продуктов, стимулирующих желчевыделение. Не следует назначать желчегонные средства и слепые зондирования в период стойкого холестаза, поскольку они могут лишь усилить боль в панкреатодуоденаль-ной зоне, кожный зуд и, следовательно, бессонницу, дискомфорт и тревогу больного.
Очень важна нормализация сна. С этой целью можно назначать экстракт корня валерианы, небольшие дозы (не более 0,01 г на ночь) фенобарбитала. Применение гепатотоксичных снотворных противопоказано. Можно назначить спазмолитики (но-шпа) при отсутствии выраженной гипотонии желчного пузыря и желчных путей. Для уменьшения зуда, желтухи можно назначать курсами (по 7—10 дней) энтеро-сорбенты с перерывами между ними по 2—5 дней для оценки эффективности предыдущего курса. Контролем эффективности лечения может служить содержание в крови желчной кислоты холинглицина.
Не показаны не только при лечении холестатической, но и других форм ВГ Лив-52, липокаин, метионин, зиксорин (последний снят с производства из-за токсичности). Противопоказаны при холестазе глюкокортикостероиды, усугубляющие холестаз и затягивающие реконвалес-ценцию. При длительном упорном холестазе неплохой эффект можно получить иногда после плазмафереза, лимфосорбции (1—3 сеанса).
